Ферменты разделяют на конститутивные и нндуцибельные. Конститутивными называются ферменты, синтезируемые с одинаковой скоростью и содержащиеся в клетке в постоянной концентрации независимо от условий роста культуры. К таковым относятся ферменты гликолиза. Индуцибельными называются ферменты, синтезируемые только в ответ на присутствие в среде необходимого для клетки субстрата - индуктора. Количество индуцибельных ферментов может изменяться в зависимости от конфетных физиологических условий роста.
Регуляция синтеза ферментов осуществляется путем индукции, репрессии и аттенуации.
Индукция синтеза ферментов. Индуцибельный синтез ферментов в клетке идет только до тех пор, пока в среде присутствует индуктор. При этом фермент синтезируется заново и одновременно в большинстве клеток культуры. Индукторами синтеза ферментов являются многие субстраты, служащие питательными веществами. К нндуцибельным относится большинство гидролитических ферментов.
Классическим примером индуцибельных ферментов является {3-галакхозндаза Е. coli, гидролизующая лактозу на галактозу и глюкозу. При выращивании Е. coli на среде с лактозой клетки этой бактерии содержат множество молекул р-галактозидазы. При замене лактозы глюкозой в клешах обнаруживаются единичные молекулы этого фермента. Если клетки снова поместить в среду, содержащую только лактозу, то в них происходит интенсивный синтез р-галак- тозидазы ~ тщуцибелъный фермент.
Одновременно с р-галактозидазой в клетках Е. coli синтезируется р-галактозвищермеаза, необходимая для переноса яашшы в клетки, и ?Ггаяamp;ктозвдграисацегшт2за, физиологическая роль шторой пока не выяснена.
Механизм индукции р-галактозидазы был изучен французскими учеными Ф. Жакобом и Ж. Моно, разработавшим к модель опероиа. Генетическими элементами модели оперена являются, регуляторный ген, оператор, набор структурных генов, промоторный участок. Они локализованы в хромосоме и все вместе, за исключением регуляторного гена, образуют одну' функциональную единицу - оперон. Так, лактозный оперой (рис.7.9) Е. coli включает' три структурных гена - z, у, а, кодирующие* синтез трех ферментов - Р-галактозидазы, р-галажггозидпермеазы и р-тно- галактозид-трансацетилазы. Рядом расположен ген-оператор (О), который выполняет функцию пускового механизма, контролируя работу структурных генов. По соседству с ним находится промотор (Р) для связывания РНК-полимеразы и инициации транскрипции. Регуляторный ген (R) кодирует синтез репрессора. Репрессор - аллостерический белок, один центр его служит для связывания с оператором, другой - с субстратом-индуктором (в данном примере с аллолактозой, которая образуется из лактозы и является фактическим индуктором р-галактозидазы).
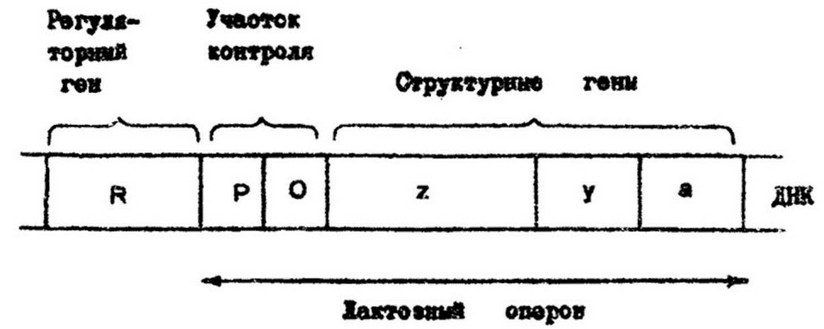
Рис. 7.9. Карта лактозного оперона Е. coli
При отсутствии в среде лактозы репрессор активен в свободном состоянии и, связываясь с оператором, предотвращает возможность присоединения РНК-полимеразы к промотору и в результате структурные гены не транскрибируются в мРНК и синтез ферментов не происходит. Когда в клетку поступает лактоза., го образовавшаяся аллолактоза связывается с белком-репрессором. Конформация белка при этом меняется так, что приводит к разрыву связи с оператором. При свободном операторе начинаются транскрипция мРНК и синтез ферментов катаболизма лактозы Аналогичным путем регулируется синтез и других индуцнбельных ферментов.
Катаболитная репрессия. Синтез ферментов регулируется не только путем индукции, но и путем репрессии. Различают два вида
репрессии: катаболитную и репрессию конечным продуктом.
Наличие катаболитной репрессии было установлено при изучении явления диауксии, обнаруженной Моно при анализе роста Вас. subtills на среде, содержащей глюкозу и арабинозу в качестве источника энергии и углерода. Вначале клетки потребляли только глюкозу, а затем по ее исчерпании - арабинозу. Такое же явление наблюдалось и у Е. coli: активно усваиваемая глюкоза подавляла потребление других сахаров. Это явление было названо катаболитной репрессией. Сущность ее заключается в том, что легкоусваиваемый клеткой источник энергии подавляет синтез ферментов катаболизма других менее доступных субстратов. Так, на среде, содержащей глюкозу и лактозу, клетки Е. coli сначала потребляют глюкозу. Несмотря на наличие в среде индуктора лактозного оперона (лактозы) структурные гены не функционируют и ферменты катаболизма лактозы не синтезируются. Транскрипция генов лактозного оперона начинается при крайне низкой концентрации глюкозы в среде. Изучение механизма катаболитной репрессии показало, что она связана с уровнем содержания в клетках циклического АМФ, который необходим для транскрипции лактозного оперона. Циклический АМФ (эффектор) связывается с белковым активатором катаболизма (БАК), или катаболитным активатором, которым является позитивно-регуляторный аллостерический белок, но в отсутствие циклического АМФ он неактивен. Образующийся комплекс (цАМФ + БАК) взаимодействует с участком промоторной области лактозного оперона и обеспечивает присоединение к промотору РНК- полимеразы и инициацию транскрипции (рис.7.10). Этот тип регуляции получил название позитивной.
Катаболтная репрессия функций лактозного оперона глюкозой при наличии в среде лактозы может быть снята при внесении в среду циклического АМФ. Это соединение выполняет только регуляторную функцию. Наличие в клетках глюкозы понижает внутриклеточную концентрацию циклического АМФ. Известно, что содержание его в клетках определяется активностью адеиилатциклазы - фермента, катализирующего образование цАМФ из АТФ:
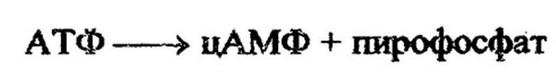
Аденилатциклаза связана с цитоплазматической мембраной и активна в том случае, если компоненты системы транспорта глюкозы в клетку фосфорилированы. Обычно это имеет место тогда, когда в клетке глюкозы нет или низкое содержание и ее надо транспортировать через мембрану. При наличии же глюкозы в достаточном для клетки количестве степень фосфорилирования системы транспорта снижается за счет фосфорилирования молекул поступающей глюкозы и соответственно снижается активность адеиилатциклазы. Это приводит к уменьшению количества цАМФ и развитию в клетке катаболитной репрессии.
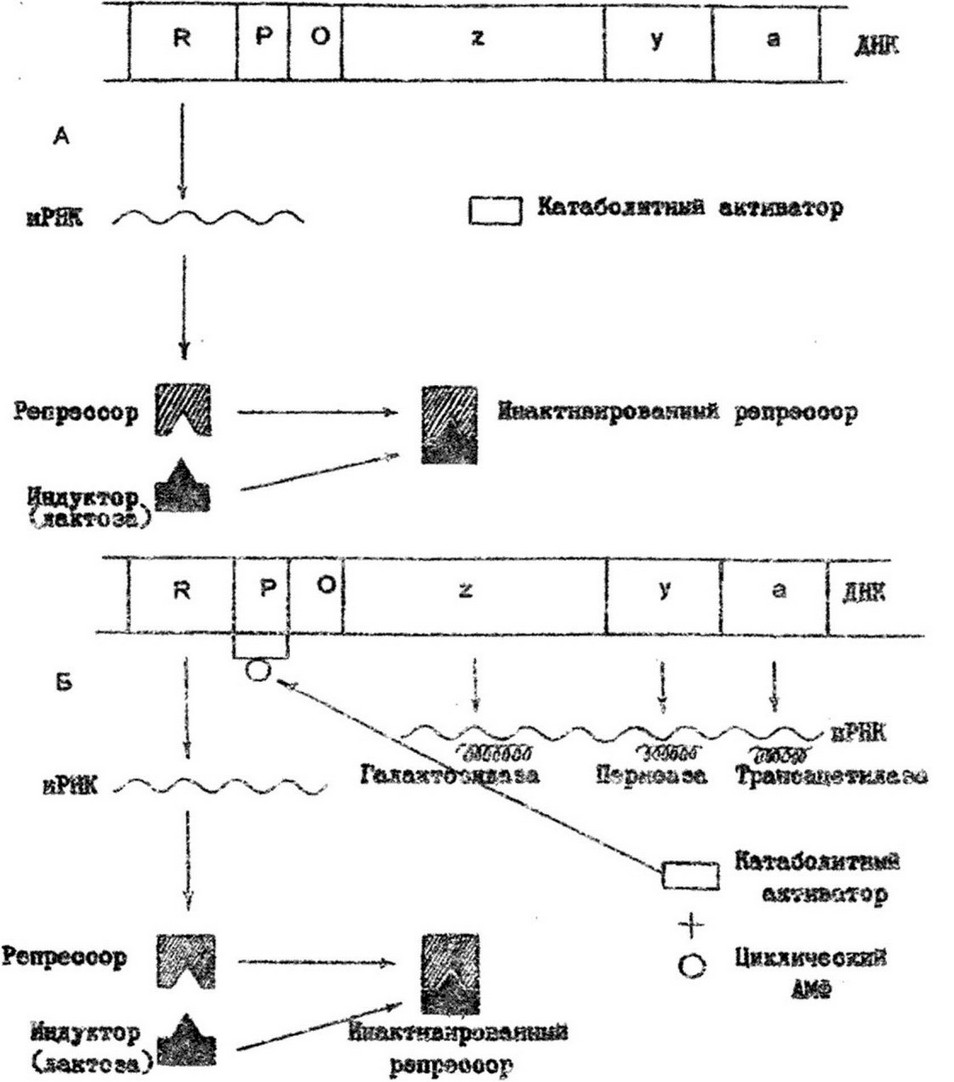
Рис. 7.10. Регуляция синтеза фермента на уровне транскрипции. А - ген-регулятор /Л/ образует
репрессорный белок, связывающийся с оператором /О/ и закрывающий промотор /Р/; транскрипции структурных генов /z,y, а/ не происходит; Б - в присутствии индуктора образуется неактивный репрессор, не способный связываться с оператором; промотор открыт, происходит транскрипция.
Таким образом, глюкоза сама по себе не вызывает катаболитную репрессию, а через систему своего транспорта регулирует концентрацию цАМФ. Последний, связываясь с
катаболитным активатором, образует универсальный комплекс, индуцирующий синтез ферментов, находящихся под контролем катаболитной репрессии.
Изучение работы лактозного оперона показало, что регуляция его функций может быть двоякой: негативной и позитивной. Негативная регуляция осуществляется на уровне взаимодействия репрессора с индуктором, позитивная - на уровне взаимодействия системы белкового катаболитного активатора и циклического АМФ с промотором.
У триптофанового оперона открыт еще один регуляторный компонент - аттенюатор (от аттенуация - ослабление). Это участок ДНК, который регулирует транскрипцию триптофанового оперона и синтез триптофана.
В триптофановом опероне промотор и оператор отделены от структурных генов участком длиной 166 нуклеотидов. Это - лидерная последовательность, которая в свою очередь содержит ослабляющую последовательность, или аттенюатор. Он расположен между 123-150 нуклеотидами. На аттенюаторе около 90 % РНК- полимераз прекращают транскрипцию, не доходя до структурных генов. Это имеет место при высокой концентрации триптофана в клетке. Понижение уровня триптофана приводит к ослаблению действия аттенюатора и РНК-полимера за осуществляет полную транскрипцию оперона. В результате осуществляется синтез ферментов триптофанового пути и образование продукта (триптофана). Отсюда был сделан вывод, что транскрипция триптофанового оперона регулируется участком контролируемой терминации, называемым аттенюатором.
Репрессия конечным продуктом. Синтез большинства ферментов анаболизма находится под контролем механизма репрессии конечным продуктом. Сущность его состоит в том, что по мере накопления в клетке конечного продукта биосинтеза снижается скорость синтеза ферментов, катализирующих его образование. Например, если выращивать кишечную палочку на минимальной среде, то ферменты, участвующие в биосинтезе аргинина, находится в необходимом для клетки количестве и аргинин синтезируется по мере надобности. Если же в среду внести готовый аргинин (20 мг/л),
то синтез ферментов, участвующих в его образовании, прекращается (репрессируется).
Изучение механизма репрессии синтеза ферментов конечным продуктом показало, что структурные гены многих ферментов анаболизма организованы в хромосоме также в виде оперона. Когда конечный продукт накапливается в клетках выше нужного уровня, он взаимодействует с белком репрессором, активируя его. Активированный репрессор присоединяется к операторному участку и блокирует инициацию транскрипции мРНК. Синтез ферментов прекращается. Таким образом, конечный продукт действует как компрессор. При его отсутствии репрессор неактивен. Хотя гены, кодирующие биосинтез ферментов одного метаболического пути, могут быть расположены в разных участках хромосомы, все равно, образование данных ферментов регулируется одним конечным продуктом. Так, в клетках кишечной палочки гены, кодирующие ферменты биосинтеза аргинина, локализованы в разных участках хромосомы, но все они репрессируются одним и тем же комплексом — белок-репрессор + аргинин. Более сложной является регуляция синтеза ферментов путем рапрессии конечным продуктом в разветвленных путях анаболизма. Как и при регуляции активности, синтез ферментов регулируется так, что каждый конечный продукт может репрессировать образование ферментов только «своего» пути биосинтеза. В разветвленных путях биосинтеза может иметь место и мультиферментная репрессия, аналогичная таковой регуляции активности ферментов.
