Этиология. Среди причин врожденных пороков сердца можно выделить следующие: 1) хромосомные нарушения — 5%; 2) мутация одного гена — 2—3%; 3) факторы среды (алкоголизм родителей, краснуха, лекарственные препараты и др.) — 1—2%; 4) полигенно-мультифакториальное наследование — 90%.
При различных хромосомных аберрациях возникают количественные и структурные мутации хромосом. Аберрации крупных и средних хромосом в большинстве своем не совместимы с жизнью. Аберрации, совместимые с жизнью, проявляются различными клиническими синдромами множественных аномалий хромосом, которые включают в себя и врожденные пороки сердца (ВПС). Пороки сердца, ассоциирующиеся с хромосомными аномалиями, всегда являются частью синдрома полисистемных пороков развития, а не изолированными дефектами. Скрининг больных с ВПС на хромосомные аномалии не имеет особого значения, если поражение сердца не сочетается с другими пороками развития. При трисомии аутосом дефекты перегородок (дефект межпредсердной и межжелудочковой перегородок, их сочетание) оказынаются самыми частыми. ВПС при аномалиях половых хромосом бывают значительно реже, чем при три- сомиях аутосом. Только 10 —16% женщин с кариотипом 45Х имеют порок развития сердечно-сосудистой системы, чаще всего — коарктацию аорты или дефект межжелудочковой перегородки (ДМЖП).
Около 2 % ВПС обусловлены мутациями единичных генов. Так же как в случаях аномалий хромосом, большинство ВПС, связанных с мутациями единичных генов, сочетается с аномалиями развития других органов. При многих формах патологии, наследуемых в соответствии с простыми менделевскими закономерностями, пороки развития сердечно-сосудистой системы являются частью синдрома с аутосомно-доминантным (синдромы Холта—Орама, Нунана, Крузона, Марфана и др.), аутосомно- рецессивным (синдромы Гурлер, Картагенера, Карпентера, Эллиса-ван-Кревельда, Робертса и др.) типами наследования или сцепленных с Х-хромосомой (синдромы Аазе, Элерса—Данло V типа, Гольтца, мукополисахаридоз II типа — синдром Гунтера и др.). Необходимо подчеркнуть ряд общих принципов для
этих синдромов. Во-первых, большинству синдромов свойственна вариабельная экспрессивность: поражение сердечно-сосудистой системы у индивидуумов с данным'синдромом может варьировать от легкой до тяжелой степени. Как правило, вариабельность экспрессии гена у представителей одной родословной выражена в меньшей степени, чем межсемейная. Во-вторых, у некоторых индивидуумов, почти наверняка имеющих соответствующий генотип, сколько-нибудь выраженных фенотипических аномалий может не быть (т. е. непенетрантность). Степень пенетрантности мутантного гена зависит также от критериев, на которые опираются при поиске признаков присутствия данного гена.
К повреждающим факторам внешней с р е- д ы, способствующим формированию ВПС, относятся воздействие рентгеновского излучения на организм женщины в первом триместре беременности, ионизирующей радиации, некоторых лекарственных препаратов, инфекционных и вирусных агентов, алкоголя и др. [Бочков Н. П., 1989J. Образующиеся в результате пороки в органах по рекомендации Международной рабочей группы кардиологов следует обозначать эмбриопатией [Spran- ger J. et al., 1982]. Так, у женщин с ревматизмом в 25 % случаев рождались дети с ВПС [Зайченко С. И. и др., 1989]. Согласно основным принципам тератологии оценка тератогенного эффекта различных повреждающих факторов проводится с учетом механизма воздействия, времени совпадения тератогенного воздействия с периодами интенсивного формирования органов и систем плода. Необходимо учитывать также эффект дозы, генетическую предрасположенность индивидуумов к неблагоприятным реакциям на пусковое воздействие среды (иногда именно на определенный препарат) и к формированию пороков развития вообще и сердечно-сосудистой системы в частности.
Существенная опасность нарушения органогенеза н формирования врожденных пороков развития доказана лишь для небольшого числа лекарств. Тератогенным действием на сердечнососудистую систему обладают: алкоголь (чаще формируются ДМЖП, открытый артериальный проток, дефект межпредсердной перегородки), амфетамины (образуются ДМЖП, транспозиция магистральных сосудов), противосудорожные препараты — ги- дантоин (формируются стеноз легочной артерии и аорты, коарктация аорты, открытый артериальный проток) и триметадион (транспозиция магистральных сосудов, тетрада Фалло, гипоплазия левого сердца), литий (аномалия Эбштейна, атрезия трехстворчатого клапана, дефект межпредсердной перегородки), прогестагены (тетрада Фалло, сложные ВПС) [Sipek А., 1989].
Среди токсических веществ, способствующих возникновению ВПС, этиловому спирту принадлежит ведущая роль. Воздействие алкоголя на плод приводит к рождению ребенка с эмбриофеталь- ным алкогольным синдромом. В последние годы интерес к изучению этого синдрома усилился в связи с учащением случаев хронического алкоголизма среди женщин. В США из 800 —
2400 новорожденных один имеет эмбриофетальный алкогольный синдром, в некоторых европейских странах — один из 200— 600 новорожденных. У матерей, страдающих алкоголизмом, поражается 30 % детей, из них ВПС встречаются в 30—49 % случаев [Таболин В. А., Урывчиков Г. А., 1986]. Алкоголь является причиной ВПС в 1% случаев [Kramer Н. et al., 1987]. Особо выраженное тератогенное действие на сердечно-сосудистую систему он оказывает в период интенсивного формирования органов (критический период развития) — в первые 3 мес беременности.
Одним из факторов среды, приводящим к рождению ребенка с ВПС, является перенесенная во время беременности краснуха [Парийская Т. В., Гикавый В. И., 1989]. Частота врожденной краснухи как причины ВПС составляет 1,3 [Kramer Н. et al., 1987] —2,4% [Emerit J. et. al., 1967]. Классический синдром врожденной краснухи включает триаду наиболее часто встречающихся аномалий развития — катаракту или глаукому, пороки сердца и глухоту. Кроме этого, имеются пороки развития нервной системы (микроцефалия), нарушение развития скелета, черепа, многие дети отстают в физическом и умственном развитии. Из неонатальных проявлений врожденной краснухи следует помнить о тромбоцитопенической пурпуре, гепатоспленомегалии, гепатите, гемолитической анемии, пневмонии, поражении трубчатых костей. Из ВПС у живорожденных детей с врожденной краснухой находят открытый артериальный проток (ОАП), транспозицию магистральных сосудов (ТМС), общий артериальный ствол, атрезию или пороки развития атриовентрикулярных и полулунных клапанов, открытый атриовентрикулярный каиал (АВК), тетраду Фалло (5—10% всех ВПС), ДМЖП (5%), стеноз легочной артерии.
Чаще всего для объяснения типа наследования при ВПС прибегают к полигенно-мультифакториальной модели, основными признаками которой являются: 1) риск повторного Поражения возрастает с увеличением числа больных среди родственников I степени; 2) если популяционные данные свидетельствуют о половых различиях частоты нарушения, родственники реже болеющего пола чаще оказываются пораженными; 3) чем более тяжелый порок, тем выше риск его повторения; 4) риск повторения порока у родственников I степени больного индивидуума равен, примерно, корню квадратному из частоты патологии в популяции [Edwards J. Н., 1960]. Экспериментальные данные свидетельствуют о том, что распространенные ВПС имеют генетическую основу, которая не является результатом мутаций единичных генов, а согласуется с муль- тифакториальным наследованием. Тем не менее, несомненно, существует генетическая гетерогенность, и определенные формы ВПС, вероятно, обусловлены мутациями единичных генов.
Помимо этиологических факторов, следует выделять факторы риска рождения ребенка с ВПС, которыми являются
возраст матери, эндокринные нарушения у супругов, токсикозы в I триместре и угрозы прерывания беременности, мертворожде- ния в анамнезе, наличие других детей с врожденными пороками развития, прием женщиной эндокринных препаратов для сохранения беременности и др.
Дать количественную оценку риска рождения ребенка с ВПС может только генетик, но оценить качественно риск как значительный, умеренный или малый должен уметь каждый врач.
При м е д и к о - г е н е т и ч е с к о м консультировании по поводу хромосомных аномалий, ассоциирующихся с ВПС, необходимо учитывать, что повышенная вероятность иметь потомство с хромосомной аномалией характерна для следующих ситуаций: 1) пожилой возраст матери; 2) сбалансированная транслокация, инверсия или другая аномалия хромосом у одного из родителей; 3) наличие в семье ребенка с хромосомной аномалией, особенно с трисомией аутосом. Таким образом, когда ВПС сочетается с аномалиями хромосом, при последующих беременностях надо ставить вопрос об амниоцентезе с целью пренатальной диагностики. Если у пробанда диагностирована трисомия, риск развития ВПС у ребенка равен 1 %, при наличии у родителя сбалансированной транслокации — 2—10%, но в случае патологии у пробанда, возникшей de novo, риск, по-видимому, не увеличен [Элиас Ш., Янаги Р., 1985].
При медико-генетическом консультировании по поводу менде- лирующих нарушений супружеским парам, относящимся к группе риска, необходимо сообщить об относительно высокой вероятности наследования мутантного гена: 50% для аутосом но-доминантных нарушений (наличие ВПС у родственников I степени — родители, братья, сестры) и 25 % для аутосомно-рецессивных (ВПС у родственников II степени — дед, бабка, дяди и тетки), при наличии ВПС у родственников III степени (двоюродные братья и сестры) вероятность составляет 13%. Однако из-за вариабельности экспрессии и пенетрантности вероятность рождения ребенка с клинически выраженной патологией часто несколько ниже. При возможности следует предлагать родителям проведение пренатальной диагностики.
При мультифакториальных ВПС шанс рождения здорового ребенка в семье, где уже есть ребенок с ВПС, составляет 97 %. При медико-генетическом консультировании необходимо учитывать риск возникновения ВПС у сибса: при тетраде Фалло он составляет 2,5%, при ТМС — 2%, при общем артериальном стволе — 1 %, при ДМЖП — 3 %, при коарктации аорты — 2 %. При этом риск развития патологии выше, если пороком страдает мать, а не отец ребенка.
Распространенность ВПС у детей достаточно высока и составляет 30 % от числа всех врожденных пороков развития. При этом ВПС могут быть: основной причиной смерти; фактором, усугубляющим течение основного заболевания; случайной находкой на аутопсии, не влиявшей на танатогенез. Частота выявления
ВПС, по данным различных авторов, колеблется от 3,23 до 8 на 1000 живорожденных детей [McMahon et al., 1953; Kerrebyjn В., 1966]. Показано, что основное число детей с ВПС умирает на первом году жизни (50—90 %) и большинство из них — в период новорожденности (20—43%) или в первые 6 месяцев жизни (до 80 %) [Бураковский В. И., Константинов Б. А., 1970; Чернова М. П., 1973; Бураковский В. И. и др., 1989; Keth J.,1978]. После первого года жизни смертность от ВПС резко снижается, и в возрасте от 1 года до 15 лет погибает не более 5% детей [ВОЗ, 1971].
Представляет интерес характер ВПС, от которых умирают дети в различном возрасте [Boughman J. A. et al., 1987]. Так, на аутопсии у детей первой недели жизни преобладают синдром гипоплазии левого желудочка, ТМС, тетрада Фалло, стеноз и атрезия легочной артерии, коарктация аорты, ДМЖП. Частота таких ВПС, как ДМЖП, дефект межпредсердной перегородки (ДМПП), в этом возрасте относительно небольшая. На аутопсии у детей в возрасте от 1 мес до 1 года наиболее часто встречались ДМЖП, ТМС, АВК, коарктация аорты, тетрада Фалло, пороки с обструкцией левого желудочка. В группе детей первого года жизни из-за большей распространенности тяжелых ВПС реже встречаются ОАП, стеноз легочной артерии, стеноз аорты. С увеличением возраста меньше остается в живых детей со сложными и комбинированными ВПС. Структура ВПС у подростков и взрослых имеет свои особенности, именно в этом возрасте удается проследить естественное течение многих ВПС. Как правило, это умеренные клапанные дефекты, небольших или средних размеров ДМЖП, ДМПП, ОАП, коарктация аорты. К другим ВПС относятся корригированная ТМС, аномалия Эбштейна, тетрада Фалло и ВПС с высокой легочной гипертензией, которые не были устранены хирургическим путем в детстве до развития такого серьезного осложнения. Примерно у 23—30 % детей с ВПС имеются сопутствующие аномалии желудочно-кишечного тракта, мочеполовой и костной систем, ЦНС [Menashe V. et al., 1967; Moller J., Neal W., 1981]. Наиболее высокая частота экстракардиальных пороков развития отмечается у больных с комбинированными септальными дефектами (74%), ОАП (59%), ДМЖП (58%), наиболее низкая — при фиброэластозе и ТМС [Landtman В., 1971].
Классификация. Создание единой классификации ВПС имеет определенные трудности в связи с огромным количеством разновидностей пороков (по М. Lev—более 200), разных принципов, которые могут быть положены в ее основу. В Институте сердечно-сосудистой хирургии им. А. Н. Бакулева АМН СССР разработана классификация, в которой ВПС распределены с учетом анатомических особенностей и гемодинамических нарушений. Классификация более удобна для кардиохирургов и менее — для практических врачей, которые не всегда имеют возможность оценить топическую ситуацию.
Не считая некоторых различий в отдельных классификациях, клинически значимые формы ВПС в зависимости от гемодина- мических нарушений можно подразделить на следующие группы:
B.C. Morgan (1978) предлагает классификацию, основанную на доступных инструментальных и клинических методах исследования. Первоначально врач определяет наличие цианоза, что можно выявить как при осмотре больного в покое или при нагрузке в случае невыраженного цианоза (плач, физическая нагрузка), так и с помощью определения Ра02 и/или гематокри- та. Далее уточняется состояние малого круга кровообращения (гипо- или гиперволемия) с помощью аускультации (характер II тона над легочной артерией) и рентгенографии сердца. Эти данные сопоставляются с результатами электрокардиографического обследования, выявляющего характер гипертрофии и перегрузки камер сердца.
I. Пороки сердца с цианозом
а) гипертрофия правого желудочка (тяжелый стеноз легочной артернй, атрезня легочной артернн с или без ДМЖП);
б) гипертрофия левого желудочка (атрезня трехстворчатого клапана, атрезия легочной артерии с гипоплазией правого желудочка);
в) комбинированная гипертрофия правого и левого желудочков (ТМС со стенозом легочной артерии, общий артериальный ствол с гипоплазией легочных артерий).
а) гипертрофия правого желудочка (ДМПП, все пороки с левоправым шунтом с легочной гипертензией — ОАП, ДМЖП, ДМПП);
б) гипертрофия левого желудочка (ОАП, ДМЖП, артерновенозная фистула).
II Пороки сердца без цианоза
а) гипертрофия правого желудочка (коарктация аорты, стеноз митрального клапана);
б) гипертрофия левого желудочка (коарктация аорты, стеноз аорты, фнбро- эластоз эндокарда).
а) гипертрофия правого желудочка (атрезия аорты, синдром гипоплазии левого желудочка, тотальный аномальный дренаж легочных вен, ТМС);
б) комбинированная гипертрофия правого и левого желудочков (ТМС, единый желудочек, атрезия трехстворчатого клапана с ТМС).
В практической деятельности врачам удобно пользоваться простым делением ВПС на 3 группы: 1) ВПС бледного типа с артериовенозным шунтом (ДМЖП, ДМПП, ОАП); 2) ВПС синего типа с веноартериальным сбросом (ТМС, тетрада Фалло, атрезия трехстворчатого клапана); 3) ВПС без сброса, но с препятствием к выбросу крови из желудочков (стенозы легочной артерии и аорты, коарктация аорты). Такое деление охватывает 9 наиболее распространенных ВПС.
ю
Не случайно большинство предложенных классификаций ВПС содержит оценку состояния легочного кровотока, так как проблема легочной гипертензии в учении о ВПС имеет огромное самостоятельное значение. В клинике легочная гипертензия определяет выраженность таких симптомов, как одышка, недостаточность кровообращения, гипотрофия, склонность к рецидивирующим пневмониям. Неумение врача увидеть, правильно и своевременно оценить выраженность легочной гипертензии нередко стоит жизни больному.
Началом развития легочной гипертензии является повышение систолического давления в легочной артерии более 30 мм рт. ст. В зависимости от того, в каком участке сосудистого русла легких наблюдается первоначальный подъем давления, различают пре- капиллярную (артериальную) гипертензию — увеличение сопротивления в артериолах и мелких артериях — и посткапиллярную (венозную) — при повышении давления в левом предсердии и легочных венах. У больных с ВПС и артериовенозным сбросом наблюдается артериальная прекапиллярная легочная гипертензия, у больных с миокардитами, кардиомиопатиями и стенозом аорты — посткапиллярная.
Существует много классификаций легочной гипертензии. На практике оказалась наиболее удачной классификация, разработанная в Институте сердечно-сосудистой хирургии им. А. Н. Бакулева [Бураковский В. И. и др., 1975], которая основана на величине давления в легочной артерии, сброса крови и общелегочного сопротивления в соотношении с показателями большого круга кровообращения (табл. 1). Согласно этой классификации больных с легочной гипертензией делят на четыре группы. Больные 1а подгруппы не имеют выраженных нарушений гемодинамики, нуждаются в наблюдении кардиоревматолога. В отношении больных 16 подгруппы и II группы уже должен ставиться вопрос
о хирургическом лечении. Легочная гипертензия в этих группах носит в основном функциональный характер. В III группе морфологические изменения настолько выражены, что после коррекции порока давление в легочной артерии не снижается до нор-
Таблица 1. Классификация легочной гипертензии | Бураковский В. И. и др., 1975|
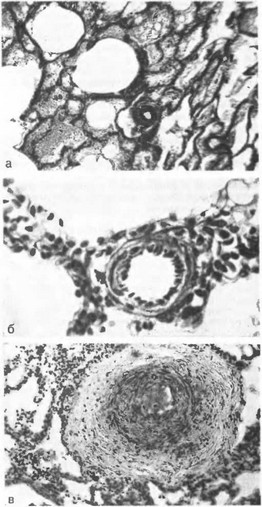
Рис. 1. Стадии легочной гипертензии по D. Heath, J. Edwards (1958)
а — гипертрофия медии артерии на уровне респираторной бронхиолы (I стадия); Окраска по ван-Гнзону с докраской фукселином. Ув. 100; б — клеточная пролиферация интимы артерии на уровне альвеолярного хода (II стадия); в — гиперплазия и фиброз интимы (III стадия);
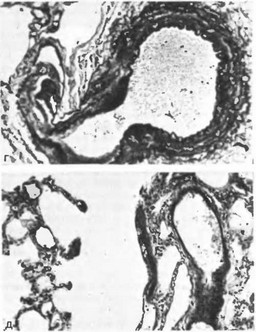
Pfcc. 1. Продолжение.
г — ангиоматозные структуры в просветах сосудов (IV стадия); д — истонченная медия (V стадия).
мального уровня; это указывает на преобладание органического компонента. В IV группе гипертензия в основном обусловлена изменениями структуры легочных сосудов и носит необратимый характер, хирургическое вмешательство в связи с этим не показано. В. И. Бураковский и соавт. (1975) предлагают выделять легочную гипертензию трех степеней: I степени — начальная — давление в легочной артерии составляет 30—50 % от аортального, II степень — умеренная — 51—70%, III степень—высокая — свыше 70 %.
Легочная гипертензия проходит 3 фазы. 1. Гиперволемиче- ская — результат несоответствия сосудистого русла объему протекающей крови, она встречается у детей первых месяцев и лет жизни. При этом сосуды легких переполнены кровью, но не возникает защитный рефлекс в виде спазма, чем и объясняются тяжелое клиническое течение, большая величина сброса. Давле
ние в легочной артерии может быть нормальным или умеренно повышенным, общелегочное сопротивление не изменено. 2. Смешанная фаза - возникает спазм сосудов в ответ на гиперволе- мию (защитный рефлекс) — сопровождается повышением как давления в легочной артерии, так и легочного сопротивления, что способствует уменьшению левоправого сброса. У детей до
Для прогноза и показаний к операции имеет значение оценка морфологической структуры легочных сосудов, которая доступна при жизни благодаря биопсии легкого-D. Heath, J. Edwards (1958) выделили 5 стадий изменений легочных сосудов (рис. 1):
При различных хромосомных аберрациях возникают количественные и структурные мутации хромосом. Аберрации крупных и средних хромосом в большинстве своем не совместимы с жизнью. Аберрации, совместимые с жизнью, проявляются различными клиническими синдромами множественных аномалий хромосом, которые включают в себя и врожденные пороки сердца (ВПС). Пороки сердца, ассоциирующиеся с хромосомными аномалиями, всегда являются частью синдрома полисистемных пороков развития, а не изолированными дефектами. Скрининг больных с ВПС на хромосомные аномалии не имеет особого значения, если поражение сердца не сочетается с другими пороками развития. При трисомии аутосом дефекты перегородок (дефект межпредсердной и межжелудочковой перегородок, их сочетание) оказынаются самыми частыми. ВПС при аномалиях половых хромосом бывают значительно реже, чем при три- сомиях аутосом. Только 10 —16% женщин с кариотипом 45Х имеют порок развития сердечно-сосудистой системы, чаще всего — коарктацию аорты или дефект межжелудочковой перегородки (ДМЖП).
Около 2 % ВПС обусловлены мутациями единичных генов. Так же как в случаях аномалий хромосом, большинство ВПС, связанных с мутациями единичных генов, сочетается с аномалиями развития других органов. При многих формах патологии, наследуемых в соответствии с простыми менделевскими закономерностями, пороки развития сердечно-сосудистой системы являются частью синдрома с аутосомно-доминантным (синдромы Холта—Орама, Нунана, Крузона, Марфана и др.), аутосомно- рецессивным (синдромы Гурлер, Картагенера, Карпентера, Эллиса-ван-Кревельда, Робертса и др.) типами наследования или сцепленных с Х-хромосомой (синдромы Аазе, Элерса—Данло V типа, Гольтца, мукополисахаридоз II типа — синдром Гунтера и др.). Необходимо подчеркнуть ряд общих принципов для
этих синдромов. Во-первых, большинству синдромов свойственна вариабельная экспрессивность: поражение сердечно-сосудистой системы у индивидуумов с данным'синдромом может варьировать от легкой до тяжелой степени. Как правило, вариабельность экспрессии гена у представителей одной родословной выражена в меньшей степени, чем межсемейная. Во-вторых, у некоторых индивидуумов, почти наверняка имеющих соответствующий генотип, сколько-нибудь выраженных фенотипических аномалий может не быть (т. е. непенетрантность). Степень пенетрантности мутантного гена зависит также от критериев, на которые опираются при поиске признаков присутствия данного гена.
К повреждающим факторам внешней с р е- д ы, способствующим формированию ВПС, относятся воздействие рентгеновского излучения на организм женщины в первом триместре беременности, ионизирующей радиации, некоторых лекарственных препаратов, инфекционных и вирусных агентов, алкоголя и др. [Бочков Н. П., 1989J. Образующиеся в результате пороки в органах по рекомендации Международной рабочей группы кардиологов следует обозначать эмбриопатией [Spran- ger J. et al., 1982]. Так, у женщин с ревматизмом в 25 % случаев рождались дети с ВПС [Зайченко С. И. и др., 1989]. Согласно основным принципам тератологии оценка тератогенного эффекта различных повреждающих факторов проводится с учетом механизма воздействия, времени совпадения тератогенного воздействия с периодами интенсивного формирования органов и систем плода. Необходимо учитывать также эффект дозы, генетическую предрасположенность индивидуумов к неблагоприятным реакциям на пусковое воздействие среды (иногда именно на определенный препарат) и к формированию пороков развития вообще и сердечно-сосудистой системы в частности.
Существенная опасность нарушения органогенеза н формирования врожденных пороков развития доказана лишь для небольшого числа лекарств. Тератогенным действием на сердечнососудистую систему обладают: алкоголь (чаще формируются ДМЖП, открытый артериальный проток, дефект межпредсердной перегородки), амфетамины (образуются ДМЖП, транспозиция магистральных сосудов), противосудорожные препараты — ги- дантоин (формируются стеноз легочной артерии и аорты, коарктация аорты, открытый артериальный проток) и триметадион (транспозиция магистральных сосудов, тетрада Фалло, гипоплазия левого сердца), литий (аномалия Эбштейна, атрезия трехстворчатого клапана, дефект межпредсердной перегородки), прогестагены (тетрада Фалло, сложные ВПС) [Sipek А., 1989].
Среди токсических веществ, способствующих возникновению ВПС, этиловому спирту принадлежит ведущая роль. Воздействие алкоголя на плод приводит к рождению ребенка с эмбриофеталь- ным алкогольным синдромом. В последние годы интерес к изучению этого синдрома усилился в связи с учащением случаев хронического алкоголизма среди женщин. В США из 800 —
2400 новорожденных один имеет эмбриофетальный алкогольный синдром, в некоторых европейских странах — один из 200— 600 новорожденных. У матерей, страдающих алкоголизмом, поражается 30 % детей, из них ВПС встречаются в 30—49 % случаев [Таболин В. А., Урывчиков Г. А., 1986]. Алкоголь является причиной ВПС в 1% случаев [Kramer Н. et al., 1987]. Особо выраженное тератогенное действие на сердечно-сосудистую систему он оказывает в период интенсивного формирования органов (критический период развития) — в первые 3 мес беременности.
Одним из факторов среды, приводящим к рождению ребенка с ВПС, является перенесенная во время беременности краснуха [Парийская Т. В., Гикавый В. И., 1989]. Частота врожденной краснухи как причины ВПС составляет 1,3 [Kramer Н. et al., 1987] —2,4% [Emerit J. et. al., 1967]. Классический синдром врожденной краснухи включает триаду наиболее часто встречающихся аномалий развития — катаракту или глаукому, пороки сердца и глухоту. Кроме этого, имеются пороки развития нервной системы (микроцефалия), нарушение развития скелета, черепа, многие дети отстают в физическом и умственном развитии. Из неонатальных проявлений врожденной краснухи следует помнить о тромбоцитопенической пурпуре, гепатоспленомегалии, гепатите, гемолитической анемии, пневмонии, поражении трубчатых костей. Из ВПС у живорожденных детей с врожденной краснухой находят открытый артериальный проток (ОАП), транспозицию магистральных сосудов (ТМС), общий артериальный ствол, атрезию или пороки развития атриовентрикулярных и полулунных клапанов, открытый атриовентрикулярный каиал (АВК), тетраду Фалло (5—10% всех ВПС), ДМЖП (5%), стеноз легочной артерии.
Чаще всего для объяснения типа наследования при ВПС прибегают к полигенно-мультифакториальной модели, основными признаками которой являются: 1) риск повторного Поражения возрастает с увеличением числа больных среди родственников I степени; 2) если популяционные данные свидетельствуют о половых различиях частоты нарушения, родственники реже болеющего пола чаще оказываются пораженными; 3) чем более тяжелый порок, тем выше риск его повторения; 4) риск повторения порока у родственников I степени больного индивидуума равен, примерно, корню квадратному из частоты патологии в популяции [Edwards J. Н., 1960]. Экспериментальные данные свидетельствуют о том, что распространенные ВПС имеют генетическую основу, которая не является результатом мутаций единичных генов, а согласуется с муль- тифакториальным наследованием. Тем не менее, несомненно, существует генетическая гетерогенность, и определенные формы ВПС, вероятно, обусловлены мутациями единичных генов.
Помимо этиологических факторов, следует выделять факторы риска рождения ребенка с ВПС, которыми являются
возраст матери, эндокринные нарушения у супругов, токсикозы в I триместре и угрозы прерывания беременности, мертворожде- ния в анамнезе, наличие других детей с врожденными пороками развития, прием женщиной эндокринных препаратов для сохранения беременности и др.
Дать количественную оценку риска рождения ребенка с ВПС может только генетик, но оценить качественно риск как значительный, умеренный или малый должен уметь каждый врач.
При м е д и к о - г е н е т и ч е с к о м консультировании по поводу хромосомных аномалий, ассоциирующихся с ВПС, необходимо учитывать, что повышенная вероятность иметь потомство с хромосомной аномалией характерна для следующих ситуаций: 1) пожилой возраст матери; 2) сбалансированная транслокация, инверсия или другая аномалия хромосом у одного из родителей; 3) наличие в семье ребенка с хромосомной аномалией, особенно с трисомией аутосом. Таким образом, когда ВПС сочетается с аномалиями хромосом, при последующих беременностях надо ставить вопрос об амниоцентезе с целью пренатальной диагностики. Если у пробанда диагностирована трисомия, риск развития ВПС у ребенка равен 1 %, при наличии у родителя сбалансированной транслокации — 2—10%, но в случае патологии у пробанда, возникшей de novo, риск, по-видимому, не увеличен [Элиас Ш., Янаги Р., 1985].
При медико-генетическом консультировании по поводу менде- лирующих нарушений супружеским парам, относящимся к группе риска, необходимо сообщить об относительно высокой вероятности наследования мутантного гена: 50% для аутосом но-доминантных нарушений (наличие ВПС у родственников I степени — родители, братья, сестры) и 25 % для аутосомно-рецессивных (ВПС у родственников II степени — дед, бабка, дяди и тетки), при наличии ВПС у родственников III степени (двоюродные братья и сестры) вероятность составляет 13%. Однако из-за вариабельности экспрессии и пенетрантности вероятность рождения ребенка с клинически выраженной патологией часто несколько ниже. При возможности следует предлагать родителям проведение пренатальной диагностики.
При мультифакториальных ВПС шанс рождения здорового ребенка в семье, где уже есть ребенок с ВПС, составляет 97 %. При медико-генетическом консультировании необходимо учитывать риск возникновения ВПС у сибса: при тетраде Фалло он составляет 2,5%, при ТМС — 2%, при общем артериальном стволе — 1 %, при ДМЖП — 3 %, при коарктации аорты — 2 %. При этом риск развития патологии выше, если пороком страдает мать, а не отец ребенка.
Распространенность ВПС у детей достаточно высока и составляет 30 % от числа всех врожденных пороков развития. При этом ВПС могут быть: основной причиной смерти; фактором, усугубляющим течение основного заболевания; случайной находкой на аутопсии, не влиявшей на танатогенез. Частота выявления
ВПС, по данным различных авторов, колеблется от 3,23 до 8 на 1000 живорожденных детей [McMahon et al., 1953; Kerrebyjn В., 1966]. Показано, что основное число детей с ВПС умирает на первом году жизни (50—90 %) и большинство из них — в период новорожденности (20—43%) или в первые 6 месяцев жизни (до 80 %) [Бураковский В. И., Константинов Б. А., 1970; Чернова М. П., 1973; Бураковский В. И. и др., 1989; Keth J.,1978]. После первого года жизни смертность от ВПС резко снижается, и в возрасте от 1 года до 15 лет погибает не более 5% детей [ВОЗ, 1971].
Представляет интерес характер ВПС, от которых умирают дети в различном возрасте [Boughman J. A. et al., 1987]. Так, на аутопсии у детей первой недели жизни преобладают синдром гипоплазии левого желудочка, ТМС, тетрада Фалло, стеноз и атрезия легочной артерии, коарктация аорты, ДМЖП. Частота таких ВПС, как ДМЖП, дефект межпредсердной перегородки (ДМПП), в этом возрасте относительно небольшая. На аутопсии у детей в возрасте от 1 мес до 1 года наиболее часто встречались ДМЖП, ТМС, АВК, коарктация аорты, тетрада Фалло, пороки с обструкцией левого желудочка. В группе детей первого года жизни из-за большей распространенности тяжелых ВПС реже встречаются ОАП, стеноз легочной артерии, стеноз аорты. С увеличением возраста меньше остается в живых детей со сложными и комбинированными ВПС. Структура ВПС у подростков и взрослых имеет свои особенности, именно в этом возрасте удается проследить естественное течение многих ВПС. Как правило, это умеренные клапанные дефекты, небольших или средних размеров ДМЖП, ДМПП, ОАП, коарктация аорты. К другим ВПС относятся корригированная ТМС, аномалия Эбштейна, тетрада Фалло и ВПС с высокой легочной гипертензией, которые не были устранены хирургическим путем в детстве до развития такого серьезного осложнения. Примерно у 23—30 % детей с ВПС имеются сопутствующие аномалии желудочно-кишечного тракта, мочеполовой и костной систем, ЦНС [Menashe V. et al., 1967; Moller J., Neal W., 1981]. Наиболее высокая частота экстракардиальных пороков развития отмечается у больных с комбинированными септальными дефектами (74%), ОАП (59%), ДМЖП (58%), наиболее низкая — при фиброэластозе и ТМС [Landtman В., 1971].
Классификация. Создание единой классификации ВПС имеет определенные трудности в связи с огромным количеством разновидностей пороков (по М. Lev—более 200), разных принципов, которые могут быть положены в ее основу. В Институте сердечно-сосудистой хирургии им. А. Н. Бакулева АМН СССР разработана классификация, в которой ВПС распределены с учетом анатомических особенностей и гемодинамических нарушений. Классификация более удобна для кардиохирургов и менее — для практических врачей, которые не всегда имеют возможность оценить топическую ситуацию.
Не считая некоторых различий в отдельных классификациях, клинически значимые формы ВПС в зависимости от гемодина- мических нарушений можно подразделить на следующие группы:
- пороки сердца с неизмененным или малоизмененным легочным кровотоком; 2)пороки с гиперволемией малого круга кровообращения; 3) пороки с гиповолемией малого круга; 4) комбинированные пороки сердца.
B.C. Morgan (1978) предлагает классификацию, основанную на доступных инструментальных и клинических методах исследования. Первоначально врач определяет наличие цианоза, что можно выявить как при осмотре больного в покое или при нагрузке в случае невыраженного цианоза (плач, физическая нагрузка), так и с помощью определения Ра02 и/или гематокри- та. Далее уточняется состояние малого круга кровообращения (гипо- или гиперволемия) с помощью аускультации (характер II тона над легочной артерией) и рентгенографии сердца. Эти данные сопоставляются с результатами электрокардиографического обследования, выявляющего характер гипертрофии и перегрузки камер сердца.
I. Пороки сердца с цианозом
- Уменьшенный кровоток в малом круге кровообращения:
а) гипертрофия правого желудочка (тяжелый стеноз легочной артернй, атрезня легочной артернн с или без ДМЖП);
б) гипертрофия левого желудочка (атрезня трехстворчатого клапана, атрезия легочной артерии с гипоплазией правого желудочка);
в) комбинированная гипертрофия правого и левого желудочков (ТМС со стенозом легочной артерии, общий артериальный ствол с гипоплазией легочных артерий).
- Увеличенный кровоток в малом круге кровообращения:
а) гипертрофия правого желудочка (ДМПП, все пороки с левоправым шунтом с легочной гипертензией — ОАП, ДМЖП, ДМПП);
б) гипертрофия левого желудочка (ОАП, ДМЖП, артерновенозная фистула).
II Пороки сердца без цианоза
- Нормальный кровоток в малом круге кровообращения:
а) гипертрофия правого желудочка (коарктация аорты, стеноз митрального клапана);
б) гипертрофия левого желудочка (коарктация аорты, стеноз аорты, фнбро- эластоз эндокарда).
- Увеличенный кровоток в малом круге кровообращения:
а) гипертрофия правого желудочка (атрезия аорты, синдром гипоплазии левого желудочка, тотальный аномальный дренаж легочных вен, ТМС);
б) комбинированная гипертрофия правого и левого желудочков (ТМС, единый желудочек, атрезия трехстворчатого клапана с ТМС).
В практической деятельности врачам удобно пользоваться простым делением ВПС на 3 группы: 1) ВПС бледного типа с артериовенозным шунтом (ДМЖП, ДМПП, ОАП); 2) ВПС синего типа с веноартериальным сбросом (ТМС, тетрада Фалло, атрезия трехстворчатого клапана); 3) ВПС без сброса, но с препятствием к выбросу крови из желудочков (стенозы легочной артерии и аорты, коарктация аорты). Такое деление охватывает 9 наиболее распространенных ВПС.
ю
Не случайно большинство предложенных классификаций ВПС содержит оценку состояния легочного кровотока, так как проблема легочной гипертензии в учении о ВПС имеет огромное самостоятельное значение. В клинике легочная гипертензия определяет выраженность таких симптомов, как одышка, недостаточность кровообращения, гипотрофия, склонность к рецидивирующим пневмониям. Неумение врача увидеть, правильно и своевременно оценить выраженность легочной гипертензии нередко стоит жизни больному.
Началом развития легочной гипертензии является повышение систолического давления в легочной артерии более 30 мм рт. ст. В зависимости от того, в каком участке сосудистого русла легких наблюдается первоначальный подъем давления, различают пре- капиллярную (артериальную) гипертензию — увеличение сопротивления в артериолах и мелких артериях — и посткапиллярную (венозную) — при повышении давления в левом предсердии и легочных венах. У больных с ВПС и артериовенозным сбросом наблюдается артериальная прекапиллярная легочная гипертензия, у больных с миокардитами, кардиомиопатиями и стенозом аорты — посткапиллярная.
Существует много классификаций легочной гипертензии. На практике оказалась наиболее удачной классификация, разработанная в Институте сердечно-сосудистой хирургии им. А. Н. Бакулева [Бураковский В. И. и др., 1975], которая основана на величине давления в легочной артерии, сброса крови и общелегочного сопротивления в соотношении с показателями большого круга кровообращения (табл. 1). Согласно этой классификации больных с легочной гипертензией делят на четыре группы. Больные 1а подгруппы не имеют выраженных нарушений гемодинамики, нуждаются в наблюдении кардиоревматолога. В отношении больных 16 подгруппы и II группы уже должен ставиться вопрос
о хирургическом лечении. Легочная гипертензия в этих группах носит в основном функциональный характер. В III группе морфологические изменения настолько выражены, что после коррекции порока давление в легочной артерии не снижается до нор-
Таблица 1. Классификация легочной гипертензии | Бураковский В. И. и др., 1975|
|
Группа гипертензии |
Отношение систолического давления в легочной артерии к системному артериальному давлению, % |
Сброс крови по отношению к минутному объему МКК. % |
Отношение общелегочного сосудистого сопротивления к системному, % |
|
1а |
До 30 |
Менее 30 |
До 30 |
|
16 |
До 30 |
Более 30 |
|
|
II |
До 70 |
В среднем 50—60 |
До 30 |
|
Ша |
Более 70 |
Более 40 |
Менее 60 |
|
1116 |
Менее 100 |
Менее 40 |
Более 60 |
|
IV |
100 |
Справа налево |
Более 100 |

Рис. 1. Стадии легочной гипертензии по D. Heath, J. Edwards (1958)
а — гипертрофия медии артерии на уровне респираторной бронхиолы (I стадия); Окраска по ван-Гнзону с докраской фукселином. Ув. 100; б — клеточная пролиферация интимы артерии на уровне альвеолярного хода (II стадия); в — гиперплазия и фиброз интимы (III стадия);

Pfcc. 1. Продолжение.
г — ангиоматозные структуры в просветах сосудов (IV стадия); д — истонченная медия (V стадия).
мального уровня; это указывает на преобладание органического компонента. В IV группе гипертензия в основном обусловлена изменениями структуры легочных сосудов и носит необратимый характер, хирургическое вмешательство в связи с этим не показано. В. И. Бураковский и соавт. (1975) предлагают выделять легочную гипертензию трех степеней: I степени — начальная — давление в легочной артерии составляет 30—50 % от аортального, II степень — умеренная — 51—70%, III степень—высокая — свыше 70 %.
Легочная гипертензия проходит 3 фазы. 1. Гиперволемиче- ская — результат несоответствия сосудистого русла объему протекающей крови, она встречается у детей первых месяцев и лет жизни. При этом сосуды легких переполнены кровью, но не возникает защитный рефлекс в виде спазма, чем и объясняются тяжелое клиническое течение, большая величина сброса. Давле
ние в легочной артерии может быть нормальным или умеренно повышенным, общелегочное сопротивление не изменено. 2. Смешанная фаза - возникает спазм сосудов в ответ на гиперволе- мию (защитный рефлекс) — сопровождается повышением как давления в легочной артерии, так и легочного сопротивления, что способствует уменьшению левоправого сброса. У детей до
- лет фактор вазоконстрикции легочных сосудов имеет решающее значение в патогенезе легочной гипертензии, у детей старше
- лет больше роль органических обструктивных изменений в легочных сосудах. 3. Склеротическая фаза — длитепьный спазм и гиперволемия вызывают необратимые склеротические изменения в сосудах легких. Существует мнение, что эта фаза может проявить себя сразу после рождения ребенка и представляет собой следствие задержанного фетального развития сосудов легкого, сохраняющих внутриутробный тип строения.
Для прогноза и показаний к операции имеет значение оценка морфологической структуры легочных сосудов, которая доступна при жизни благодаря биопсии легкого-D. Heath, J. Edwards (1958) выделили 5 стадий изменений легочных сосудов (рис. 1):
- стадия — толщина медии (ее гипертрофия) достигает 25 % общего диаметра сосудов; II стадия — гиперплазия интимы; III стадия — гиперплазия и фиброз интимы с обструкцией многих мелких легочных сосудов; IV стадия — в просветах сосудов развиваются ангиоматозные структуры; V стадия — просвет сосудов увеличивается, медия истончается. В результате таких изменений легочный кровоток значительно уменьшается, увеличивается сброс в аорту, постепенно развивается цианоз.
