ЭЛЕКТРОХИМИЧЕСКИЕ (КОРРОЗИОННЫЕ) ПРОЦЕССЫ В ПОЛОСТИ РТА
Слюна — сложный электролит, состав которого зависит от общего состояния здоровья, состояния полости рта, наличия зубных протезов.
Полость рта находится в состоянии непрерывной аэрации при каждом вдохе (избыток кислорода) и карбонатной насыщенности при каждом выдохе (избыток углекислого газа). Она представляет собой электрохимическую систему, в которой роль электролита выполняет слюна (жидкая фаза), насыщенная кислородом и углекислым газом, а роль электродов — зубы, зубные протезы (твердая фаза). На границе твердой и жидкой фаз возникает разность потенциалов, или потенциал ф электрод-системы, величина которого зависит от электропроводности твердой фазы (зубной протез) и концентрации потенциалопределяющих частиц в жидкой фазе (слюна). Наибольшей электропроводностью обладают металлы, поэтому потенциал (lt;р) резко увеличивается, если в полости рта имеются разнометаллические влючения (нержавеющая сталь, припой, амальгама, хромокобальтовый сплав и другие сочетания). При этом в полости рта образуются короткозамкнутые гальваносистемы с разными величинами электродных потенциалов (ф). Потенциалопределяющие частицы — это ионы и молекулы веществ, входящих в состав слюны, а также газы (кислород, углекислота), насыщающие слюну. Однако, поскольку концентрация потенциалопределяющих величин в слюне сравнительно невелика, изменение ее практически мало влияет на величину ф. Для оценки ф можно пользоваться стандартными величинами, указанными в справочниках.
Любую электродную реакцию можно представить в виде уравнения:
ox -f п -е red Окислитель Восстановитель
Электродная реакция — это окислительно-восстано- вительная реакция, протекающая на границе твердой фазы (обладающей электропроводностью) и раствора электролита. За счет этой реакции на границе твердой фазы (металлические протезы, зубы) и электролита возникает разность потенциалов (потенциал электрод- системы (pox/red).
Разновидностями электрод-систем являются:
- Возникновение собственного потенциала:
I I
Ме°~^ * Меп + red | Ион металла (твердая | (жидкая фаза)
фаза) ф
- Возникновение окислительно-восстановительного потенциала (рсдокс-потепциал):
ф° Fe3f/ Fe2+ =+0,77 В
В этом случае происходит передача электронов через твердую фазу, обладающую электропроводностью. Положительная величина ф показывает, что Fe*1" — сильный окислитель.
- Возникновение потенциала газовой системы:
Твердая
фаза
CL,
ф° С12/С1° =+1,359 В
С02 + 2Н + 2е~ з=с СО + Н20 (ф = -0,12 В)
С02 + N2 + 6Н+ + 6е~ ^CO(NH2)2 + Н20 (lt;р = + 0,1 В)
Мочевина
С02 + 2Н+ + 2е~ ** НСООН (ф = -0,2 В)
2С02 + 2Н+ + 2е~ ** Н2 С2 04 (ф = - 0,49 В)
Примеры окислительно-восстановительных реакций на границе твердой фазы (металлические протезы) и жидкой фазы (слюна):
- Си2+ + 2е~ ^ Си0 ф°Си2/Си° = +0,337 В ox red
- С12 + 2е~ ^ 2С1- ф°С12/С1° = + 1,359 В
ox red
Положительная величина ф° показывает, что хлор и медь (Си2+) — сильные окислители.
- Са2 + 2е~ ** Са° ф°Са2+/Са° = -2,87 В
ox red
- Сг3++ Зе~ у* Сг° ф°Сг3+/Сг° = —0,74 В
- Сг2+ + 2lt;?-^Сг° ф°Сг2+/Сг0 == —0,91 • В
Отрицательная величина ф° показывает, что хром и кальций — сильные восстановители.
- Возникновение коррозионного гальванического эле‘- мента при наличии протеза из золота (при pH 5,5):
Слюна
СО,
Анодный процесс (окисление)
2(НСООН) — 4е-з=с 2С02 + 4Н+
Катодный процесс (восстановление)
02 + 4е~ + 4Н+ — 2Н2 О
02 + 2 (НСООН) — 2С02 + 2Н2 О Еэпс = цgt;°К - \°А = + 1,229 В — (—0,2 В) = + 1,429 В
- Возникновение коррозионного гальванического элемента при наличии протезов из нержавеющей стали:
Натод
4е Fe
СО 2 Слкgt;на о2
2Fe - Ае~ + 2Н20 + 2СОг — 2FeC03 (тв.) + 4Н+ ФЛ = -0,756 В 02 + 4е“ + 2Н20 — 4(ОН)- lt;?/(=+1,229 В
2Fe + 02 + 2СОг — 2FeC03 + 4Н+ + 40Н~
ЭДС = 1,229в + 0,756g = ~2В
- Сравнительные анодные процессы в кислой и нейтральной среде металлического протеза из нержавеющей стали.
pH 5,5 pH 7,0
Fe° — 2е~ -gt;Fe2+ Fe° — 2е~ + 2НгО
Fe2+ — \е~ -gt;-Fe3+ —Fe(OH)2 + 2Н+
Fe° — Зе~ + 3H20-»
-*-Fe(OH)3 + ЗН +
Идет растворение анодного участка протеза.
Сг° —Зе~ -*Сг3+ Ni° — 2е~ —Ni2+
Образуются наросты малорастворимых Fe(OH)2 и Fe(OH)3 на анодных участках протеза.
2СгО — 6е~ + ЗН20-»
— Сг203 + 6Н+
Ni° — 2е~ + Н20 -gt; NiO + 2Н +
В нейтральной среде (pH 7,0) электрохимическая реакция сопровождается избытком водородных ионов, т. е. повышенной кислотностью. Это явление подтверждается и клинически: у больных, имеющих протезы из нержавеющей стали или хромокобальтового сплава, появляется чувство кислоты, жжения в полости рта. Оно может несколько стихать или усиливаться во время приема пищи (растительная пища создает кислую среду, белко-
вая — щелочную). По-видимому, таким больным следует рекомендовать белковую пищу для нейтрализации избытка водородных ионов.
В кислотной среде происходит выраженный процесс растворения металлического протеза — анодных участков.
Ф° Fe2+/Fe° == —0,44 В lt;р° Сг3+/Сг° = —0,74 В Ф° Ni2+/Ni0 = —0,23 В.
Таким образом, анодные реакции коррозии протезов характеризуются изменением электродных потенциалов вследствие перехода ионов металлов из твердой фазы (металлические протезы) в жидкую (слюну). Эти положения были подтверждены нами в эксперименте и клинике ортопедической стоматологии.
Нержавеющая сталь, предложенная в 30-х годах для зубного протезирования, испытывалась на коррозийную стойкость. Д. Н. Цитрин и В. Н. Дятлова (1934) определяли степень коррозии, учитывая потерю массы и изменение вида испытуемой детали. Потери массы были крайне незначительны и определялись весовым методом. Внешний вид образцов не менялся. На основании этих данных авторы пришли к выводу, что нержавеющая сталь является удовлетворительным сплавом для зубного протезирования.
Однако из электрохимии известно, что коррозия определяется также и качеством и количеством компонентов, выходящих в среду из испытуемых (образцов) сплавов металлов. Нами разработан и применен метод химикоспектрального анализа для определения процессов коррозии в искусственной среде [Гожая Л. Д., 1969]. При составлении искусственной среды мы руководствовались данными литературы о химическом составе слюны человека [Fusayama Т., Katavori Т., 1963; Todorow J., 1966, и др.].
Искусственную среду помещали в прибор (рис. 1), представляющий собой кварцевый сообщающийся сосуд, покрытый теплоизоляционным слоем для поддержания постоянной температуры. Нагревание (37°С) жидкости в сосуде осуществляли электрическим током, подведенным под теплоизоляционный слой через лабораторный автотрансформатор ТИП-1. В одном колене сосуда находилась мешалка для перемешивания и соединения с электромотором, в другом — штатив для испытуемых образ-
Рис. 1. Прибор для испытания металлов на коррозию в среде, близкой к полости рта (схема)
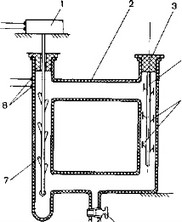 I — электромотор; 2 — кварцевый сообщающийся сосуд; 3 — пробка; 4 — штатив; 5 — образец; 6 — кран; 7 — мешалка; 8 — контакты электрообогрева.
I — электромотор; 2 — кварцевый сообщающийся сосуд; 3 — пробка; 4 — штатив; 5 — образец; 6 — кран; 7 — мешалка; 8 — контакты электрообогрева.
цов, в основании сосуда — кран для забора проб. Сосуд закрывали пробками из фторопласта. Общее количество искусственной среды составляло 1000 г. Для анализа брали 8 см3 испытуемой жидкости, делили на две пробы (4 см3) и определяли среднее значение. Отбор проб проводили через каждые 6 дней. Взято 15 проб, проведено
- анализов, изучено 150 спектрограмм. Спектральный анализ выявил коррозионные изменения в испытуемой среде. Исследование на коррозию проводили и при pH среды 5,5 (максимальный сдвиг pH, возможный в полости рта), и при температуре 37° С. Для испытания на коррозию были взяты три мостовидных протеза из нержавеющей стали с припоем (масса до опыта 6,92 г, после опыта 6,86 г), потери составили 0,06 г (0,87%). Время испытания 3 мес (2100 ч). В течение этого времени определяли качественную и количественную характеристику коррозионного процесса.
При осмотре (до опыта) мостовидные протезы в местах паек вследствие образования окисных продуктов имели потемнения, наружная поверхность была отполированной, блестящей. Перед началом исследования мостовидные протезы тщательно полировали. Внутренняя поверхность коронок матовая. После опыта в местах паек коронок и промежуточной части поверхность зелено-синяя, образовалась окисная пленка в виде «наростов»,
1
Время, мес
Рис. 2. Зависимость процесса коррозии (AS) нержавеющей стали от времени испытания I — марганец; II — железо; III — медь; IV — никель; V — хром.
после снятия которой обнаружены кратерообразные углубления («язвы»).
Механическое надламывание в этих местах привело к разлому коронки. Поверхность полированной части мостовидных протезов стала тусклой, внутри коронок появилась окисная пленка темно-желтого цвета. Эти явления можно объяснить процессом коррозии.
По данным Д. Г. Туфанова (1969) и М. Andreas (1960), в агрессивных средах нержавеющая сталь с припоем подвергается контактной коррозии. При этом большое значение имеет соотношение площадей контактируе- м_ых металлов.
Сочетание большой поверхности катода (нержавеющая сталь) с небольшой поверхностью анода (припой) вызывает значительное растворение металлов — припоя.
На рис. 2 представлена зависимость разности почернений (AS) микропримесей железа, меди, никеля, хрома от времени испытания (Т) нержавеющей стали с припоем в искусственной среде.
Из рис. 2 видно, что содержание анализируемых примесей в искусственной среде с увеличением времени испытания возрастает. Особенно ярко эта зависимость выражена у марганца, железа, меди, никеля, меньше — у хрома.
Это связано с разной химической активностью этих
металлов, определяемой разными электрохимическими потенциалами:
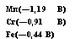
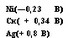
Хром легко пассируется, т. е. покрывается очень плотной фазой СггОз, и становится малоактивным металлом.
Ф° = + 0,4 В
Медь в присутствии серы (S-2) и других сульфидов t(Na2S; K2S) образует CuS и становится активным металлом.
lt;pCu2S/2Cu + S“2 = —0,88 В
Характер кривых показывает, что коррозия имеет временные стадии активизации и замедления.
Таким образом, по данным спектрографических исследований, нержавеющая сталь с припоем в искусственной среде, близкой к условиям полости рта, подвергается коррозии.
Исследовали на коррозию также 4 образца серебрянопалладиевого сплава (спецсплав) массой 1,5028; 1,5692;
- 5519 и 1,3822 г (общая масса 6,001 г). Масса испытуемых образцов спецсплава после опыта не изменилась. Время испытания с целью уточнения пассивирующего процесса 5 мес. Отбор проб для исследования проводили через 6 дней в течение 1-го месяца, затем через каждые 2 нед. Взято 12 проб, проведено 24 спектральных анализа.
На рис. 3 показано, что в течение 1-го месяца значительно увеличивается содержание серебра в испытуемой среде (от 9-10—6 до 2*10_5%). Затем выделение серебра несколько замедляется. Это явление можно объяснить первоначальным действием слабокислой среды на переход серебра из спецсплава в среду с последующей пассивацией (образование окисной пленки на поверхности испытуемых образцов).
Коррозия усиливается с увеличением времени испытания. Корродируется основной компонент — серебро.
Анализ с учетом потенциалов [Лурье Ю. Ю., 1983] показывает, что потенциалы серебра уменьшаются в присутствии веществ, содержащих ионы хлора, брома, молекулы аммиака и др. В этом случае ЭДС серебряно-палла-
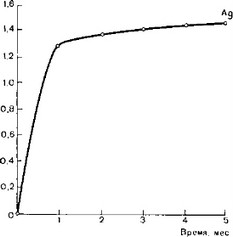
Рис. 3. Зависимость коррозии (AS) серебряно-палладиевого (Ag) сплава от времени испытания.
диевого сплава должна увеличиваться, а коррозионный процесс — активироваться. Однако в слабокислой и нейтральной среде потенциал серебра резко увеличивается в присутствии кислорода (может достигать 2 В). В этом случае (дыхание преимущественно через рот) ЭДС коррозионного гальванического элемента уменьшается и наблюдается временное затухание коррозионного процесса или перераспределение катодных и анодных участков, т. е. временно палладий становится анодным участком и на его поверхности могут образовываться твердые или мягкие наросты, имеющие большие силы сцепления (адгезии) с поверхностью палладия.
Анод (Ag) Катод (Pd)
ф = + 0,8 В ф = +0,99 В
Происходит контактная коррозия, в результате чего серебро корродирует (так как (pAglt;(pPd).
Химико-спектральный анализ является достоверным тестом для оценки коррозионной устойчивости сплавов металлов в биологических средах. В модельных опытах
методом химико-спектрального анализа было показано, что гальванопара золото — хромокобальт корродирует и приводит к накоплению в искусственной слюне (pH 5,5) иионов хрома (2*10-5%), никеля (5-10~7%), железа (3-10~5%). Железо входит в состав хромокобальтового сплава в количестве 0,5%, хром — 25—28%, никель — около 4%. В модели слюны pH 7,0 и 8,0 ионы хрома и никеля не обнаруживаются, а ионы железа присутствуют в концентрации 1-10~5% [Седов С. Э., 1983].
Клинические исследования биологических сред (слюна, кровь, моча, слизистые оболочки и т. д.) на микроэлементы у лиц, имеющих в полости рта металлические конструкции, подтверждают модельные опыты и выявляют процессы коррозии протеза в полости рта.
Продуктами электрохимических реакций являются ионы металлов (микроэлементы), поступающие в слюну из корродирующих сплавов. Динамика изменения микроэлементов состава слюны находится в прямой зависимости от степени электрохимических процессов в полости рта. Высокие концентрации микроэлементов установлены нами в слюне, лиц с аллергическим и токсическим стоматитом, вызванным протезом (400 человек) из нержавеющей стали, по сравнению с нормой (50 человек). Наиболее выраженные колебания обнаружены в содержании железа, никеля, меди, серебра, хрома, титана.
Изменение количественного содержания микроэлементов в слюне тесно связано с процессами коррозии мостовидных протезов из нержавеющей стали. Это установлено нами при исследовании снятого паяного протеза из нержавеющей стали после работы его в полости рта. С этой целью обследовано 30 человек в возрасте от 35 до 58 лет. Первую группу составили 8 больных, у которых мостовидные протезы были сняты по причине отрыва промежуточных частей в местах пайки (10 протезов). Во вторую группу вошло 22 больных с парестезией полости рта (16) и аллергией на металлические протезы (6). У этих больных протезы снимали после установления причинной зависимости заболеваемости от металлических конструкций. Снято и исследовано более 35 протезов. Диагноз заболевания ставился на основании данных клинических и лабораторных исследований (спектральный анализ слюны, анализ крови, аллергологические тесты).
Снятые мостовидные протезы из нержавеющей стали исследовали на сканирующем электронном микроскопе микрозондовым анализатором. В каждом протезе изуча-
ли три зоны: припой, контакт припоя с коронкой и припой с промежуточной (литой) частью. Всего исследовано 90 зон мостовидных протезов, проведено 30 спектральных анализов слюны.
При исследовании припоя у больных первой группы обнаружены сетка коррозионных трещин и межкристал- литная коррозия (рис. 4), что свидетельстует об одновременном действии механических напряжений и коррозионной среды. Как известно, межкристаллитная коррозия возникает при совместном действии агрессивной среды и внутренних напряжений [Кабанов Б. Н., 1966]. В полости рта протезы в значительной степени подвержены электрохимической коррозии, усиленной вследствие взаимодействия разнородных металлов (сталь — припой). У больных этой группы отмечена большая протяженность мостовидных протезов, построенных без учета состояния пародонта опорных зубов и зубов-антагони- стов. В этом случае напряжения в металле усиливают коррозионный процесс. Усилению коррозии способствует также наличие зазоров вследствие некачественного выполнения шва, вызывающих щелевую коррозию
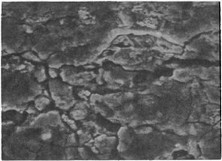
Рис. 4. Микрофото. Сетка коррозионных трещин и межкристаллитное разрушение в зоне припоя. Х1600.
[Жук Н. Т., 1976]. Нарушение температуры пайки в интервале 450—850° С приводит к межкристаллитной коррозии. При этом по границам зерен происходит выделение карбидов [Гернер М. М. и др., 1984].
В зоне контакта припоя с коронкой отмечается коррозионное растрескивание и механическое разрушение (рис. 5). В литой части мостовидного протеза (третья зона) коррозионный процесс выражен очень слабо. При осмотре больных второй группы мостовидные протезы в местах паек (припой) имели толстые, большие по площади, пористые окисные пленки. Известно, что коррозии противостоят только весьма тонкие пассивирующие слои [Б. Н. Кабанов, 1966]. Мостовидные протезы после их снятия разрушали механическим способом на границе коронка — припой.
При исследовании зоны излома на сканирующем электронном микроскопе обнаружено несколько крупных пор. Поверхностные поры, сообщающиеся со средой полости рта, и поры внутри шва (припоя) содержали продукты коррозии и являлись очагом щелевой коррозии (рис. 6). Структура припоя пористая, поверхность ее совпадает с составляющими эвтектики серебро — медь. Однако характер распределения медных и марганцевых включений в припое не всегда равномерен: встречаются большие и малые скопления марганца, меди и участки, где включения отсутствуют (рис. 7). Серебряные включения распределены в припое равномерно (рис. 8). Наличие в структуре отдельных микрообластей, богатых медью, характеризуется пониженным сопротивлением коррозии [Sarkar N., 1979]. Известно также, что включения обусловливают степень выраженности электрохимических реакций в полости рта, так как их электродные потенциалы различны.
Таким образом, в полости рта протезы из нержавеющей стали подвергаются коррозии. В поверхностных порах припоя наблюдается щелевая коррозия. Продукты ее (микропримеси железа, меди, марганца, серебра и др.) поступают в полость рта, что подтверждается данными спектрального анализа слюны. Процесс этот во времени является постоянным. Коррозия происходит на всей глубине припоя. В зоне, прилегающей к коронкам, припой корродирует в меньшей степени. В литой структуре стали коррозия выражена слабо. Возникновению межкристаллитной коррозии способствуют механические напряжения в металле, значительная протяженность протезов, нару-
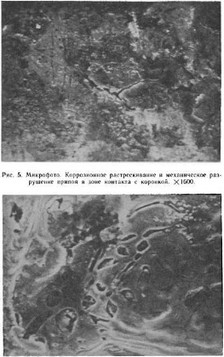
Рис. 6. Микрофото. Структура припоя. Поверхность ее совпадает с составляющими эвтектики Ag—Си. Х2400.
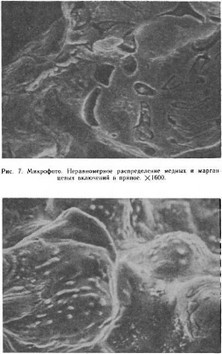
Рис. 8. Микрофото. Равномерное распределение серебряных включений в припое. Х2400.
шения конфигурации паяного шва и образование зазоров.
Мостовидные протезы с межкристаллитной коррозией в полости рта способны разрушаться по шву (пайки).
Источник: Гожая Л. Д., «Аллергические заболевания в ортопедической стоматологии» 1988