III. ПУТЬ АНТИБИОТИКА ИЗ ЛАБОРАТОРИИ В ПРОИЗВОДСТВО
Выделенные из почвы штаммы-продуценты антибиотиков образуют обычно менее 50 мг продукта на 1 л культуры, а для проведения всех исследований, необходимых для оценки качеств препарата, его нужно несколько килограммов. Более того, если препарат успешно применяется в клинике, каждый год он должен производиться в количестве нескольких тонн. Если бы продуктивность штаммов оставалась на том же уровне, как у исходного штамма, стоимость антибиотика была бы непомерно высокой. Ясно поэтому, что одним из первых этапов работы по внедрению нового антибиотика должна быть разработка способов увеличения биосинтетической продуктивности. Эти исследования могут проводиться в двух направлениях: увеличение продуктивности штамма и улучшение условий ферментации.
А. УЛУЧШЕНИЕ ШТАММА-ПРОДУЦЕНТА
Этот термин означает работу с самим штаммом, направленную на повышение его способности к синтезу антибиотика. Для этого имеются два пути: 1) мутации и отбор; 2) генетическая инженерия.
- МУТАЦИИ И ОТБОР
Образование вторичных метаболитов, которыми и являются антибиотики, регулируется несколькими механизмами. Скорость образования таких метаболитов зависит от скорости синтеза продуктов обмена, являющихся промежуточными продуктами синтеза антибиотиков, и от скорости их превращения. Эти реакции регулируются такими механизмами, как репрессия или индукция синтеза ферментов, аллостерическая регуляция активности ферментов или катаболитная репрессия. Все эти механизмы генетически детерминированы, и поэтому их можно модифицировать или даже полностью исключить в результате мутаций. В природе мутации у бактерий происходят во время деления клеток, но с очень низкой частотой. Частота мутаций увеличивается на несколько порядков под действием мутагенов,
таких как ультрафиолетовое и рентгеновское облучение или химические агенты (азотистая кислота, нитрозогуанидин и т. д.).
Большинство мутаций вызывает изменения в ДНК, приводящие к гибели клетки, но некоторые из них, затрагивающие определенные стадии обмена, не являются летальными и индуцируют более интенсивный синтез антибиотика. Популяция микроорганизмов, выживших после воздействия мутагеном, состоит из 1) клеток, в которых вообще не произошло мутаций и которые поэтому не отличаются от исходного штамма;
- клеток, в которых произошла одна или несколько мутаций, или не влияющих на синтез антибиотика, или даже подавляющих его; 3) клеток, в которых произошли мутации, индуцирующие более интенсивный синтез антибиотика. Эти последние клетки, называемые высокопродуктивными мутантами, присутствуют в популяции в очень небольшом количестве. Проблема состоит в том, чтобы идентифицировать их среди множества низкопродуктивных клеток. Процесс, с помощью которого это осуществляется, называется отбором.
а. Случайный отбор
Это наиболее эмпирический способ отбора. Суспензию клеток, обработанных мутагенами, помещают на чашки с питательной средой, с тем чтобы выросли колонии из одной клетки (моноклональные колонии). Некоторые из этих колоний'отбирают случайным образом для выращивания в чистой культуре и определяют их продуктивность (концентрацию антибиотика, образованного за фиксированное время ферментации). Поскольку мутации, вызывающие повышение продуктивности, встречаются редко, чтобы найти высокопродуктивный мутант, необходимо проверить очень много колоний. Программа такого типа требует отбора и проверки около 10 000 колоний в год. Хотя это не слишком эффективная и далеко не творческая работа, зачастую только она может привести к успеху, по крайней мере на ранних стадиях работы с антибиотиком.
Эффективность отбора можно повысить, предварительно отобрав потенциальные высокопродуктивные колонии непосредственно на чашке. Для этого чашку с выросшими колониями заливают слоем агара с бактериями, чувствительными к данному антибиотику. Колонии высокопродуктивных организмов образуют зоны подавления роста бактерий большего размера, чем колонии исходного штамма.
б. Отбор морфологических мутантов
Среди колоний, образованных клетками, которые пережили обработку мутагеном, имеются такие, которые морфологически отличаются от колоний дикого типа. В отдельных случаях об
наружена качественная взаимосвязь между морфологией колоний и их способностью к синтезу антибиотика (например, пенициллина, циклогексимида, нистатина). Однако какие-либо объяснения того факта, что определенные морфологические мутанты образуют больше антибиотика, отсутствуют. Возможно, мутация, ведущая к определенным морфологическим изменениям, затрагивает один из ферментов, участвующих в метаболизме сахаров, что приводит к соответствующему изменению концентрации фосфорилированных сахаров, коферментов и отношения ATP/ADP. Мутации такого типа могут приводить, с одной стороны, к изменению состава клеточной стенки и, следовательно, к изменению морфологии колоний, а с другой — к изменению скорости синтеза предшественников антибиотика.
в. Отбор мутантов, образующих большие количества
промежуточных продуктов
Вторичные метаболиты образуются в результате биохимических превращений или полимеризации промежуточных продуктов. Увеличение скорости синтеза последних может привести к увеличению продуктивности. Например, скорость метилирования антибиотика может определяться доступностью донора метальных групп, которым часто служит метионин. Если фонд метионина увеличивается в результате мутации, ведущей к усилению синтеза этой аминокислоты, увеличивается и скорость образования антибиотика.
?. Отбор ауксотрофных мутантов
и их ревертантов
Ауксотроф — это мутант, отличающийся от исходного штамма тем, что он нуждается в дополнительном источнике питательных веществ. Например, для роста ауксотрофа по витамину В12 в среду нужно добавить этот витамин. Ауксотрофность во многих случаях оказывает очень сильное влияние на синтез антибиотиков. Вообще говоря, ауксотрофные мутанты менее продуктивны, чем штамм дикого типа. Однако, если необходимое питательное вещество добавлено к среде, некоторые ауксо- трофы образуют больше антибиотика, чем штамм дикого типа. Продуктивность иногда удается увеличить, выделив вначале ауксотрофный мутант, а затем ревертант, т. е. штамм, который больше не нуждается в добавлении питательного вещества. Хотя мы и не знаем для каждого конкретного случая механизмов увеличения скорости образования антибиотика при реверсии от ауксотрофности к исходному типу (к прототрофности), можно предположить, что это связано с изменением механизма контроля одного или нескольких метаболических путей, приводящего к увеличению синтеза одного или нескольких предше
ственников антибиотика и, следовательно, к стимуляции образования последнего.
Таким образом, 1) ауксотрофность обычно связана с уменьшением образования антибиотика; 2) если к среде добавлено необходимое для роста питательное вещество, некоторые ауксо- трофные мутанты образуют больше антибиотика, чем исходный штамм; 3) некоторые ревертанты образуют больше антибиотика, чем исходный штамм.
д. Отбор мутантов с измененными механизмами контроля
Синтез микроорганизмами первичных и вторичных метаболитов регулируется многими механизмами, предотвращающими избыточное образование метаболитов. Поскольку цель программы улучшения штамма-продуцента состоит исключительно в получении больших количеств данного метаболита, легко понять, насколько важным здесь может быть выключение регуляторных механизмов. Основные такие механизмы перечислены ниже.
- Регуляция конечным продуктом по принципу обратной связи: подавление активности (а не синтеза) фермента (обычно первого в метаболическом пути) низкомолекулярным соединением, называемым эффектором. Таким эффектором может быть (см. рис. 7.1): а) конечный продукт метаболического пути, т. е. сам антибиотик, как в случае хлорамфеникола, который ингибирует активность фермента ариламинсинтетазы; это первый фермент пути, ответвляющегося от обычного пути синтеза ароматических аминокислот (подавление конечным продуктом);
б) предшественник антибиотика, который может регулировать свой собственный синтез по принципу обратной связи и, следовательно, лимитировать скорость синтеза антибиотика; в) метаболит, участвующий в синтезе антибиотика.
- Репрессия синтеза одного или нескольких ферментов: уменьшение скорости синтеза ферментов, участвующих в биосинтезе антибиотика; эффектором является низкомолекулярное соединение, обычно конечный продукт ферментативных реакций или близкое к нему по структуре соединение.
- Индукция синтеза одного или нескольких ферментов: увеличение скорости синтеза одного или нескольких ферментов, специфически индуцируемое низкомолекулярным соединением, которое обычно является субстратом фермента или близко ему по структуре. Например, лактоза индуцирует синтез |3-галакто- зидазы, расщепляющей лактозу на составляющие ее сахара, глюкозу и галактозу.
- Катаболитная репрессия в присутствии глюкозы: снижение скорости синтеза некоторых ферментов, в особенности
Различные типы ингиamp;цро0ания по принципу обратной с/язи
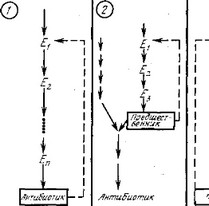

Рис. 7.1. Различные типы ингибирования по принципу обратной связи.
ферментов деградации (гликолитических ферментов пентозофос- фатного цикла, ферментов пути Энтнера—Дудорова, глиокси- латного цикла, деградации аминокислот), в присутствии глюкозы или других легко усваиваемых источников углерода. Результатом репрессии синтеза этих ферментов является уменьшение синтеза метаболитов в путях, использующих эти ферменты. Синтез антибиотиков часто находится под контролем катабо- литной репрессии.
- Катаболитная репрессия в присутствии источников азота: снижение скорости синтеза ферментов, связанных с катаболизмом азотсодержащих соединений (протеаз, амидаз, нитратре- дуктаз и т. д.) в присутствии легко усваиваемых источников азота, таких как соли аммония. Таким образом контролируется синтез многих антибиотиков.
- Регуляция неорганическим фосфатом: добавление неорганического фосфата к культуре, активно синтезирующей антибиотик, зачастую сильно снижает скорость синтеза. Для объяснения регуляции биосинтеза антибиотиков фосфатом предложено несколько механизмов (наиболее важные из них схематически представлены на рис. 7.2): а) фосфат стимулирует первичный метаболизм, направляя энергию и субстраты на рост, а не на синтез вторичных метаболитов; известно, что фосфат вызывает переключение катаболизма углеводов с гексозомонофос-
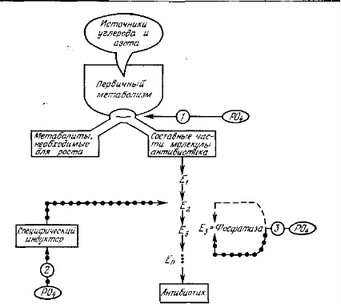
Рис. 7.2. Возможные механизмы регуляции биосинтеза антибиотиков фосфатом. репрессия или индукция синтеза фермента; регуляция
активности фермента.
фатного пути на гликолитический; б) фосфат контролирует образование специфического индуктора синтеза антибиотика; по-видимому, одним из таких индукторов является фактор А, индуцирующий синтез стрептомицина; синтез фактора А контролируется неорганическим фосфатом; в) фосфат может подавлять активность или синтез фосфатаз, участвующих в метаболизме фосфорилированного предшественника (предшественников) антибиотика.
Регуляция синтеза антибиотиков фосфатом характерна для многих штамов-продуцентов и для разных антибиотиков. Возможно, в разных организмах или при разных физиологических условиях функционируют разные механизмы или действуют сразу несколько таких механизмов. Мутации, затрагивающие один или несколько механизмов регуляции, по-видимому, являются одним из наиболее продуктивных типов мутаций, особенно на ранних этапах работы по улучшению штамма-проду- цента.
е. Отбор штаммов, устойчивых
к данному антибиотику
Штаммы-продуценты зачастую оказываются чувствительными к тем антибиотикам, которые они сами синтезируют. В некоторых случаях мутанты, устойчивые к токсическому действию антибиотика, являются одновременно высокопродуктивными.
ж. Отбор штаммов, устойчивых
к токсическим предшественникам
Классическим примером является образование пенициллина V после добавления к культуральной среде фенилуксусной кислоты — предшественника, токсичного для продуцента. Штаммы, устойчивые к высоким концентрациям фенилуксусной кислоты, часто образуют большие количества пенициллина V.
2. ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ
Генетическая информация, детерминирующая синтез антибиотика, может быть «размножена» (амплифицирована) путем увеличения числа копий одного или нескольких генов. Такие клетки могут синтезировать антибиотик с большей скоростью. Это верно только в том случае, если механизм, контролирующий экспрессию генов, допускает экспрессию большего числа копий. Существует несколько методов амплификации генов. Можно «конструировать» (отсюда термин «генетическая инженерия») микроорганизмы, геном которых состоит из фрагментов, происходящих от разных штаммов. Такие организмы называют рекомбинантами. Скрещивая два разных высокопродуктивных мутанта (у которых способность к синтезу больших количеств антибиотика является следствием разных мутаций), можно получить рекомбинанты, несущие информацию от обоих родительских штаммов.
Недавно высказано предположение, что синтез некоторых антибиотиков может детерминироваться генами, локализованными во внехромосомных ДНК — плазмидах, которые передаются от штамма к штамму.
Весьма перспективной представляется амплификация генов методом молекулярного клонирования. Этот метод состоит во включении фрагмента ДНК в плазмиду, которая реплицируется с образованием нескольких копий. Кроме того, выбрав соответствующую плазмиду, этот фрагмент ДНК можно передавать разным микроорганизмам (например, Е. coli, физиология и генетика которых хорошо известны), в которых он может экспрессироваться. Уже удалось осуществить перенос генов млекопитающих (например, генов, кодирующих синтез инсули
на или дигидрофолатредуктазы) в Е. coli и достичь их экспрессии.
Необходимо, однако, помнить, что большинство антибиотиков являются продуктами нескольких генов, как правило, расположенных в разных участках хромосомы. В этом смысле антибиотик является не продуктом гена, а продуктом продуктов (ферментов) нескольких или многих генов. Поэтому вряд ли в ближайшем будущем удастся перенести все гены, ответственные за синтез данного антибиотика, от организма одного вида к другому.
Б. УЛУЧШЕНИЕ УСЛОВИЙ ФЕРМЕНТАЦИИ
Скорость образования антибиотика зависит от многих факторов: природы и концентрации источников углерода и азота, концентрации микроэлементов (фосфата, сульфата и т. д.) и многих других веществ, pH среды, давления кислорода, содержания растворенной в среде двуокиси углерода. Эти факторы могут влиять на образование антибиотика либо прямым образом, выступая в роли предшественников или эффекторов в биосинтетических путях и таким образом воздействуя на механизмы контроля метаболизма, либо косвенным, регулируя скорость роста клеток. Направленно изменяя состав питательной среды и физические условия ферментации (аэрацию, перемешивание, температуру), можно повысить продуктивность, т. е. количество антибиотика, образующегося на единицу биомассы в единицу времени.
При увеличении масштабов производства, однако, возникают проблемы, связанные с увеличением объема. Поиски и исследование новых антибиотиков в лаборатории проводят с использованием оборудования, в котором продуценты выращивают в сосудах емкостью от 100 мл до 1 л. Чтобы промышленное производство антибиотиков было рентабельным, необходимо использовать ферментеры гораздо больших объемов. Переход от оптимального ферментационного процесса в лабораторных условиях к ферментации в промышленных масштабах представляет серьезную проблему. Исследования, связанные с решением этой проблемы, называют масштабированием и проводят в двух разных взаимосвязанных направлениях: 1) конструирование промышленных ферментеров, в которых можно воспроизвести условия, обеспечивающие в лаборатории максимальную продуктивность; 2) модификацию лабораторного процесса ферментации таким образом, чтобы приблизить его к процессам, протекающим в больших объемах. Необходимость этих последних исследований и трудности при их осуществлении связаны с тем, что различные параметры процесса не всегда можно увеличивать пропорционально. Например, аэрация и
энергия, необходимая для перемешивания культуральной жидкости, пропорциональны объему ферментера, тогда как теплоотдача— его поверхности; значит, на многие операции нагревания и охлаждения, связанные со стерилизацией, необходимо затрачивать разное время. Высота столба жидкости в ферментере влияет на время обмена двуокиси углерода со средой. Развитие микроорганизма от исходной колонии до жидкой ‘культуры, равномерной по плотности, требует не только больше времени, но и большего числа генераций, и это может вызывать отличия в продуктивности.
В последние годы развилась область, известная под названием «биоинженерия», предметом которой является установление параметров, важных при переходе от лабораторных экспериментов к промышленному производству.
Источник: Ланчини Д., Паренти Ф., «Антибиотики. Пер. с англ. — М.: Мир. — 272 с., ил.» 1985