ДОСТИЖЕНИЯ В ЛЕЧЕНИИ, ПРЕДУПРЕЖДЕНИЕ РЕСТЕНОЗОВ
До эпохи стентов многочисленные попытки механического и лекарственного предупреждения рестенозов осуществлялись, но безрезультатно. Хотя и применялись различные способы по разрушению атеросклеротических бляшек, самым успешными считались процедуры, при которых рестеноз возникал в течение 6 мес в 50% случаев. Процесс рестенозирования после баллонной ангиопластики и любого механического вмешательства, кроме стентирования, представляет собой комплекс восстановительных процессов после повреждения, в результате которого происходит пролиферация интимы и ремоделирование сосуда. Имплантация металлического стента минимизирует повреждение стенки сосуда, тем самым уменьшая вероятность развития клинического рестеноза и снижая необходимость в проведении повторной операции по поводу рецидива симптомов. В то же время, имплантация металлического стента вызывает пролиферацию неоинтимы. Таким образом, при имплантации стентов в мелкие сосуды, с протяженным повреждением, происходит рестеноз, достигающий уровня 30% [253]. Кроме того, рестеноз в зоне имплантации стента трудно поддается лечению, и с каждой новой процедурой частота рестеноза увеличивается на 19-83% [254]. Это возникает в случае происхождения диффузного или пролиферативного рестеноза. Вследствие того что в основе рестеноза в зоне имплантации стентов лежит пролиферации неоинтимы, нашло успешное применение внутрисердечное облучение как Y-, так и p-лучами. Тем не менее долгосрочные результаты такой терапии (брахитерапия) были ассоциированы с чрезвычайно высокими темпами тромбоза стента и поздней окклюзией сосуда, предположительно, из-за замедления процессов восстановления эндотелия [255]. Использование сосудистого облучения, применяемого во время имплантации стента с целью предупреждения поздней пролиферации неоинтимы внутри стента, было прекращено в результате развития осложнений: острого и позднего тромбоза стентов.
В настоящее время стенты (DES) с лекарственным покрытием вытесняют простые металлические стенты (BMS). Их металлические основы покрыты полимерными соединениями, содержащими менее 0,1 мг цитотоксических и противовоспалительных компонентов (например, паклитаксел, сиролимус, эверолимус), исчезающими постепенно в течение первых недель после имплантации стентов. Три препарата показали одинаковые положительные эффекты в исследованиях с DES (паклитаксел, сиролимус и его производное эверолимус).
Применение в последнее время специальных приспособлений позволило сократить как уровень ангиографических рестенозов, так и необходимость прибегать к повторным вмешательствам вследствие рецидива симптомов более чем на 60% [256]. Частота зафиксированных случаев
возникновения тяжелых побочных эффектов, включающих необходимость повторного вмешательства, за последние 9 мес колеблется в пределах 7,1-0,3% со стентами с лекарственным покрытием (DES) по сравнению с уровнем 13,3-18,9% с простыми стентами (BMS). Современные рекомендации по использованию DES представлены в европейских рекомендациях по ЧТА [257]. Другое направление заключается в увеличении частоты использования прямого стентирования, т.е. осуществлении имплантации стентов без предварительной баллонной дилатации. Эксперименты на животных подтвердили тот факт, что при прямом стентировании не происходит повреждение сосудистой стенки и меньше повреждается эндотелий [258]. Если прямое стентирование осуществляется с DES, то частота рестенозов уменьшается до 2% [259].
Недостаток имплантации стентов заключается в наличии риска тромбоза стента, который приводит к высокой смертности на госпитальном этапе. Частота возникновения тромбоза стентов в течение первого года 2%, и прибавляется на 0,5% с каждым прожитым годом. Риск тромбоза стентов DES больше, чем BMS. Высокий риск тромбоза, ассоциированный с имплантацией DES, однако, не приводит к увеличению уровня смертности и развития ИМ (рис. 17.27). Таким образом, значительно уменьшая риск рестеноза по сравнению с обычными стентами, стенты с лекарственным покрытием напрямую уменьшают риск летального исхода и нефатального ИМ, тем самым компенсируя риск тромбоза стента [261]. В совокупности метаанализы и клинические исследования указывают на тот факт, что имплантация DES незначительно уменьшает уровень серьезных кардиальных осложнений, таких как летальный исход и ИМ, при сравнении с имплантацией BMS [262].
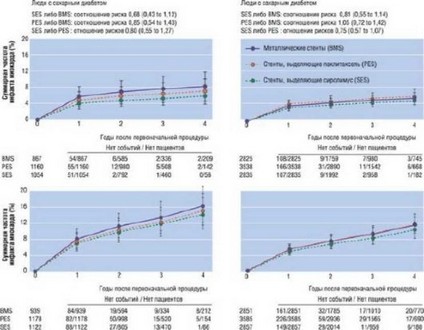
Рис. 17.27. Метаанализ со сравнением способов лечения. Прямое сравнение результатов клинических исследований, полученных при условии сохранения случайного распределения пациентов по группам (рандомизации). Риск ИМ и смерти или ИМ был одинаков для стентов, выделяющих сиролимус (SES), паклитаксель (PES) и обычных металлических стентов (BMS), как у пациентов с диабетом, так и без диабета. Изменено: Stettler C., Alleman S., Wandel S. et al. Drug eluting and bare metal stents in people with and without diabetes: collaborative network meta-analysis // BMJ. - 2008. - Vol. 337. - P. 1331.
Таким образом, при наличии высокого риска рестеноза следует использовать стенты с лекарственным покрытием. При имплантации стентов с лекарственным покрытием необходима пролонгированная двойная антикоагулянтная терапия.
Механическая травма при проведении ЧТА, нанесенная эндотелиальному слою и глубоким слоям сосудистой стенки, наличие самого стента являются мощнейшими стимуляторами для активации тромбоцитов и процесса свертывания. Таким образом, становится очевидным факт необходимости назначения антиагрегантной терапии.
Всем пациентам необходимо назначать терапию аспирином* и тиенопиридином [260]. Для полного достижения уровня антитромботической активности необходимо назначать клопидогрел за 6 ч до операции в дозе 300 мг, в идеальных условиях его следует назначать за сутки до запланированной операции [261]. До сих пор до конца не определена оптимальная продолжительность двойной антиагрегантной терапии после имплантации стентов с лекарственным покрытием, но многие доктора рекомендуют продолжительность терапии до года, особенно после комбинированного стентирования нескольких артерий и после сложной процедуры. Влияние возможной резистентности к антиагрегантной терапии требует дальнейшего тщательного исследования.
Ингибиторы гликопротеинов IIb/IIIa, наиболее мощные представители антиагрегантных препаратов, действуя на блокирование рецепторов фибриногена, доказали свою эффективность при ЧТА с высоким риском, в частности во время ОКС. Учитывая низкий риск при проведении ЧТА у больных со стабильным течением ИБС, мощность эффектов ингибиторов гликопротеинов IIb/IIIa в увеличении риска осложненного кровотечения и их значительную себестоимость при системном использовании, эти препараты не входят в состав стандартной антиагрегантной терапии, но необходимо их использовать при сложных ЧТА или связанных с высоким уровнем риска [264].
Низкомолекулярный гепарин обычно применяется болюсно, определяется время активации свертываемости и рассчитывается на массу (обычно 100 ЕД на кг или 50 ЕД на кг при одновременном применении ингибиторов гликопротеинов IIb/IIIa). В недавно проведенных исследованиях у пациентов, идущих на ЧТА, было установлено, что при однократном болюсном в/в введении эноксапарина 0,5 мг на кг массы наблюдалось снижение уровня кровоточивости по сравнению с применением низкомолекулярного гепарина и сопровождалось более предсказуемым эффектом антикоагулянтной терапии [265]. Бивалирудин является ингибитором прямого тромбина с кратковременным эффектом и может использоваться у больных с гепарин-индуцированной тромбоцитопенией [266]. Продолжение гепаринизации после завершения процедуры не рекомендуется.
В настоящее время стенты (DES) с лекарственным покрытием вытесняют простые металлические стенты (BMS). Их металлические основы покрыты полимерными соединениями, содержащими менее 0,1 мг цитотоксических и противовоспалительных компонентов (например, паклитаксел, сиролимус, эверолимус), исчезающими постепенно в течение первых недель после имплантации стентов. Три препарата показали одинаковые положительные эффекты в исследованиях с DES (паклитаксел, сиролимус и его производное эверолимус).
Применение в последнее время специальных приспособлений позволило сократить как уровень ангиографических рестенозов, так и необходимость прибегать к повторным вмешательствам вследствие рецидива симптомов более чем на 60% [256]. Частота зафиксированных случаев
возникновения тяжелых побочных эффектов, включающих необходимость повторного вмешательства, за последние 9 мес колеблется в пределах 7,1-0,3% со стентами с лекарственным покрытием (DES) по сравнению с уровнем 13,3-18,9% с простыми стентами (BMS). Современные рекомендации по использованию DES представлены в европейских рекомендациях по ЧТА [257]. Другое направление заключается в увеличении частоты использования прямого стентирования, т.е. осуществлении имплантации стентов без предварительной баллонной дилатации. Эксперименты на животных подтвердили тот факт, что при прямом стентировании не происходит повреждение сосудистой стенки и меньше повреждается эндотелий [258]. Если прямое стентирование осуществляется с DES, то частота рестенозов уменьшается до 2% [259].
Недостаток имплантации стентов заключается в наличии риска тромбоза стента, который приводит к высокой смертности на госпитальном этапе. Частота возникновения тромбоза стентов в течение первого года 2%, и прибавляется на 0,5% с каждым прожитым годом. Риск тромбоза стентов DES больше, чем BMS. Высокий риск тромбоза, ассоциированный с имплантацией DES, однако, не приводит к увеличению уровня смертности и развития ИМ (рис. 17.27). Таким образом, значительно уменьшая риск рестеноза по сравнению с обычными стентами, стенты с лекарственным покрытием напрямую уменьшают риск летального исхода и нефатального ИМ, тем самым компенсируя риск тромбоза стента [261]. В совокупности метаанализы и клинические исследования указывают на тот факт, что имплантация DES незначительно уменьшает уровень серьезных кардиальных осложнений, таких как летальный исход и ИМ, при сравнении с имплантацией BMS [262].

Рис. 17.27. Метаанализ со сравнением способов лечения. Прямое сравнение результатов клинических исследований, полученных при условии сохранения случайного распределения пациентов по группам (рандомизации). Риск ИМ и смерти или ИМ был одинаков для стентов, выделяющих сиролимус (SES), паклитаксель (PES) и обычных металлических стентов (BMS), как у пациентов с диабетом, так и без диабета. Изменено: Stettler C., Alleman S., Wandel S. et al. Drug eluting and bare metal stents in people with and without diabetes: collaborative network meta-analysis // BMJ. - 2008. - Vol. 337. - P. 1331.
Таким образом, при наличии высокого риска рестеноза следует использовать стенты с лекарственным покрытием. При имплантации стентов с лекарственным покрытием необходима пролонгированная двойная антикоагулянтная терапия.
Механическая травма при проведении ЧТА, нанесенная эндотелиальному слою и глубоким слоям сосудистой стенки, наличие самого стента являются мощнейшими стимуляторами для активации тромбоцитов и процесса свертывания. Таким образом, становится очевидным факт необходимости назначения антиагрегантной терапии.
Всем пациентам необходимо назначать терапию аспирином* и тиенопиридином [260]. Для полного достижения уровня антитромботической активности необходимо назначать клопидогрел за 6 ч до операции в дозе 300 мг, в идеальных условиях его следует назначать за сутки до запланированной операции [261]. До сих пор до конца не определена оптимальная продолжительность двойной антиагрегантной терапии после имплантации стентов с лекарственным покрытием, но многие доктора рекомендуют продолжительность терапии до года, особенно после комбинированного стентирования нескольких артерий и после сложной процедуры. Влияние возможной резистентности к антиагрегантной терапии требует дальнейшего тщательного исследования.
Ингибиторы гликопротеинов IIb/IIIa, наиболее мощные представители антиагрегантных препаратов, действуя на блокирование рецепторов фибриногена, доказали свою эффективность при ЧТА с высоким риском, в частности во время ОКС. Учитывая низкий риск при проведении ЧТА у больных со стабильным течением ИБС, мощность эффектов ингибиторов гликопротеинов IIb/IIIa в увеличении риска осложненного кровотечения и их значительную себестоимость при системном использовании, эти препараты не входят в состав стандартной антиагрегантной терапии, но необходимо их использовать при сложных ЧТА или связанных с высоким уровнем риска [264].
Низкомолекулярный гепарин обычно применяется болюсно, определяется время активации свертываемости и рассчитывается на массу (обычно 100 ЕД на кг или 50 ЕД на кг при одновременном применении ингибиторов гликопротеинов IIb/IIIa). В недавно проведенных исследованиях у пациентов, идущих на ЧТА, было установлено, что при однократном болюсном в/в введении эноксапарина 0,5 мг на кг массы наблюдалось снижение уровня кровоточивости по сравнению с применением низкомолекулярного гепарина и сопровождалось более предсказуемым эффектом антикоагулянтной терапии [265]. Бивалирудин является ингибитором прямого тромбина с кратковременным эффектом и может использоваться у больных с гепарин-индуцированной тромбоцитопенией [266]. Продолжение гепаринизации после завершения процедуры не рекомендуется.
Источник: Кэмм А. Джон, Люшер Томас Ф., Серруис П.В., «Болезни сердца и сосудов.Часть 4 (Главы 16-19)» 2011
А так же в разделе « ДОСТИЖЕНИЯ В ЛЕЧЕНИИ, ПРЕДУПРЕЖДЕНИЕ РЕСТЕНОЗОВ »
- ИНГИБИТОРЫ ЦИКЛООКСИГЕНАЗЫ
- ГОРМОНАЛЬНЫЕ ПРЕПАРАТЫ ПРИ ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ
- РЕВАСКУЛЯРИЗАЦИЯ МИОКАРДА
- ЧРЕСКОЖНАЯ АНГИОПЛАСТИКА
- ПОКАЗАНИЯ К ЧРЕСКОЖНОЙ АНГИОПЛАСТИКЕ
- АОРТОКОРОНАРНОЕ ШУНТИРОВАНИЕ
- ОПЕРАЦИИ НА РАБОТАЮЩЕМ СЕРДЦЕ
- ПОВТОРНЫЕ ОПЕРАЦИИ НА ВЕНЕЧНЫХ СОСУДАХ
- СРАВНЕНИЕ ЧРЕСКОЖНОЙ АНГИОПЛАСТИКИ И АОРТОКОРОНАРНОГО ШУНТИРОВАНИЯ
- ЛЕЧЕНИЕ РЕФРАКТЕРНОЙ СТЕНОКАРДИИ