СРАВНЕНИЕ ЧРЕСКОЖНОЙ АНГИОПЛАСТИКИ И АОРТОКОРОНАРНОГО ШУНТИРОВАНИЯ
Проводились многочисленные исследования по сравнению ЧТА и АКШ с целью определения предпочтительной тактики ведения, как до, так и после появления стентов. Метаанализ выполненных исследований до 1995 г., когда стентирование было редким, не выявило каких-либо значимых различий в стратегии лечения по критерию развития смерти или по комбинированной конечной точке - смерти и ИМ [302]. Уровень внутригоспитальной смертности в связи с выполненнием АКШ составил 1,3% по сравнению с 1% при ЧТА. Необходимость в повторной реваскуляризации была значительно выше в группе ЧТА, и хотя у пациентов значительно реже возникал рецидив стенокардии в течение года после АКШ, чем после ЧТА, через 3 года различие переставало быть статистически значимым. Результаты исследования BARI (Bypass Angioplasty Revascularization Investigation), крупнейшего исследования по сравнению ЧТА и хирургического вмешательства, не вошедшего в этот метаанализ, тем не менее подтверждали данное наблюдение, хотя уровень выживаемости в группе АКШ был выше у больных с диабетом [303]. По сравнению с эрой баллонной ангиопластики, ангиопластика с использованием стентов без
лекарственного покрытия сократила в 2 раза необходимость в повторной реваскуляризации миокарда в течение 1 года, которая, тем не менее остается около 18% после ЧТА по сравнению 4,4% после АКШ [304, 305].
Метаанализ исследований, изучавших использование стентов, подтверждает факт уменьшения уровня смертности у пациентов с многососудистым поражением коронарного русла после АКШ по сравнению с ЧТА на протяжении от 5 до 8 лет. Более того, было показано уменьшение частоты рецидивов стенокардии и необходимости в повторной реваскуляризации миокарда [306]. При анализе исследованных групп пациентов с имплантированными стентами и без них была определена неоднородность внутри групп. С учетом данных исследований в эру, предшествующую стентированию, было отмечено снижение уровня смертности после АКШ, который не был очевиден для стентирования. В недавнем метаанализе четырех рандомизированных контролируемых исследований с ЧТА со стентированием, сравниваемых с АКШ, было установлено, что между этими процедурами нет каких-либо существенных отличий в отношении развития первичных конечных точек - летальный исход, ИМ или инсульт в течение года [307]. Однако данные Нью-Йорского регистра (New York Cardiac Registry) по более чем 60 000 пациентов показали, что при двух- или более сосудистых поражениях венечных артерий выполнение АКШ приводит к значимому увеличению продолжительности жизни по сравнению с ЧТА [308]. Похожие данные были получены и в ходе более поздних исследований по сравнению АКШ и ангиопластики с использованием стентов с лекарственным покрытием [309].
Вышеуказанные исследования по сравнению ЧТА и АКШ были ограничены по одному или нескольким критериям:
они были ограничены строго отобранной субпопуляцией пациентов (обычно отражающей не более чем 5% всех осмотренных пациентов);
у них не было активного контроля за пациентами скринированными, но не рандомизированными;
в них не использовались современные, стандартные техники выполнения АКШ и ЧТА.
В исследовании SYNTAX (SYNergy between PCI with TAXus and cardiac surgery) были учтены все вышеуказанные факторы. Было набрано 3075 пациентов с многососудистым поражением и/или стенозом ствола левой венечной артерии; 1800 пациентов, у которых было возможно выполнение хирургической реваскуляризации миокарда, были рандомизированы; 1077 пациентов, которым было выполнено АКШ из-за наличия противопоказаний к ЧТА, и 198 пациентов, которым выполнена ЧТА при наличии противопоказаний к АКШ, были включены в регистры. Первичной конечной точкой было сочетание всех случаев - летальность, цереброваскулярные события, подтвержденный ИМ или повторная реваскуляризации в течение 12 мес наблюдения. Исследование не подтвердило преимуществ ЧТА по отношению к АКШ по первичной конечной точке, которая соответственно составила 13,7% в группе ЧТА и 5,9% в группе АКШ. Это различие было в основном обусловлено высокой частотой выполнения повторной реваскуляризации миокарда (14,7 против 5,4%), хотя уровень смертности, развития инсультов и ИМ был одинаков (7,7 против 7,6% соответственно). Был установлен интересный факт, что частота развития инсультов в группе после АКШ была больше, чем после ЧТА (2,2 против 0,6%), в то же время частота развития ИМ в группе ЧТА была выше по сравнению с АКШ (4,8 против 3,2%) (рис. 17.30). Среди пациентов после АКШ первичная конечная точка составила 8,8%. Таким образом, с учетом того, что около трети больных были с многососудистым поражением или стенозом ствола левой венечной артерии, у данной категории больных, благодаря АКШ, были достигнуты превосходные результаты. Среди пациентов после ЧТА (из регистра ЧТА) первичная конечная точка составила 20,5%. У этих пациентов, однако, предоперационный риск был выше. Таким образом, выполнение ЧТА показано пациентам с противопоказаниями к АКШ, где ожидается развитие тяжелых сердечно-сосудистых осложнений. Интересно, что авторам удалось разработать новую шкалу оценки описания сложности поражений венечных сосудов, на основе которых можно было предопределить первичный результат. Среди пациентов с низким уровнем риска (что составляло 1/3 всех исследуемых больных) частота достижения первичной конечной точки была одинакова как в группе АКШ, так и ЧТА [316].
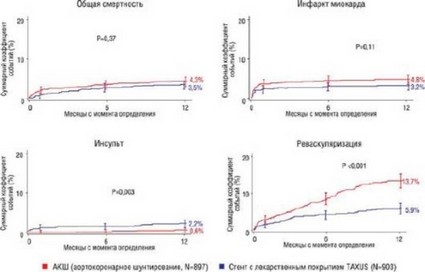
Рис. 17.30. Сравнение уровней общей кардиальной летальности, развития ИМ, нарушения мозгового кровообращения и регоспитализаций при проведении ЧТА с использованием стентов с лекарственным покрытием и АКШ в течение годичного наблюдения в исследовании SYNTAX. Материал предоставлен P. Serruys.
Некоторые группы пациентов нуждаются в детальном обсуждении при решении вопроса о возможности выполнения реваскуляризации миокарда. К таким группам относятся пациенты:
со значительным снижением функции ЛЖ и/или с высоким риском хирургического вмешательства;
с диабетом и многососудистым поражением;
с хронической тотальной окклюзией венечных артерий;
с осложнениями после выполненного ранее АКШ.
Логично предположить, что пациентам, у которых хирургический риск чрезмерно высок, можно рекомендовать выполнение реваскуляризации путем ЧТА, особенно когда оставшаяся жизнеспособная часть миокарда может подвергнуться неблагополучной перфузии основными сосудами. Однако это не было доказано в ходе клинических испытаний.
Хотя исследований по эффективности ЧТА или АКШ среди пациентов с диабетом не проводилось, но по косвеным результатам клинических исследований установлено, что последствия при выполнении ЧТА хуже, чем при АКШ [310]. Самым большим клиническим исследованием было BARI, в котором была обнаружена статистическая разница в летальном исходе между группами лечения больных с диабетом [303]. В исследовании ARTS-I (Arterial Revascularization Therapies Study) последствия для диабетиков были неблагоприятными при выполнении обоих видов реваскуляризации миокарда, но наиболее неблагоприятными при ЧТА. Через 3 года уровень смертности после ЧТА составил 7,1% и 4,2% после АКШ. Кроме того, отмечался различный уровень выживаемости без клинических событий (52,7% после ЧТА и 81,7% после АКШ [311]). По предварительным данным исследования ARTS-II [312] можно предположить, что использование стентов с лекарственным покрытием у пациентов с многососудистым поражением и/или наличием диабета может изменить данную ситуацию. Ожидается, что соотвествующие клинические испытания ответят на вопрос.
Хроническая тотальная окклюзия представляет собой анатомическое состояние, при котором выполнение ЧТА сопровождается малой эффективностью и высоким уровнем осложнений, таких как обширное расслоение, окклюзия боковых ветвей, эмболизация дистальных отделов и перфорация венечного сосуда [313]. При условии прохождения окклюзированного участка проводником и достижения дистального отдела возможно получение оптимального ангиографического результата с помощью установки стента, с ожидаемым высоким уровнем рестеноза (32-55%) [314]. В этом случае показано, что использование стентов с лекарственным покрытием приводит к наилучшим результатам [315].
К сожалению, клинических контролируемых рандомизированных исследований, сравнивающих особенности терапии у пациентов с выполненным АКШ, не проводилось. Повторная операция может быть выполнена при наличии симптомов заболевания и подходящего анатомического доступа. Однако риск операции при повторном АКШ в 3 раза выше, чем при первичном, и у тех, у кого шунт левой внутренней грудной артерии проходим, появляется риск повреждения его во время операции. С другой стороны, ЧТА могла бы выполняться после перенесенной операции хирургической реваскуляризации миокарда, как на венозном, так и на артериальном шунте, а также на нативных венечных артериях. Это может представлять собой альтернативу выполнению повторного АКШ для устранения симптомов.
Таким образом, после изначально консервативного подхода к терапии можно рекомендовать выполнение реваскуляризации миокарда пациентам с доступной анатомией сосудистого русла, у которых нет эффекта от медикаментозного лечения. При бессимптомном течении заболевания выполнение реваскуляризации не способно улучшить клиническую картину, и единственным уместным показанием к реваскуляризации миокарда будет профилактика будущих вероятных осложнений, связанных с ишемией миокарда. Показания для данного вида лечения ограничены пациентами с обширной ишемией и/или дисфункцией ЛЖ, у которых реваскуляризация (ЧТА или АКШ) способна снизить вероятность летального исхода. Пациентам без сопутствующего диабета с поражением одного или двух сосудов, без высокой степени стеноза проксимального отдела передней межжелудочковой ветви, у которых выполнение ангиопластики одного или нескольких стенозов может привести к улучшению клинического статуса, предпочтительно выполнение ЧТА. Это менее повреждающий инвазивный способ с отсутствием преимуществ в выживаемости при выполнении АКШ. Тактика ведения пациентов с более тяжелыми поражениями венечных артерий в каждом случае должна обсуждаться между эндоваскулярными и сердечно-сосудистыми хирургами. Некоторым пациентам показано проведение только АКШ или ЧТА. При условии, что оба метода способны в достаточной мере обеспечить оптимальную реваскуляризацию, выбор метода должен быть основан на индивидуальных обстоятельствах и предпочтениях пациента, учитывая, что более сложные поражения требуют преимущественно выполнения АКШ.
Следующие факторы должны всегда приниматься во внимание при выборе оптимального метода реваскуляризации миокарда:
риск внутриоперационных осложнений и смерти;
вероятность успеха операции, в том числе наличие таких факторов, как техническая возможность выполнения ангиопластики или АКШ;
риск рестеноза или окклюзии шунта;
полнота реваскуляризации;
наличие диабета;
опыт работы кардиохирургов и интервенционных кардиологов;
предпочтения пациента.
лекарственного покрытия сократила в 2 раза необходимость в повторной реваскуляризации миокарда в течение 1 года, которая, тем не менее остается около 18% после ЧТА по сравнению 4,4% после АКШ [304, 305].
Метаанализ исследований, изучавших использование стентов, подтверждает факт уменьшения уровня смертности у пациентов с многососудистым поражением коронарного русла после АКШ по сравнению с ЧТА на протяжении от 5 до 8 лет. Более того, было показано уменьшение частоты рецидивов стенокардии и необходимости в повторной реваскуляризации миокарда [306]. При анализе исследованных групп пациентов с имплантированными стентами и без них была определена неоднородность внутри групп. С учетом данных исследований в эру, предшествующую стентированию, было отмечено снижение уровня смертности после АКШ, который не был очевиден для стентирования. В недавнем метаанализе четырех рандомизированных контролируемых исследований с ЧТА со стентированием, сравниваемых с АКШ, было установлено, что между этими процедурами нет каких-либо существенных отличий в отношении развития первичных конечных точек - летальный исход, ИМ или инсульт в течение года [307]. Однако данные Нью-Йорского регистра (New York Cardiac Registry) по более чем 60 000 пациентов показали, что при двух- или более сосудистых поражениях венечных артерий выполнение АКШ приводит к значимому увеличению продолжительности жизни по сравнению с ЧТА [308]. Похожие данные были получены и в ходе более поздних исследований по сравнению АКШ и ангиопластики с использованием стентов с лекарственным покрытием [309].
Вышеуказанные исследования по сравнению ЧТА и АКШ были ограничены по одному или нескольким критериям:
они были ограничены строго отобранной субпопуляцией пациентов (обычно отражающей не более чем 5% всех осмотренных пациентов);
у них не было активного контроля за пациентами скринированными, но не рандомизированными;
в них не использовались современные, стандартные техники выполнения АКШ и ЧТА.
В исследовании SYNTAX (SYNergy between PCI with TAXus and cardiac surgery) были учтены все вышеуказанные факторы. Было набрано 3075 пациентов с многососудистым поражением и/или стенозом ствола левой венечной артерии; 1800 пациентов, у которых было возможно выполнение хирургической реваскуляризации миокарда, были рандомизированы; 1077 пациентов, которым было выполнено АКШ из-за наличия противопоказаний к ЧТА, и 198 пациентов, которым выполнена ЧТА при наличии противопоказаний к АКШ, были включены в регистры. Первичной конечной точкой было сочетание всех случаев - летальность, цереброваскулярные события, подтвержденный ИМ или повторная реваскуляризации в течение 12 мес наблюдения. Исследование не подтвердило преимуществ ЧТА по отношению к АКШ по первичной конечной точке, которая соответственно составила 13,7% в группе ЧТА и 5,9% в группе АКШ. Это различие было в основном обусловлено высокой частотой выполнения повторной реваскуляризации миокарда (14,7 против 5,4%), хотя уровень смертности, развития инсультов и ИМ был одинаков (7,7 против 7,6% соответственно). Был установлен интересный факт, что частота развития инсультов в группе после АКШ была больше, чем после ЧТА (2,2 против 0,6%), в то же время частота развития ИМ в группе ЧТА была выше по сравнению с АКШ (4,8 против 3,2%) (рис. 17.30). Среди пациентов после АКШ первичная конечная точка составила 8,8%. Таким образом, с учетом того, что около трети больных были с многососудистым поражением или стенозом ствола левой венечной артерии, у данной категории больных, благодаря АКШ, были достигнуты превосходные результаты. Среди пациентов после ЧТА (из регистра ЧТА) первичная конечная точка составила 20,5%. У этих пациентов, однако, предоперационный риск был выше. Таким образом, выполнение ЧТА показано пациентам с противопоказаниями к АКШ, где ожидается развитие тяжелых сердечно-сосудистых осложнений. Интересно, что авторам удалось разработать новую шкалу оценки описания сложности поражений венечных сосудов, на основе которых можно было предопределить первичный результат. Среди пациентов с низким уровнем риска (что составляло 1/3 всех исследуемых больных) частота достижения первичной конечной точки была одинакова как в группе АКШ, так и ЧТА [316].

Рис. 17.30. Сравнение уровней общей кардиальной летальности, развития ИМ, нарушения мозгового кровообращения и регоспитализаций при проведении ЧТА с использованием стентов с лекарственным покрытием и АКШ в течение годичного наблюдения в исследовании SYNTAX. Материал предоставлен P. Serruys.
Некоторые группы пациентов нуждаются в детальном обсуждении при решении вопроса о возможности выполнения реваскуляризации миокарда. К таким группам относятся пациенты:
со значительным снижением функции ЛЖ и/или с высоким риском хирургического вмешательства;
с диабетом и многососудистым поражением;
с хронической тотальной окклюзией венечных артерий;
с осложнениями после выполненного ранее АКШ.
Логично предположить, что пациентам, у которых хирургический риск чрезмерно высок, можно рекомендовать выполнение реваскуляризации путем ЧТА, особенно когда оставшаяся жизнеспособная часть миокарда может подвергнуться неблагополучной перфузии основными сосудами. Однако это не было доказано в ходе клинических испытаний.
Хотя исследований по эффективности ЧТА или АКШ среди пациентов с диабетом не проводилось, но по косвеным результатам клинических исследований установлено, что последствия при выполнении ЧТА хуже, чем при АКШ [310]. Самым большим клиническим исследованием было BARI, в котором была обнаружена статистическая разница в летальном исходе между группами лечения больных с диабетом [303]. В исследовании ARTS-I (Arterial Revascularization Therapies Study) последствия для диабетиков были неблагоприятными при выполнении обоих видов реваскуляризации миокарда, но наиболее неблагоприятными при ЧТА. Через 3 года уровень смертности после ЧТА составил 7,1% и 4,2% после АКШ. Кроме того, отмечался различный уровень выживаемости без клинических событий (52,7% после ЧТА и 81,7% после АКШ [311]). По предварительным данным исследования ARTS-II [312] можно предположить, что использование стентов с лекарственным покрытием у пациентов с многососудистым поражением и/или наличием диабета может изменить данную ситуацию. Ожидается, что соотвествующие клинические испытания ответят на вопрос.
Хроническая тотальная окклюзия представляет собой анатомическое состояние, при котором выполнение ЧТА сопровождается малой эффективностью и высоким уровнем осложнений, таких как обширное расслоение, окклюзия боковых ветвей, эмболизация дистальных отделов и перфорация венечного сосуда [313]. При условии прохождения окклюзированного участка проводником и достижения дистального отдела возможно получение оптимального ангиографического результата с помощью установки стента, с ожидаемым высоким уровнем рестеноза (32-55%) [314]. В этом случае показано, что использование стентов с лекарственным покрытием приводит к наилучшим результатам [315].
К сожалению, клинических контролируемых рандомизированных исследований, сравнивающих особенности терапии у пациентов с выполненным АКШ, не проводилось. Повторная операция может быть выполнена при наличии симптомов заболевания и подходящего анатомического доступа. Однако риск операции при повторном АКШ в 3 раза выше, чем при первичном, и у тех, у кого шунт левой внутренней грудной артерии проходим, появляется риск повреждения его во время операции. С другой стороны, ЧТА могла бы выполняться после перенесенной операции хирургической реваскуляризации миокарда, как на венозном, так и на артериальном шунте, а также на нативных венечных артериях. Это может представлять собой альтернативу выполнению повторного АКШ для устранения симптомов.
Таким образом, после изначально консервативного подхода к терапии можно рекомендовать выполнение реваскуляризации миокарда пациентам с доступной анатомией сосудистого русла, у которых нет эффекта от медикаментозного лечения. При бессимптомном течении заболевания выполнение реваскуляризации не способно улучшить клиническую картину, и единственным уместным показанием к реваскуляризации миокарда будет профилактика будущих вероятных осложнений, связанных с ишемией миокарда. Показания для данного вида лечения ограничены пациентами с обширной ишемией и/или дисфункцией ЛЖ, у которых реваскуляризация (ЧТА или АКШ) способна снизить вероятность летального исхода. Пациентам без сопутствующего диабета с поражением одного или двух сосудов, без высокой степени стеноза проксимального отдела передней межжелудочковой ветви, у которых выполнение ангиопластики одного или нескольких стенозов может привести к улучшению клинического статуса, предпочтительно выполнение ЧТА. Это менее повреждающий инвазивный способ с отсутствием преимуществ в выживаемости при выполнении АКШ. Тактика ведения пациентов с более тяжелыми поражениями венечных артерий в каждом случае должна обсуждаться между эндоваскулярными и сердечно-сосудистыми хирургами. Некоторым пациентам показано проведение только АКШ или ЧТА. При условии, что оба метода способны в достаточной мере обеспечить оптимальную реваскуляризацию, выбор метода должен быть основан на индивидуальных обстоятельствах и предпочтениях пациента, учитывая, что более сложные поражения требуют преимущественно выполнения АКШ.
Следующие факторы должны всегда приниматься во внимание при выборе оптимального метода реваскуляризации миокарда:
риск внутриоперационных осложнений и смерти;
вероятность успеха операции, в том числе наличие таких факторов, как техническая возможность выполнения ангиопластики или АКШ;
риск рестеноза или окклюзии шунта;
полнота реваскуляризации;
наличие диабета;
опыт работы кардиохирургов и интервенционных кардиологов;
предпочтения пациента.
Источник: Кэмм А. Джон, Люшер Томас Ф., Серруис П.В., «Болезни сердца и сосудов.Часть 4 (Главы 16-19)» 2011
А так же в разделе « СРАВНЕНИЕ ЧРЕСКОЖНОЙ АНГИОПЛАСТИКИ И АОРТОКОРОНАРНОГО ШУНТИРОВАНИЯ »
- ИНГИБИТОРЫ ЦИКЛООКСИГЕНАЗЫ
- ГОРМОНАЛЬНЫЕ ПРЕПАРАТЫ ПРИ ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ
- РЕВАСКУЛЯРИЗАЦИЯ МИОКАРДА
- ЧРЕСКОЖНАЯ АНГИОПЛАСТИКА
- ДОСТИЖЕНИЯ В ЛЕЧЕНИИ, ПРЕДУПРЕЖДЕНИЕ РЕСТЕНОЗОВ
- ПОКАЗАНИЯ К ЧРЕСКОЖНОЙ АНГИОПЛАСТИКЕ
- АОРТОКОРОНАРНОЕ ШУНТИРОВАНИЕ
- ОПЕРАЦИИ НА РАБОТАЮЩЕМ СЕРДЦЕ
- ПОВТОРНЫЕ ОПЕРАЦИИ НА ВЕНЕЧНЫХ СОСУДАХ
- ЛЕЧЕНИЕ РЕФРАКТЕРНОЙ СТЕНОКАРДИИ