Впервые толерантность к клеточным антигенам была обнаружена американским исследователем Р. Оуеном в 1945 г. у дизи- готных телят-близнецов. Такие близнецы не являются генетически идентичными, так как развиваются из разных оплодотворенных яйцеклеток. В процессе эмбриогенеза у телят устанавливается общий плацентарный кровоток, что приводит к обмену клетками крови между ними. В результате каждый теленок представлял собой химеру, обладая как собственными клетками крови, так и клетками близнеца. При взаимной иммунизации телят клетками 308 криви близнецы оставались ареактивными к аллоантигенам партнера по внутриутробной жизни. Английский исследователь П. Me- давар и его сотрудники показали, что дизиготные близнецы взаимно толерантны к кожному трансплантату, пересаживаемому от одного близнеца другому, несмотря на различия по полу и окраске. В то же время (конец 40-х — начато 50-х годов) было установлено, что толерантность воспроизводится не только к кожным трансплантатам, но и к вирусным антигенам. При иммунизации новорожденных мышей непатогенным вирусом лимфоцитарного хориоменингита иммунитет не вырабатывается, и вирус персис- тирует в организме хозяина в течение всей его жизни. В то же время введение вируса взрослым животным приводит к быстрой элиминации вирусных частиц.
Наиболее демонстративные опыты, иллюстрирующие специфичность иммунологической неотвечаемости, были проведены в лаборатории П. Медавара с инбредными линиями мышей. Толерантность к антигенам гистосовмесгимости оценивалась по отторжению кожного трансплантата. Эмбрионам мышей линии СВА (гап- лотип Н-2к) вводили клетки селезенки мышей А (Н-2а). После достижения взрослого состояния мышам СВА пересаживали кожный лоскут донора А. Такой аллотрансплантат приживался. Трансплантат от любой другой линии мышей, отличающейся по антигенам гистосовместимости как от донора, так и реципиента, отторгался обычным способом. Чешский исследователь М. Гашек смог индуцировать иммунологическую толера!ггиость у кур слиянием хориоаллантоисных мембран двух эмбрионов, что приводило к установлению общего кровотока.
На первых этапах работы состояние толерантности оценивали по отторжению аллотрансплантата у мышей, которым предварительно вводили клетки донора-трансплантата. Было показано, что для индукции толерантного состояния требуется введение критического числа живых гемопоэтических клеток сразу после рождения животных-реципиентов. Клетки других тканей или мертвые клетки не инициировали толерантность. Состояние иммунологической неотвечаемости можно оценить не только при использовании кожного трансплантата, но и по реакции в смешанной культуре лимфоцитов (СКЛ), когда лимфоциты реципиента помешают в культуру с клетками донора. Отсутствие пролиферативного ответа клеток реципиента на антигены гистосовместимости донора указывает на создание толерантного состояния. Эффективность создания толерантности зависит также от степени антигенных различий между донором аллогенных клеток и реципиентом. Так, при работе с конгенными и рекомбинантными линиями мышей было показано, что толерантность индуцируется легче при различиях
If1'*
по антигенам II класса, чем при различиях по антигенам I класса МНС. Различия по всему комплексу Н-2 дают наибольший эффект в создании толерантности.
Толерантность удается индуцировать не только к антигенам гистосовместимости, но и к белковым антигенам, хотя и с большими трудностями. К сильным иммуногенам специфическая нео- твечаемостъ, как правило, не формируется. Напротив, слабо иммуногенные белки индуцируют продолжительную ареактивность, особенно если вводятся животным несколько раз.
Классический путь воспроизведения толерантного состояния — это введение антигена в новорожденный организм, чья иммунная система еще не приобрела полноценного развития. Однако при определенных условиях специфическую неотвечаемость можно воспроизвести и у зрелого организма. Вот некоторые из условий.
- Во всех случаях эффективность индукции толерантности у взрослых обратно пропорциональна степени иммуногенности антигена: чем более иммуногенен антиген, тем труднее создать толерантное состояние. Например, альбумин является слабым иммуногеном. Он длительное время циркулирует в кровотоке и плохо захватывается антигенпрезентирующими клетками. Эти его особенности создают условия для относительно легкой индукции толерантности. В то же время создание толерантности к сильным иммуногенам, в частности к чужеродным эритроцитам, часто терпит неудачу.
- Успех индукции толерантности зависит также от дозы используемого антигена. Так, опыты с бычьим сывороточным альбумином показали, что толерантное состояние воспроизводится либо при использовании дозы ниже той, которая является иммуногенной, либо при очень высокой дозе. Эти факты послужили основой для разработки концепции низкодозовой и высокодозо- вой толерантности.
- Антигены, которые плохо деградируют в организме животных, являются лучшими толерогенами, чем те, которые характеризуются метаболической нестабильностью. Известно, что полимеры D-аминокислот в отличие от L-аминокислот не подвержены гидролитическому разрушению вообще или только в крайне слабой форме. Конъюгация гаптена (например, ДНФ) с синтетическим пептидом, составленным из D-аминокислот, обеспечивает развитие толерантности к гаптену. В то же время конъюгат гаптена с L-аминокислотами не способен индуцировать толерантность.
- Способность многих белков к агрегации является фактором повышения их иммуногенности. Такое повышение связано с более активным захватом белковых агрегатов макрофагами. Использование дезагрегированных белков, таких как альбумин, иммуноглобулин, обеспечивает более легкое создание толерантного состояния.
- Взаимодействие иммуноглобулина с Fc-рецептором может быть одним из факторов индукции толерантности. Так, конъюгат аутологичного иммуноглобулина с гаптеном вызывает толерантность к гаптену в отличие от конъюгата этого же гаптена с альбумином или F(ab'h.
- Использование иммуносупрессорных агентов благоприятствует созданию толерантности. Одновременное введение с антигеном ингибиторов клеточного деления — метатрексата, цикло- фосфамида, 6-меркаптопурина —* обеспечивает относительно легкую индукцию толерантности.
В таблице 12.1 представлены некоторые из условий индукции толерантности к гаптену ДНФ.
Таблица 12.1
Некоторые условия индукции толерантности у взрослых мышей
|
Антиген |
Время полураспада антигена |
Поглощение макрофагами |
Иммуни тет |
Толеран тность |
|
ДНФ-гемоцианин |
минуты |
++++ |
++++ |
— |
|
ДНФ-мономер ГГЧ |
дни |
+ |
± |
+++ |
|
Д Н Ф-пол и мер ГГЧ |
минуты |
+++ |
+++ |
— |
|
ДНФ-аугалог. IgG |
дни |
+ |
— |
+++ |
|
ДНФ-аутолог. альбумин |
дни |
± |
— |
+ |
|
днФ-L-m |
минуты |
++ |
— |
± |
|
ДНФ-О-ГЛ |
минуты |
++ |
— |
+++ |
|
Примечание: ГГЧ — гамма-гло |
булин человека, ДНФ-L-rJl |
— ДИНИТ- |
||
рофенил-L-поли глутаминовая кислота и полилизин 12.2. КЛЕТОЧНЫЕ ОСНОВЫ ТОЛЕРАНТНОСТИ
Становление толерантности есть активный процесс, связанный с участием различных типов клеток.
В системе переноса иммунокомпетентных клеток от толерант ных мышей в организм интактных, облученных животных было установлено, что состояние толерантности зависит как от Т-, так и В-клеток (рис. 12.1).Введение облученным мышам тимусзависи- мых клеток от толерантных животных вместе с интактными 13- лимфоцитами, также как и введение в обратном сочетании, т.е. В- клетки — от толерантных мышей, а Т-клетки — от интактных, приводит к толерантному состоянию у реципиентов. Причем, Т- зависимая толерантность — более стойкая по сравнению с В-за- висимой ареактивностью. Более того, для индукции толерантности, связанной с В-клетками, требуется большая доза толерогена.
Существенным моментом является участие макрофагов в индукции толерантности. В тех случаях, когда антиген активно захватывается макрофагами, индуцировать толерантность не удается (табл 12.1). Напротив, слабое участие макрофагов в поглощении антигена обеспечивает, как правило, развитие толерантности.
зп
Связано это явление с тем, что толероген, минуя антигенпрезен- тирующую клетку, действует непосредственно на специфические клоны лимфоцитов, что приводит к нарушению нормальной клеточной кооперации при формировании иммунного ответа.
Относительная легкость индукции толерантности у неонатальных мышей связывают, в частности, с малочисленностью субпопуляции макрофагов, экспрессирующих молекулы II класса МНС (1а-антигены). В ситуации недостатка 1а+-макрофагов Т-хелперы не отвечают на тимусзависимые антигены, что и способствует развитию толерантности.
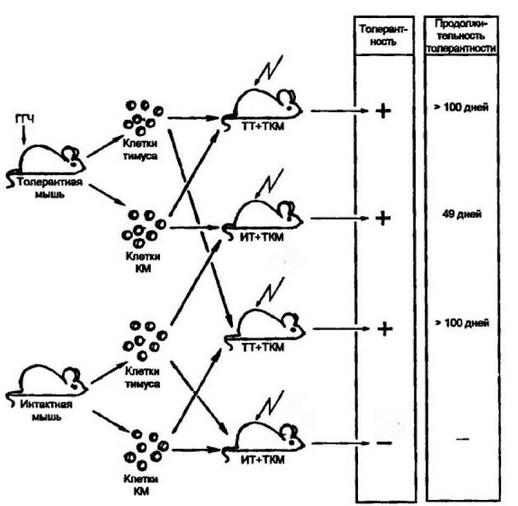
Рис. 12.1. Участие тммощггов и клеток костного мозга gt; создании толерантного сое го лиха.
Перенос клеток тимуса и костного мозга от толерантных мышей в облучен- пых животных вызывает прочную, более 100 дней, неотвечаемость реципиента на использованный антиген. Тимоциты в отличие от клеток костного мозга обеспечивают более длительное состояние толерантности. ГГЧ — гамма-глобулин человека; ТТ и ТКМ — тимоциты и клетки костного мозга от толерантных мышей; ИТ и ИКМ — тимоциты и клетки костного мозга от интактных мышей, соответственно
В создании толерантности, возможно, участвуют специфические Т-супрессоры. Активность этих клеток реализуется через хел- перные Т-клетки. Известно, что Т-супрессоры подавляют функцию Т-хелперов, препятствуя тем самым их успешной кооперации с В-лимфоцитами. Примером участия Т-супрсссоров в создании толерантности могут служить опыты на крысах с использованием модели отторжения кожного трансплантата. Показано, что предварительная инъекция новорожденным крысятам аллогенных клеток костного мозга обеспечивает приживление соответствующего трансплантата. Индуцируемая таким способом толерантность высокоспецифична и может быть перенесена нормальным взрослым реципиентам с помощью лимфоцитов первичного реципиента. Этот факт демонстрирует, что индуцируемая толерантность во втором хозяине есть активный процесс, связанный с лимфоцитами, подавляющими иммунную реакцию этого хозяина на аллогенный трансплантат. Введение вторичному реципиенту большого количества нормальных сингенных лимфоцитов не отменяет индуцируемой супрессорными клетками толерантности. Имеются и другие аналогичные примеры. К сожалению, механизм действия Т-супрессоров в создании антигенспецифической толерантности до сих пор неясен.
Существенным моментом сохранения толерантного состояния является длительное пребывание антигена в организме (табл. 12.1). Присутствие такого антигена в свободной форме обеспечивает вступление в реакцию блокады все новых Т- и В-клеток, специфически взаимодействующих с данным антигеном. Исключение составляет конъюгат ДНФ с D-формами полиглутаминовой кислоты — полилизина. Механизм создания толерантности в данном случае, очевидно, отличается от общих правил, так как особая форма аминокислот, составляющих антиген, включает и особый путь его метаболизма.
