Механизмы перечисленных этапов контактного цитолиза в настоящее время изучены достаточно полно. Иммунный синапс, называемый также супрамолекулярным активационным кластером (SMAC — Supramolecular activation cluster), — универсальная основа взаимодействия клеток при презентации антигена (см. раздел 3.5.1.3) и осуществлении контактного кил- линга. Формирование иммунного синапса происходит с участием двух классов молекул — молекул адгезии, формирующих контакт между клетками, и рецепторных молекул и их мишеней, обусловливающих специфический характер взаимодействия. В запуске активационных сигналов участвуют связанные с рецепторами ферменты и адапторные белки, доставляемые в синапс в составе рафтов — обогащенных сфинголипидами и холестерином липидных доменов в составе клеточной мембраны.
Синапс, образующийся при контактном цитолизе клеток-мишеней естественными киллерами или Т-лимфоцитами (см. раздел 3.6.1.1), называют цитотоксическим иммунным синапсом (рис. 2.36). Для его формирования необходимо отсутствие ингибирующих сигналов (экспрессия МНС-I) и распознавание молекул-мишеней активирующими рецепторами. Решающую роль на начальном этапе формирования такого синапса играют молекулы адгезии — в2-интегрины (LFA-1, Mac-1 — со стороны киллера) и их рецепторы (особенно ICAM-1, ICAM-2 — со стороны клетки-мишени), а также молекула CD2 и ее рецептор CD58. Уже на этом этапе происходит мобилизация к синапсу некоторых внутриклеточных структур — компонентов цитоскелета и ферментов. При помощи белка талина устанавливается связь синапса с цитоскелетом и происходит полимеризация актина (формирование F-актина), осуществляемая с участием белка WASP (от Wiskott-Aldrich syndrome protein), играющего роль посредника между актиновыми нитями и мембраной клетки. С участием F-актина происходит перемещение раф- тов и формируется организующий центр микротрубочек. Микротрубочки ориентируются по направлению к клетке-мишени, и по ним к синапсу транспортируются гранулы, содержащие перфорин. К синапсу в составе рафтов доставляется PLC (изоформа у), адапторные белки LAT, SLP-76, протеинкиназы Fyn, Lck, Syk, ZAP-70, Itk, PKC (изоформа 0).
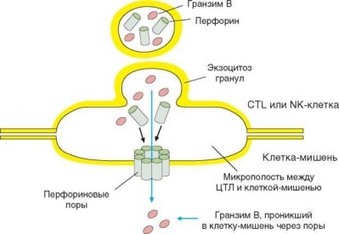
Рис. 2.36. Структура цитолитического синапса. Цитолитический синапс формируется при распознавании киллером клетки-мишени. Синапс стабилизируется молекулами адгезии. В его центральной части формируется микрополость, в которую секрети- руется перфорин, гранзимы и другие участвующие в цитолизе вещества. Секреция ориентирована таким образом, что акцептором этих веществ становится мембрана клетки-мишени. Далее — см. текст
В центре синапса на мембране NK-клеток расположены активационные рецепторы, а на мембране клеток-мишеней — их лиганды. При взаимодействии активационного рецептора NKG2D с лигандом происходит перекрестное связываение 2 рецепторов. Это необходимо для нековалентного взаимодействия NKG2D с адапторными белками DAP-10 (два белка DAP-10 на 1 рецептор). При этом происходит фосфорилирование мотива YXXM в молекуле DAP-10 (при участии тирозинкиназ Src) и запускается активационный сигнал, передаваемый через PI3K. Происходит формирование мультимолекулярного комплекса, включающего 2 молекулы рецептора NKG2D, 4 молекулы белка DAP-10, p85-субъединицу киназы PI3K, адапторный белок Grb2 и GEF-белок (GEF — Guanine nucleotide exchange factor) Vav1. Это приводит к активации не только PI3K, но и PLCy, а также ГТФазы семейства Rho. Затем в процесс вовлекаются киназы р38, Jak3, EKK1/2, MEK1/2 и транскрипционный фактор STAT5 — компоненты нескольких параллельных сигнальных путей. Результат этой последовательности молекулярных событий — мобилизация ионов Са2+ из внутриклеточных депо и индукция ряда транскрипционных факторов (в частности NFkB и AP-1), ответственных за экспрессию активационных генов. Это обеспечивает ответ NK-клеток, проявляющийся в одной из двух основных форм — развитии цитотоксической реакции (в случае CD56dim клеток, или синтезе цитокинов в случае CD56bright клеток.
При связывании лиганда FcyRIII NK-клеток активация происходит сходным образом. При взаимодействии с Fc-фрагментом IgG происходит
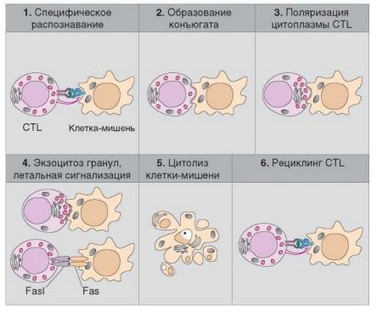
Рис. 2.37. Этапы клеточного цитолиза клетки-мишени естественным киллером
димеризация FcyRIII, приводящая к фосфорилированию последовательности ITAM в его цитоплазматической части, что обусловливает активацию Scr-киназ. Эти киназы фосфорилируют Z- или FceRIy-цепи, что приводит к активации PI3K. Дальнейшие события развиваются так же, как и при активации через рецептор NKG2D. Параллельно активируется фосфатаза SHIP1, обеспечивающая возврат клетки в исходное состояние после завершения ответа.
Если в зоне контакта ингибирующие рецепторы распознают сингенные молекулы МНС-I, формируется ингибиторный иммунный синапс. Его особенность состоит в образовании кластеров ингибиторных рецепторов KIR, CD95/NKG2, LILR с фосфорилированием ингибиторного мотива ITIM и рекрутированием к нему фосфатаз SHP1 и SHP2. Под влиянием этих фосфатаз происходит подавление начавшегося фосфорилирования Scr-киназ и мобилизация талина к месту контакта. Особенно важно на этом этапе дефосфорилирование белка Vav-1. В результате контакт между клетками быстро (в течение нескольких минут) нарушается. В отличие от ситуации с активационным синапсом в этом случае отсутствует привлечение в зону контакта рафтов, содержащих ферменты и адапторные белки. Последствия ингибиторного сигнала быстро проходят и через короткий промежуток времени клетка вновь приобретает способность к активации.
