Лазерная низкоинтенсивная терапия и биостимуляция.
На рубеже XIX и XX веков в медицине происходило бурное развитие нового метода лечения - фототерапии (или светолечения), а именно: лечение с использованием узких спектров видимой области света (фотохромотерапии). Ранее светолечение применялось на протяжении столетий для лечения различных заболеваний. До изобретения электричества применялся солнечный свет, пропущенный через различные фильтры. Наиболее действенной считалась красная область света. При помощи красного света лечили оспенную лихорадку, рожистое воспаление, трофические нарушения ещё в начале прошлого столетия. Предполагалось, что красный свет повышает устойчивость организма к инфекции. Для лечения особенно тяжелых инфекционных больных организовались специальные палаты, в которых окна драпировались плотным красным шелком и не допускались посторонние источники света.
В 1889 году датский врач-исследователь Нильс Финзен (1860-1904 гг.) изобрёл аппарат, разработал принципы и методику фототерапии.
Методика Финзена с успехом прошла клинические испытания. Им же был организован институт светолечения и клиника для больных - Финзеновский медицинский Институт Света (Copenhagen).
Принципы, сформулированные Н. Финзеном, звучат чрезвычайно современно: различные спектры светового излучения оказывают различное терапевтическое действие. Наиболее эффективны области красного и синего света: "красный лечит всё хроническое, синий - всё острое".
Эффективность фототерапии зависит от качества фильтрации света (т.е. от спектральной плотности световой энергии). Лечение необходимо проводить в затемнённом помещении при отсутствии посторонних источников света. Аппарат Финзена представлял собой устройство с ярким источником света - дуговой лампой, системой линз для фокусировки луча и рубиновым фильтром для фильтрации света. Таким образом, излучаемый спектр находился в пределах 0,64^0,68 мкм с предполагаемой мощностью излучения около 5-^10 мВт. Н. Финзен настаивал на применении именно рубинового фильтра, подчеркивая, что использование фильтра из крашеного стекла существенно снизит терапевтическую эффективность.
Показания к хромотерапии по Финзену были достаточно широки: от оспенной лихорадки до лечения трофических нарушений и заболеваний опорно-двигательного аппарата дистрофического и воспалительного характера. Клинический эффект лечения "чистым красным светом" объяснялся просто: повышение сопротивляемости организма. Синий свет, полученный в результате фильтрации через кобальтовое стекло, применялся при травмах мягких тканей в остром периоде и способствовал уменьшению посттравматического отека и кровоизлияний.
Работы Н. Финзена получили признание учёного мира того времени, и в 1903 году он был удостоен Нобелевской премии в области медицины.
Метод Финзена нашёл своих последователей и в России, где практически во всех крупных городах были организованы лечебные кабинеты. Судя по научным дискуссиям в медицинских журналах того времени, эффективность метода была достаточно высока. Как это нередко бывает в медицине, практический опыт и эмпирические знания намного опередили научное объяснение.
Однако метод фотохромотерапии был всё-таки на время забыт. В дальнейшем появление работ американских радиобиологов в области фотореактивации объясняющих эффект фототерапии, а главное, изобретение лазеров явилось предпосылкой к продолжению работ в области фототерапии в ее новом качестве - лазеротерапии.
Установлено, что наибольший биологический эффект оказывает лазерное излучение красной области видимого спектра, а наиболее подходящими источниками света для стимуляции биологических процессов являются гелий-неоновые лазеры.
Подавляющее большинство работ по клиническому применению низкоэнергетического лазерного излучения выполнено в нашей стране, являющейся пионером этого направления исследований. Публикации отечественных учёных, в которых сообщается о благоприятных результатах применения гелий-неонового лазера в хирургии, ортопедии, стоматологии, гинекологии и др., исчисляются сотнями, и уже имеются монографии, в которых обобщены данные по отдельным областям медицины. Серия исследований проведена в Венгрии, появились первые сообщения о клинических результатах, полученных в Италии, Германии и др. В связи с многочисленностью клинических данных, не позволяющих сомневаться в реальности феномена биостимуляции, возникла
необходимость установить процессы, лежащие в его основе, которые до последнего времени оставались практически неизвестными.
В 70-х годах были сделаны попытки объяснить явление лазерной биостимуляции особыми свойствами ("биополе", "биоплазма"), которые якобы присущи живым организмам и придают специфическим характеристикам лазерного излучения биологическую значимость.
Отсутствие в этих построениях фактического обоснования и произвольность сделанных допущений не позволяли с ними согласиться, и, следовательно, вопрос оставался открытым.
В 1979 году было выдвинуто предположение, что биологические эффекты низкоэнергетического лазерного излучения связаны с естественными процессами световой регуляции, наблюдающимися у животных. Молекулярная основа начальных этапов таких процессов лучше изучена у растений, для которых установлены не только сам факт фоторегуляции, но и химическая природа одного из первичных акцепторов света - фитохрома. Этот хромопротеид существует в двух формах, одна из которых поглощает свет вблизи 660 нм, а другая - 730 нм. Вследствие взаимопревращения этих форм при освещении меняется их количественное соотношение, что является пусковым механизмом в цепи процессов, приводящих в конечном счёте к прорастанию семян, образованию почек, зацветанию растений и другим формообразовательным эффектам. Хотя не вызывает сомнения тот факт, что и у животных в основе таких явлений, как цикличность полового размножения или приуроченность ряда приспособительных реакций (линька и спячка млекопитающих, перелёты птиц) к определённым периодам года, лежат фоторегуляторные процессы.
В 1982 году венгерским хирургом Е. Местером была выдвинута гипотеза, в которой была предпринята попытка объяснить
биостимуляционную активность лазерного излучения исключительно его поляризованностью: благодаря поляризации излучения оно способно
реагировать с полярными молекулами липидов в двойном липидном слое цитоплазматической мембраны, что и запускает цепь изменений в клетке. Согласно предложенной модели, стимулирующий эффект не должен зависеть от длины волны излучения. Однако экспериментальные данные этого не подтверждают.
Последующие исследования позволили выявить у разных клеток человека и животных наличие высокой световой чувствительности, даже значительно большей, чем можно было ожидать на основании клинических результатов лазерной биостимуляционной терапии. Эта чувствительность не была обусловлена когерентностью и поляризацией света и не ограничивалась красной областью спектра: наряду с максимумом в этой области имелись два других - в фиолетовом и зелёном участках спектра.
Используя иной методический подход (определение интенсивности синтеза ДНК в клетках культуры HeLa по включению меченого тимидина), Т.И. Кару и соавт. (1982, 1983) также показали, что эффект биостимуляции не связан с когерентностью и поляризацией света.
С момента первых публикаций по лазерной терапии возникают дискуссии о специфичности биологического влияния низкоинтенсивного излучения лазеров.
В настоящее время существуют две основные конкурирующие теории. Первая, наиболее популярная, рассматривает лазерное излучение как один из факторов активации неспецифической резистентности организма, который следует объяснять исходя из точки зрения целостности организма. Вторая теория основана на идее влияния "специфического" монохроматического света на некие особые системы фоторегуляции, существующие для опосредованного регуляторного действия солнечного света на организм животных, т.е. предполагают наличие фотоакцепторов.
Светоакцептором в гипотетической системе фоторегуляции животных клеток служит какое-то соединение из группы порфиринов, являющихся, как известно, составной частью многих важных биохимических компонентов организма животных - гемоглобина, цитохромов, ряда ферментов и др.
В 1978 году С.М. Зубкова высказала предположение, что
биостимулирующее действие излучения гелий-неонового лазера связано с его поглощением порфиринсодержащим ферментом каталазой, имеющим максимум светоабсорбции порядка 628 нм. На основании этой теории параметры лазерного излучения во многом определяют ответную реакцию организма.
Выбор длины волны оптического (лазерного) излучения для биостимуляции или низкоинтенсивной терапии в той или иной степени может быть обоснован поглощением излучения кровью. Спектр поглощения насыщенной кислородом (HbO2) и ненасыщенной кислородом (Hb) крови представлен на рис. 5-3-1.
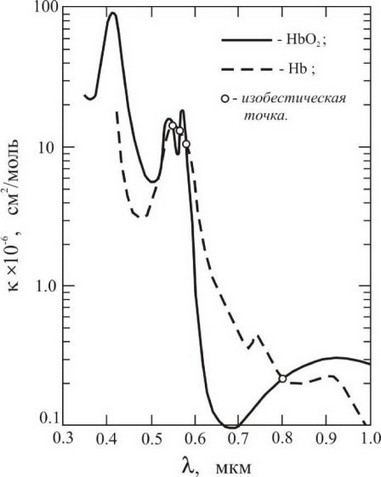
Рис. 5-3-1. Спектр поглощения крови (насыщенной кислородом (HbO2) и ненасыщенной кислородом (Hb)).
Если интересует воздействие на ткани и органы, расположенные достаточно глубоко (в области дермиса и т.д.), то оптимальной может
быть область длин волн 0,6^0,7 мкм. Если интересует воздействие на приповерхностные слои кожи (эпидермис и т.д.) или воздействовать на приповерхностные слои открытых органов, то целесообразно использовать длины волн меньше 0,6 мкм.
Итак, при воздействии лазера на ткани возникают фотофизические и фотохимические реакции, связанные с поглощением световой энергии тканями и нарушением слабых молекулярных связей, а также происходят восприятие и перенос эффекта лазерного излучения жидкими средами организма. Наличие в биологических тканях специфических фотоакцепторов, в частности гемоглобина, порфиринов, циклических нуклеотидов, железо- и медьсодержащих ферментов (каталаза, супероксиддисмутаза), ферментов окислительно-восстановительного цикла (цитохромы, пигменты и другие вещества), усиливает восприимчивость биологических тканей к лазерному излучению.
Фотоактивация в организме человека происходит многоступенчато: поглощение квантов света, первичный фотофизический и
фотохимический акт, промежуточные стадии, включающие образование в тканях фотосенсибилизированных продуктов или перенос энергии на мембранных компонентах клеток, образование в тканях физиологически активных соединений, нейрогуморальные реакции, конечный
фотобиологический эффект.
Лазерное излучение вызывает: стимуляцию синтеза коллагена; повышение энергизации митохондрий; усиленное образование АТФ; увеличение активности дыхательных ферментов (каталазы,
цитохромоксидазы); активацию метаболизма клеток и повышение их функциональной активности; стимуляцию репаративных процессов; противовоспалительное действие; активизацию микроциркуляции крови и повышение уровня трофического обеспечения тканей;
анальгезирующее действие; усиление реакций клеточного и
гуморального звена иммунитета, нормализацию неспецифической иммунной зашиты, коррекцию иммунного статуса; рефлексогенное действие на функциональную активность различных органов и систем; десенсибилизирующее действие; гипохолестеринемический эффект; бактерицидный и бактериостатический эффект; дезинтоксикационный эффект за счёт конформационных изменений белковых и иммунных структур; повышение парциального давления кислорода и интенсификацию окислительно-восстановительных процессов;
активацию антиоксидантной системы и повышение устойчивости мембран к продуктам перекисного окисления липидов.
Эффект воздействия лазерного излучения на ткани зависит от его параметров: длины волны, которая определяет глубину проникновения в ткани и степень отражения излучения от поверхности, мощности излучения и времени воздействия. В лазеротерапии используют световые потоки низкой интенсивности не более 100 мВт/см . Данное воздействие
называют низкоинтенсивным (НИЛИ), в англоязычной литературе - LLLT (Low Level Laser Therapy), как было предложено Т. Ohshiro и G. Calderhead в 1988 году [7].
Специфическое действие лазерного излучения определяется воздействием на определенное звено патогенеза, после чего запускаются генетически обусловленные процессы выздоровления (саногенез). Реализация его осуществляется, прежде всего, на клеточном, тканевом, регионарном уровнях.
На уровне тканей и органов было показано, что действие низкоэнергетического лазерного излучения проявляется в стимуляции изменений рецепторной чувствительности, укорочении фазы воспаления, увеличении потребления тканями кислорода, улучшении
микроциркуляции крови, активации транспорта веществ через сосудистые стенки.
Результирующий фотобиологический эффект действия лазерного излучения на организм в целом выражается в противовоспалительной, регенеративной, иммунокорректирующей и бактериостатической реакциях, в улучшении региональной микроциркуляции в тканях и органах, нормализации липидного обмена.
Степень проявления того или иного эффекта зависит от длины волны излучения, плотности мощности и дозы воздействия. Экспериментальные и клинические исследования позволили определить пределы возможных изменений параметров воздействия для обеспечения биостимулирующего эффекта:
2
- по плотности мощности - 0,1^100 мВт/см ;
- по плотности энергии - 1,0^10 Дж/см ;
- длина волны излучения - 337, 404, 415, 441, 500, 570, 620, 632, 680, 760, 830, 890,1064 и 1260 нм.
Итоговый результат фотобиологического процесса, заключающийся в кратко- или долговременной адаптации организма, - это ответ биологического объекта на лазерное воздействие на клеточном и тканевом уровне, причём само воздействие играет роль триггера, запускающего всю цепь преобразований в биообъекте. Поэтому вторичные проявления и конечные результаты, выражающиеся в реакции организма многообразны, хотя первичные фотоакцепторные акты достаточно просты и немногочисленны.
Лазерное излучение при определённых его параметрах может выступать и в качестве раздражителя, вызывающего неспецифическую реакцию адаптации. В этом случае его реализация осуществляется опосредованно через центральные механизмы регуляции.
Механизм реализации терапевтического эффекта
низкоэнергетического лазерного света и его специфичность представляются как воздействие на дегенеративно-дистрофический процесс на клеточном, тканевом и системном уровнях:
- На клеточном уровне реализована уникальная способность лазерного
света восстанавливать генетический и мембранный аппарат клетки, ферменты антиперекисной защиты и снижать интенсивность
перекисного окисления липидов, обеспечивая антиоксидантное и протекторное действие.
- На уровне возбудимых тканей (мышечная, нервная) реализован эффект
лазерного света, инициированный на клеточном уровне -
антипарабиотическое действие, в результате которого очаг альтерации выводился из экзальтационной фазы парабиоза, повышался порог возбудимости, создавалось состояние "оперативного покоя", активизировалась симпатическая регуляция, усиливались обменные процессы, проявлялся аналитический эффект.
- На организменном и системном уровнях проявлялся симпатолитический эффект: снижалась амплитуда температурной реакции, уменьшался дефицит температурной адаптации, повышался термоболевой порог; отмечалось нормализующее действие на реологические свойства крови и её антисвёртывающую систему, на капиллярный кровоток и другие компоненты системы микроциркуляции. Воздействие на иммунную систему приводило к иммуномодулирующему эффекту, снижалась боль, улучшалась функция конечности. На примере лазеротерапии хронических болевых синдромов показана возможность ликвидации гиперактивной детерминантной структуры - генератора патологически усиленного возбуждения, что вело за собой исчезновение вызванного ею синдрома.
Определение адекватных показаний к проведению лечения излучением низкоэнергетического лазера, наряду с соблюдением методики лазеротерапии, является определяющим для достижения максимального положительного результата.
Лазеротерапия может быть использована:
- как основной метод лечения;
- как фактор, повышающий эффективность других методов лечения (эффект суммирования положительного влияния);
- как фактор, повышающий резистентность на тканевом и организменном уровнях и уменьшающий риск осложнений при применении кортикостероидов или инвазивных манипуляций на опорно-двигательном аппарате (блокады, пункции суставов и костей) - протекторное действие лазеротерапии МКС.
В настоящее время для лечения ортопедо-травматологических больных в подавляющем большинстве случаев применяют низкоэнергетическое лазерное излучение в красном и ближнем инфракрасном диапазоне света: излучение гелий-неоновых лазеров (длина волны 0,63 мкм) и полупроводниковых (длина волны 0,81 мкм).
Методики лазеротерапии разделяются на методики наружного облучения, методику внутривенного облучения крови, методику внутрикостного облучения, методику внутрисуставного облучения и методики сочетанной лазеротерапии.
Наружное облучение проводится с применением лазерного света в красном или инфракрасном диапазоне в зависимости от течения заболевания. Перед сеансом лазеротерапии предполагаемые зоны облучения обезжиривают 70% раствором этилового спирта, проводят туалет раневой поверхности.
Независимо от области облучения и заболевания число сеансов лазеротерапии составляет 10М5, которые проводятся по возможности ежедневно.
Методика наружной лазеротерапии зависит от характера заболевания и определяется топографией облучаемых зон, плотностью потока мощности воздействия, экспозиционной дозой в минутах с учётом особенностей отдельных патологических процессов.
Методика сочетанной лазеротерапии применяется у больных с тяжёлыми формами поражения крупных суставов конечностей, с выраженным болевым синдромом и нарушениями функции мышц, у больных пожилого и старческого возраста, имеющих сопутствующие заболевания сердечно-сосудистой и эндокринной системы. Введение кортикостероидов и инвазивных манипуляций на суставах на фоне применения МКС лазера у больных с нарушением функции центральной и периферической гемодинамики и изменениями углеводного обмена не приводило к обострению сопутствующей патологии: гиперкоагуляции и ишемическим нарушениям. Это позволило существенно расширить показания к активной тактике лечения больных и повысить эффективность амбулаторной помощи. Длительность лечения составляет от 1,5 до 2-х месяцев. Используются плотность потока мощности 100 мВт/см , длительность сеанса 15^20 мин., число сеансов от 10 до 15 с интервалами через 1^2 дня.
Инвазивные методы лазеротерапии проводятся в условиях процедурной, манипуляционной, операционной с соблюдением всех правил асептики и антисептики. Внутривенное облучение крови желательно проводить под контролем капилляроскопии и термометрии. Положительными признаками лазеротерапии являются: снижение
температуры кожи на поражённом сегменте конечности (при достаточном магистральном кровотоке), прекращение функционирования шунтов, восстановление нормального капиллярного кровотока.
Превышение экспозиционной дозы приводит к прекращению положительной динамики микроциркуляции и резкому ухудшению капиллярного кровотока.
Методика внутривенного облучения крови заключается в проведении венепункции, проведении через просвет иглы световода (после чего пункционную иглу желательно извлечь из просвета вены) и проведении облучения крови МКС гелий-неонового лазера с мощностью лазерного света на рабочем конце световода 5М0 мВт в течение 10^15 мин. (желательно индивидуальное определение экспозиционной дозы). Сеансы облучения повторяются 2 раза в неделю общим числом 5^6.
При лечении септических состояний облучение проводится ежедневно с проведением световода через подключичный катетер.
Методика внутрикостного облучения заключается:
- в пункции кортикального слоя кости иглой Дюфо (после предварительной анестезии кожи, подкожных тканей и надкостницы);
- в формировании канала в губчатой кости спицей Киршнера через просвет иглы;
- в проведении в образованный канал световода;
- в облучении губчатого вещества кости МКС гелий-неонового лазера с мощностью на рабочем конце 5^10 мВт. в течение 10 мин. Сеансы облучения проводятся 1^2 раза в неделю общим числом 4^6.
Техника костномозговой пункции заключается в проведении анестезии мягких тканей до кости 5^15 мл 0,5% раствора новокаина, после чего игла для внутрикостной анестезии вводится или вбивается в избранное место. Места введения иглы определяются характером заболевания.
Методика внутрисуставного облучения заключается в пункции сустава тонкой иглой, через которую суставная полость заполняется кислородом. Отдельным доступом производится пункция сустава иглой с широким просветом, через который проводится световод, подключённый к лазерному аппарату. Под контролем светящегося через кожу пятна световод подводят к поражённому участку сустава (верхний заворот, в область крыловидных связок) и проводят облучение каждого отдела сустава в течение 3^5 мин. За один сеанс проводится облучение 2^5 участков. Облучение проводят МКС гелий-неонового лазера с мощностью излучения на рабочем конце световода 5^10 мВт. Процедуру повторяют через 3^4 дня. Общее число сеансов 4^6.
Методика акупунктурного облучения заключается в воздействии лазерным лучом на биологически активные точки. При этом лечебный эффект опосредуется через рефлекторные влияния на органы-мишени. Методика считается одной из перспективных.
В медицинской практике следует учитывать поверхностную плотность энергии НЭ (доза, экспозиция, количество облучения), обычно выражаемую в Дж/см . Для оценки воздействия излучения на площадь объекта используется величина, называемая поверхностной плотностью облучения ЕЭ (энергетическая освещенность, плотность мощности излучения), измеряемая в Вт/м или мВт/см . Для определения указанных параметров необходимо знать энергию (Дж) или мощность ФЭ (или поток излучения, Вт). Эти физические характеристики всегда указываются в паспортных данных каждой выпускаемой установки. Доза облучения связана с площадью облучаемой поверхности S (см ).
В большинстве опубликованных работ по медицинской лазерологии как основной параметр указывается плотность мощности излучения в мВт/см . В последние годы для характеристики дозы лазерного излучения стали чаще пользоваться энергетической экспозицией.
Диапазон стимулирующих доз лазерного низкоэнергетического излучения определён в пределах от 3 до 9 Дж/см , что подтверждено результатами комплексных морфологических исследований. Указанная вариабельность стимулирующих доз может быть объяснена не только физическими свойствами лазерного луча (длина волны, когерентность, поляризация и т.д.), но и биофизическими свойствами самого облучаемого объекта (структура тканей, химический состав, оптическая плотность и т.д.). Здесь весьма необходимо изучение оптических коэффициентов биологических тканей.
Отрабатываются и сами методики лазерной, магнитолазерной терапии. Так, в последних экспериментальных исследованиях и клинических наблюдениях было доказано, что лечебная эффективность магнитолазерной терапии значительно повышается, если во время сеанса излучение подаётся с интервалами, прерывая воздействие через каждую минуту на 2^3 с. С медико-биологической точки зрения это может быть объяснено определённым влиянием на адаптационную способность биологических тканей.
Весьма перспективными в медицине для биостимуляции оказались полупроводниковые и He-Ne лазеры.
Начало применению в медицине полупроводниковых лазеров на арсениде галлия положили комплексные разработки, проведённые в Институте медицинской промышленности (С.П. Калинин, Б.А. Разыгрин, Л.Ш. Розенблат, А.К. Полонский), когда в 1986 году была выпущена первая партия аппаратов для магнитолазерной терапии (АМЛТ). Этот аппарат с успехом был применён в комплексном лечении инфицированных ран, трофических язв, хронических заболеваний костей и суставов, а также заболеваний периферической нервной системы. В 1989 году была выпущена вторая модель АМЛТ, сконструированная с учётом медико-технических рекомендаций. В 1991 году на основе АМЛТ был создан новый магнитолазерный двухканальный аппарат "МЛАДА": длина волны излучения 0,83 мкм, суммарная мощность непрерывного лазерного излучения 30 мВт. Начат серийный выпуск этого аппарата.
Весьма эффективным оказалось использование в лечебной практике низкоэнергетического лазерного излучения в импульсном режиме. Отечественный лазерный терапевтический аппарат "Узор" .широко применяют в клинической практике. Длина волны излучения этого аппарата 0,89 мкм, частота повторения импульсов дискретная - от 80 до 300 Гц. В приборе имеется специальная насадка для проведения сеансов магнитолазерной терапии.
В хирургической практике для лазерной рефлексотерапии используют портативный полупроводниковый прибор "Колокольчик" также на арсениде галлия. Он был применён также при лечении послеоперационных нарушений функции кишечника и мочевыводящих путей. Хорошие и удовлетворительные результаты были получены у 88% больных, причём интересно, что лучшие результаты были у пациентов, не получавших наркотических средств и анальгетиков, и у некурящих.
Использование модулированного лазерного излучения полупроводниковых лазеров в терапевтических целях имеет большие перспективы и требует дальнейших экспериментально-клинических исследований.
В настоящее время серийно выпускают физиотерапевтическую установку УЛФ-01 "Ягода" на основе He-Ne лазера. Основными её узлами являются: излучатель He-Ne лазера ЛГИ-106 с оптической насадкой, закреплённый на вертикальной стойке; блок питания и блок управления. Длина волны излучения составляет 0,63 мкм, мощность излучения - не менее 12 мВт, пределы регулирования диаметра лазерного пучка на облучаемой поверхности - от 5 до 300 мм.
Плотность мощности излучения на рабочих расстояниях можно регулировать посредством изменения диаметра лазерного пучка на облучаемой поверхности от 0,1 до 800 мВт/см . Оптическая насадка служит для формирования и изменения направления лазерного излучения. На выходе манипулятора имеется трансфокатор для варьирования диаметра пятна излучения от 2 до 150 мм на расстоянии 1 м от манипулятора. Для подведения излучения к точкам объекта применяют гибкие волоконные кварцевые световоды.
Для передачи лазерного излучения используют кварцевый световод (внешний диаметр 1 мм) со светопроводящей жилой диаметром 400 мкм в полимерной оболочке. При лечении заболеваний желудка и двенадцатиперстной кишки световод вводят в инструментальный канал гастроэндоскопа для терапевтического облучения язвенных образований.
Имеющиеся теоретические посылки, а также накопленный богатый клинический опыт позволили сформулировать перечень основных последствий НИЛИ, которые и определяют показания к лазерной терапии:
- общий биостимулирующий эффект, повышение тонуса, резистентности к стрессовым воздействиям;
- усиление биоэнергетических процессов, нейтрализация катаболических сдвигов, проявлений послестрессовой анергии и т.п.;
- нормализация деятельности систем, участвующих в адаптивных процессах (нервной, иммунной, эндокринной и др.);
- улучшение процессов генерации и рецепции информации, обеспечивающей согласованное функционирование клеточных сообществ (миокарда, центров ЦНС и др.);
- устранение ишемических сдвигов и их последствий за счёт активации
общей и микроциркуляторной гемодинамики, усиления
газотранспортной функции крови, поддержки антиагрегационных механизмов, профилактики сладжа и т.д.;
- стимуляция репаративных процессов, заживления хронических язв и других проявлений нарушенной трофики;
- повышение эффективности ответа на фармакологические средства стимулирующего характера;
- прямое и опосредованное усиление действия других физических факторов, способных купировать токсикозы по принципу эфферентной терапии.
Эти и многие оставшиеся "за кадром" особенности НИЛИ делают данный лечебный приём достаточно универсальным, т.е. весьма перспективным для подавляющего большинства медицинских специальностей.
Основные показания:
- заболевания центральной нервной системы (острые и хронические нарушения мозгового кровообращения, травмы головного и спинного мозга);
- патология надсегментарного отдела вегетативной нервной системы;
- психоэмоциональные расстройства;
- токсикомании (табакокурение, алкоголизм);
- заболевания периферической нервной системы (невропатии, плексопатии, полиневропатии, вертеброгенные синдромы);
- заболевания органов дыхания (хронический бронхит, хроническая пневмония, бронхиальная астма);
- заболевания сердечно-сосудистой системы (ишемическая болезнь сердца, гипертоническая болезнь, облитерирующий эндартериит);
- заболевания желудочно-кишечного тракта (хронический гастрит с повышенной или нормальной секрецией, язвенная болезнь желудка и двенадцатиперстной кишки, хронический холецистит);
- заболевания кожи (нейродермит, псориаз, экзема);
- заболевания ЛОР-органов (хронические тонзиллит, фарингит, ларингит, отит, синусит, ринит).
Наибольший эффект от назначения лазерной терапии достигается при лечении хронических, вялотекущих заболеваний, в патогенезе которых ведущее значение принадлежит воспалению, дисфункциям иммунной системы, нейротрофическим нарушениям в тканях и органах. Нецелесообразно применение для получения симптоматических рефлекторных эффектов, а именно: купирования острейшего болевого синдрома, приступа бронхиальной астмы, вегетативно-сосудистого пароксизма и т. п.
Основные противопоказания:
- новообразования (независимо от локализации и характера);
- злокачественные заболевания крови;
- беременность;
- геморрагические синдромы;
- заболевания органов и систем в стадии декомпенсации;
- наличие или потенциальная угроза кровотечения;
- острые воспалительные (и особенно воспалительно-деструктивные процессы);
- активные формы онкологических заболеваний;
- фотодерматозы и другие виды патологических реакций на фотовоздействия;
- некоторые формы гематологических заболеваний.
Основываясь на результатах экспериментальных исследований и клинических наблюдений, можно показать, что при лазерной низкоинтенсивной терапии экспозиция одной процедуры лазерного воздействия (при использовании полупроводниковых ИК лазеров) не должна превышать 5^8 мин. при плотности мощности излучения порядка 4^5 мВт/см . Всего на курс лечения обычно требуется 10^12 сеансов. При недостаточном клиническом эффекте через 7^10 дней целесообразно провести повторный курс лазерной терапии. Это лишь общая схема проведения лазерной терапии. Естественно, она может быть изменена, что зависит от многих факторов: характера течения заболевания, локализации и стадии развития патологического процесса, индивидуальных особенностей больного и т.д. Так, например, установлено, что при хирургической патологии наиболее выраженный стимулирующий эффект отмечается с 3-го по 10-й день воздействия лазерным излучением, а затем происходит постепенное снижение эффекта лечебного воздействия.
В настоящее время наибольшее распространение получили гелий-неоновые лазеры. Однако, несмотря на их широкое применение в клинической практике, многие вопросы, связанные с их использованием, пока не до конца решены. Это касается определения наиболее эффективной в лечебном отношении экспозиции воздействия на очаг патологии с учётом используемой плотности мощности излучения. Установлено, что указанные параметры не могут быть стабильными при проведении лазерной терапии различных по этиологии и патогенезу заболеваний. Так, например, при использовании излучения гелий-неонового лазера (длина волны 0,632 мкм) в травматологии выраженный терапевтический эффект был получен при двадцатиминутной экспозиции и плотности мощности излучения 100^300 мВт/см .
Использование при лазерной терапии различных длин волн излучения повышает лечебный эффект. Так, комбинированное использование гелий-неонового, гелий-кадмиевого и ультрафиолетового лазерного излучения оказалось эффективным в комплексном лечении многих заболеваний и травм.
Применение лазерной терапии в сочетании с другими видами физиотерапевтического воздействия также повышает эффективность лечения. Так, например, совместное использование ультразвуковой и лазерной терапии оказалось весьма перспективным при лечении гнойных ран.
В эксперименте и клинике изучен положительный эффект воздействия постоянного и переменного магнитного поля на ферментативную активность и регенеративные процессы в ране. Достоверно установлено, что под воздействием магнитных полей в живых тканях происходит определенная переориентация электростатических зарядов в молекулах и средах, способствующая изменению течения биохимических реакций и активности ферментативных систем. Всё это послужило основанием для изучения совместного воздействия на патологический очаг низкоинтенсивным лазерным излучением и постоянным магнитным полем (магнитолазерная терапия). В экспериментах и клинике было доказано, что
противовоспалительное действие низкоинтенсивного лазерного излучения и постоянного магнитного поля более выражено, чем при раздельном или последовательном применении указанных физических факторов. При этом оказалось возможным и целесообразным уменьшить экспозицию воздействия на патологический очаг по сравнению с продолжительностью воздействия при использовании только одного лазерного излучения.
Довольно распространённой является магнитолазерная терапия. На патологический очаг (рана, трофическая язва, область перелома кости, воспалительный инфильтрат и т.п.) накладывают кольцевые ферритовые магниты (напряжённость магнитного поля порядка 30^45 мТ, но не более 100 мТ) и одновременно проводят облучение низкоинтенсивным лазерным излучением при плотности мощности излучения от 4,5^5 до 20^30 мВт/см , что зависит от степени выраженности и характера течения патологического процесса. Экспозиция воздействия указанных физических факторов 3^5 мин. Курс лечения обычно состоит из 8^10 процедур (но не более 12). При недостаточной клинической эффективности первого курса магнитолазерной терапии через 7^10 дней следует провести повторный курс лечения. Пользуясь указанной методикой, удаётся добиться положительных результатов при лечении долго незаживающих трофических язв и инфицированных ран даже в тех случаях, когда одна лазерная терапия оказывается малоэффективной.
В настоящее время большое распространение приобрели функциональные нарушения желудочно-кишечного тракта, а именно: синдром раздражённой толстой кишки, гастроэзофагеальный рефлюкс, дуоденогастральный рефлюкс, которые приводят к воспалительным изменениям слизистой пищевода, желудка, толстой кишки и могут ста
Источник: А.В. Беликов, А.В. Скрипник, «ЛАЗЕРНЫЕ БИОМЕДИЦИНСКИЕ ТЕХНОЛОГИИ (часть 1). Учебное пособие» 2008