Сердечно-сосудистые заболевания распространены чрезвычайно широко и являются одной из основных причин смертности. Основной патологией является атеросклероз - хроническое заболевание, состоящее в изменении интимы артерий, обусловленном отложением в ней липидов, формированием липидных бляшек, развитием соединительной ткани, что приводит к уплотнению, неравномерному сужению просвета сосудов и нарушению кровотока. В результате ухудшения кровоснабжения в органах развиваются дистрофические и склеротические процессы.
Типы и размеры кровеносных сосудов человека в различных отделах системы кровообращения весьма разнообразны. Различают артерии и вены.
Артерии по внутреннему диаметру подразделяются на три группы: крупные с внутренним диаметром 8^26 мм и толщиной стенки 0,4^2,5 мм, средние с внутренним диаметров 4-^8 мм и толщиной стенки 0,28^0,45 мм и мелкие с внутренним диаметром 1,5^4 мм и толщиной стенки 0,15^0,35 мм.
По распределению в средней оболочке артерии эластических волокон и гладкомышечных клеток артерии подразделяются на три типа: эластические со значительным развитием эластических окончатых мембран и эластических волокон в средней оболочке; мышечно-эластические, содержащие в средней оболочке примерно равные количества гладкомышечных клеток и эластических волокон; мышечного типа, в средней оболочке которых преобладают гладкомышечные клетки.
К артериям эластического типа относятся аорта и легочная артерия, в которых гемодинамические условия характеризуются высоким давлением крови (120^130 мм рт. ст.) и большой скоростью кровотока (около 0,5 м/с), что требует от сосуда значительной упругости и эластичности. К артериям мышечно-эластического типа относятся такие артерии, как сонная и подключичная. К артериям мышечного типа относится большинство внутриорганных артерий, бедренная артерия и другие. Общие закономерности строения стенки вен, как и артерий, связаны с гемодинамическими условиями. Низкое давление, которое в дистальных отделах не превышает 10 мм рт. ст., а на уровне сердца 3^6 мм рт. ст., незначительная скорость кровотока (0,01^0,03 м/с) определяют слабое развитие эластических волокон в стенках вен.
Развитие гладких мышечных клеток в стенке вен зависит от направления кровотока к сердцу под действием сил гидростатического давления крови или силы тяжести крови. Необходимость преодоления сил гидростатического давления крови проявляется в развитии мышечных слоёв в венах, расположенных ниже уровня сердца. Но, как и в артериях, мышечный слой в венах имеет назначение поддерживать необходимое внутрисосудистое кровяное давление. Важным фактором, определяющим структурное отличие стенки вены, является то обстоятельство, что вены лишены активной гемодинамической функции, заключающейся в кумуляции энергии сердечного толчка, чему служат мощные стенки артерии.
Строение стенок кровеносных сосудов зависит от гемодинамических условий (кровяного давления, скорости кровотока) и выполняемой данным сосудом функции. Стенка артерии (см. рис. 5-2-1) состоит из трёх оболочек: внутренней (tunica intima), средней (tunica media) и наружной (tunica externa).
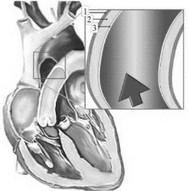
Рис. 5-2-1. Строение артерии (1 - tunica externa, 2 - tunica media, 3 - tunica intima).
В состав внутренней оболочки артерии входят три слоя: эндотелий с базальной мембраной, подэндотелий и внутренняя эластическая мембрана. Эндотелиальный слой образован эндотелиальными клетками,
препятствующими тромбообразованию. Средняя оболочка артерии состоит из нескольких слоёв гладких мышечных клеток, расположенных концентрически. В средней оболочке артерии содержится наибольшее количество эластических и коллагеновых волокон. Наружная оболочка состоит из наружной эластической мембраны и рыхлой волокнистой соединительной ткани. В ней содержатся снабжающие стенку артерии кровеносные сосуды (артерии и вены) и нервы.
Стенки артерий и вен примерно на 70% состоят из воды, которая не является упругим материалом и проявляет упругие свойства только при всестороннем сжатии. Упругие свойства стенок сосуда как целого определяются волокнами трёх типов: эластическими, коллагеновыми и гладкомышечными.
Эластин является резиноподобным материалом, модуль Юнга которого равен примерно 3x10 Н/м . Коллаген гораздо более жёсткий, чем эластин, его модуль Юнга равен 10 Н/м . Предел прочности при растяжении эластина составляет менее 5% от аналогичного показателя коллагена. Считают, что резкое увеличение жёсткости стенок кровеносного сосуда при растяжении связано с различием в организации
входящих в их состав волокон коллагена и эластина. При малых деформациях большая часть волокон коллагена расслаблена и не вытянута по прямой; всё напряжение при этом создаётся волокнами эластина. С увеличением деформации волокна коллагена выпрямляются и всё в большей мере участвуют в создании напряжения. Так как они гораздо более жёсткие, чем волокна эластина, то и вся стенка становится более жёсткой. Поведение кровеносного сосуда как целого определяется на только упругими свойствами его составляющих, но и геометрическими параметрами. Наиболее важными величинами является внутренний диаметр сосуда d и толщина стенки 8. Основные механические свойства артерии представлены в таблице 5-2-1.
Таблица 5-2-1. Механические свойства стенки бедренной артерии.
|
Тип артерии |
Удлинение |
Предел прочности, МПа |
Модуль упругости, МПа при сг=0,5 МПа |
|||
|
Без поражения |
1,57 |
1,44 |
1,3 |
1,04 |
1,1 |
1,42 |
|
Поражённая (1 и 2 стадии) |
1,45 |
1,41 |
1,05 |
0,95 |
1,3 |
1,47 |
|
Поражённая (3 и 4 стадии) |
1,42 |
1,33 |
0,83 |
0,73 |
1,39 |
1,78 |
Существуют несколько теорий атерогенеза - возникновения атеросклероза. В первых научных работах атерогенез рассматривался как результат нарушения обмена холестерина. Предполагалось, что увеличение поступления холестерина с пищей приводит к его накоплению в тканях сосудистой стенки и развитию атеросклеротических изменений. И в самом деле, диета с повышенным содержанием холестерина вызывала у экспериментальных животных развитие атеросклероза. Поэтому
гиперхолестеринемия, то есть повышенное содержание холестерина в крови, стала считаться одним из факторов риска развития атеросклероза у человека. Но уже в 20^30-е годы учёным стало ясно, что это не совсем так. Оказалось, что за атерогенез ответственен не вообще холестерин, а только холестерин крови. Более того - во многих случаях атеросклероз может развиваться без гиперхолестеринемии, и, наоборот, гиперхолестеринемия может не вызывать атеросклероза. Поэтому объяснить развитие атеросклеротических изменений только лишь нарушением холестеринового обмена нельзя.
В 40^50-е годы учёные обратили внимание на молекулы - переносчики холестерина. Холестерин, как и большинство других липидов, нерастворим в плазме крови. Поэтому в организме липиды переносятся белково-липидными комплексами - липопротеинами (липидная теория).
Липопротеины (ЛП) - это мельчайшие жиросодержащие частички типа шариков, заключённых в оболочку. Снаружи оболочка по своей природе гидрофильна, то есть легко смачивается водой. В неё встроены белковые молекулы, называемые апобелками. Внутренняя же сторона оболочки, наоборот, гидрофобна, то есть не смачивается водой. Она окружает липидную (жироподобную) часть липопротеина, в которую включаются переносимые липиды и в их числе холестерин. Постепенно в науке сформировалось представление о том, что нарушение метаболизма переносчиков холестерина липопротеинов - повышение их содержания в плазме крови - вызывает развитие атеросклероза. Однако оказалось, что, хотя высокая концентрация ЛП и может привести к атеросклерозу, прямой связи между степенью атеросклероза и содержанием ЛП в крови всё же нет.
В 60-е годы было обнаружено, что ЛП неоднородны по плотности, видам апобелков, липидному составу, а также и по влиянию на развитие атеросклеротических изменений в кровеносных сосудах. В наибольшей степени атерогенны ЛП низкой (ЛПНП) и очень низкой плотности. ЛП высокой плотности, напротив, предотвращают атеросклероз, что подтвердили не только эксперименты на животных, но и многочисленные клинические данные. Это звучит убедительно, поскольку ЛП низкой и очень низкой плотности переносят липиды в периферические ткани - при их избыточном содержании в плазме крови вероятность развития атеросклероза резко увеличивается.
Наоборот, ЛП высокой плотности (ЛПВП) переносят липиды из тканей в печень, тем самым, препятствуя атерогенезу. Казалось бы, причина развития атеросклероза наконец-то найдена. Несмотря на это, в современной науке появились и другие, не менее обоснованные теории атерогенеза.
Ещё на заре изучения причин развития атеросклероза, в начале ХХ века, обнаружили, что повреждение стенки кровеносного сосуда является одной из наиболее вероятных предпосылок для образования атеросклеротической бляшки. А ведь стенка сосуда может стать мишенью воздействия микроорганизмов (паразитарная концепция). Поэтому легко предположить, что одним из следствий тяжёлых инфекций, сопровождающихся попаданием микробов в кровь, будет атеросклероз. Но оказалось, что микроорганизмы могут вызывать образование отложений на стенках сосудов и без других симптомов инфекционного заболевания.
В 1978 году группа американских учёных обнаружила, что индуцировать образование атеросклеротических бляшек у экспериментальных животных можно, заразив их цитомегаловирусом. Причём содержание холестерина в крови (а экспериментальные животные были разделены на несколько групп, получавших с пищей разное количество холестерина) в этом случае не влияет на тяжесть атеросклероза. Аналогичные результаты были получены и для других вирусов. Но настоящий переворот в представлениях об атерогенезе произвело обнаружение в атеросклеротических бляшках возбудителей бактериальной пневмонии - Chlamydia pneumoniae. Автором этого открытия можно считать доктора из университета штата Юта в США Джозефа Мухлештейна, опубликовавшего результаты своих сенсационных исследований в журнале Американского колледжа кардиологии. Он обнаружил в коронарных артериях у 80% больных атеросклерозом хламидии. В то же время у здоровых людей хламидии в сосудах встречаются только в 4% случаев. Эта работа стала началом паразитарной теории атерогенеза. Результаты доктора Мухлештейна были подтверждены целым рядом исследователей. Следовательно, оптимальным лекарством против атеросклероза могут стать простые антибиотики, а не лекарства, снижающие уровень холестирина в крови.
Но паразитарная и липидная концепции возникновения и развития атеросклероза охватывают далеко не все современные теории атерогенеза. Среди наиболее важных теорий можно упомянуть нервно-метаболическую, рассматривающую атеросклероз как следствие нарушения нервно-эндокринного контроля состояния кровеносных сосудов. Её разновидностью является эмоционально-стрессовая, по которой причина таких нарушений заключается в стрессовых воздействиях. С обеими вышеуказанными теориями связана так называемая простациклиновая гипотеза, предполагающая, что
атеросклероз развивается вследствие нарушения механизма синтеза простагландина I2 (простациклина), обеспечивающего расширение кровеносных сосудов и снижение проницаемости клеток, выстилающих их внутреннюю стенку. Существует также так называемая тромбогенная теория. Она рассматривает в качестве причины атерогенеза локальное нарушение свертываемости крови, вызывающее местный тромбоз с последующим формированием атеросклеротической бляшки. С ней связана теория "response-to-injury" ("ответ на повреждение"), созданная в 1970-х годах. Согласно этой теории, атеросклероз возникает вследствие локальных повреждений клеток внутренней поверхности сосуда, причина которых неизвестна. К повреждённой сосудистой стенке начинают прилипать тромбоциты. Это, в свою очередь, может вызывать местный тромбоз. Кроме того, при формировании тромба тромбоциты выбрасывают в плазму крови вещества, вызывающие развитие всего комплекса изменений стенки сосуда, характерных для атеросклероза.
Можно также упомянуть и теорию, которая рассматривает атеросклероз как следствие старческого изменения артериальной стенки (геронтологическая теория). Итак, теорий атерогенеза - множество (!). В подобных случаях в медицинской литературе такое заболевание называют полиэтиологическим. Это означает, что его возникновение зависит от множества различных факторов.
После возникновения стадии формирования атеросклеротической бляшки достаточно хорошо изучены. Причиной формирования бляшки является воспаление в интиме, которое вызывает местную реакцию с
проникновением в интиму гладкомышечных клеток из медии, с лейкоцитарной инфильтрацией, захватом ЛПНП клетками соединительной ткани с последующим их разрушением и выбросом ферментов, которые "подтачивают" эндотелий изнутри, со стороны интимы. Разрастающиеся гладкомышечные клетки, клетки соединительной ткани, сами липиды (образуется (+) ткань) отдавливают эндотелий в просвет сосуда, так как наружная стенка артерии значительно крепче внутренней. Поначалу образуется "бугорок", который через некоторое время приобретает вид атеросклеротической бляшки. Эндотелий на бляшке называют "кепкой", а зону по периметру "кепки" - "воротником" (см. рис. 5-2-2).
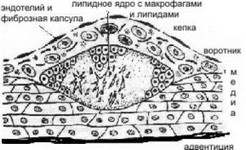
Рис. 5-2-2. Атеросклеротическая бляшка. "Мягкая" атеросклеротическая бляшка здесь ещё в начале процесса дестабилизации. Фиброзная капсула не воспалена и не подточена ферментами.
Поначалу сосуд-мишень с бляшкой ничем себя не проявляет до того времени, пока бляшка не перекроет примерно 75% просвета сосуда. Затем появляется симптоматика со стороны органа или тканей, которые питаются данным больным сосудом.
Со временем "кепка" начинает разрушаться. Наступает момент, когда появляется дефект в эндотелии - обнажаются подэндотелиальные структуры. Разрыв в "кепке" (диссекция) мгновенно закрывается тромбоцитами, начинается цепная реакция образования агрегата клеток.
Параллельно этому запускается каскад свёртывания крови и тромбоциты "армируются" фибрином - образуется тромб (рис. 5-2-3).

Рис. 5-2-3. Варианты образования тромба при диссекции (разрыве) атеросклеротической бляшки.
Возможны варианты расположения тромба, а именно: он может перекрыть просвет сосуда; может расположиться внутри дефекта, в самой бляшке; может частично выступать в просвет сосуда и ещё более перекрывать кровоток. На ранних стадиях образования сгустка-тромба он рыхлый и струёй крови его части могут отрываться и "путешествовать" к отдалённым участкам сосуда, блокируя более узкие места. Мигрирующий сгусток называется тромбэмбол.
Если описанный процесс с перекрытием кровотока происходит в сосудах сердца - развиваются инфаркт миокарда; если в сосудах питающих головной мозг - инсульт; в сосудах нижних конечностей приведёт к гангрене конечности; в сосудах кишечника - к некрозу кишечника и перитониту. Закупорка центральной артерии сетчатки приведёт к слепоте и т. д.
Места образования бляшек, обычно у устьев или в местах деления артерий, т.е. там, где силы гемодинамики наиболее значительны, и есть феномен завихрения крови. При патологоанатомических вскрытиях, почти всегда обнаруживаются бляшки у бифуркции аорты, затем (по частоте) идут сосуды сердца и головного мозга. По мере жизни человека стабильные бляшки прорастают соединительной тканью и пропитываются кальцием, что вызывает уплотнению артерий. А это ведёт к повышению верхнего (систолического) давления.
Методы диагностики атеросклероза подразделяют на неинвазивные (доплеровское УЗИ, томография (компьютерная, магнитно-резонансная, которая позволяет визуализировать сосуды)) и инвазивные (модификации ангиографии).
В современном мире существует достаточно много методов борьбы с атеросклерозом: медикаментозный (нитраты, В-блокаторы, верапамил, дилтиазем, станины, никотиновая кислота, фибраты, аспирин и т.д.), диета, хирургический (аортокоронарное шунтирование, лазерная перфорация, транслюминальная ангиопластика со стентированием).
Аортокоронарное шунтирование предполагает применение аппарата искусственного кровообращения, т.е. остановку сердца на время операции. Как видно из названия, аорта соединяется с коронарными артериями, в обход суженных участков, шунтами, для которых используются периферические вены или артерии того же больного.
Транслюминальная (чрескожная) ангиопластика со стентированием - операция без разреза. Пунктируется крупная артерия и по просвету аорты к сердцу проводятся специальные направляющие и баллонные катетеры. Катетер с баллончиком устанавливается в суженном месте. Затем баллончик раздувается высоким давлением (12 атм.) до заранее рассчитанного размера. Атеросклеротическая бляшка раздавливается, затем в это место устанавливается стент - проволочная пружинка-каркас. Стент удерживает сосуд в расширенном состоянии. Для разрушения атеросклеротической бляшки возможно использование лазерного излучения - лазерная ангиопластика. Обратим внимание на оптические свойства сосудов.
Как видно из зависимости, представленной на рис. 5-2-4, спектры поглощения слоёв аорты изучены в основном в диапазоне от 200^1400 нм.
В диапазоне 400^600 нм поглощение обусловлено наличием в стенках сосудов гемоглобина. В диапазоне между длинами волн 600^1300 нм коэффициент поглощения сосудов близок к 0,1 см-1. Самым оптическим плотным слоем аорты является адвенция, затем интима и менее плотным слоем - медиа (см. таблицу 5-2-2). Для tunica intima характерны пики поглощения на длинах волн: 413 нм, 542 нм и 580 нм. В свою очередь для tunica media это 407 нм, 538 нм и 579 нм, а для tunica externa - 411 нм, 540 нм, 577 нм и 698 нм.
Коэффициент поглощения света тканями сосуда возрастает в диапазоне от 800 нм и далее. Это обусловлено тем, что в этой области поглощение обусловлено водой, из которой на 70^80% состоят ткани сосуда.
В диапазоне 200^600 нм (см. рис. 5-2-5.) спектральная зависимость нормального сосуда и сосуда с патологией (атеросклеротическая бляшка) различаются. Основные пики поглощения наблюдаются на двух длинах волн 224 и 280 нм. Для кривой, которая соответствует нормальной стенке аорты, коэффициент поглощения понижается после достижения второго максимума, который соответствует длине волны 280 нм. Кривая, которая соответствует атеросклеротической аорте, коэффициент поглощения уменьшается быстрее, но формирует максимум на той же длине волны. Возрастание и уменьшение кривых поглощений почти идентичны. Следовательно, коэффициент поглощения у сосуда с патологией ниже, чем у сосуда без патологии. Эта зависимость объясняется тем, что структура сосуда с патологией более плотная, нежели у здорового сосуда.
Более плотная структура объясняется в первую очередь строением бляшки, а именно тем, что в её состав включены комплексы липопротеинов, связанных гладкомышечными клетками. Заметим, что основные пики поглощения самой атеросклеротической бляшки близка спектрам поглощения липопротеинов.
Хирургическое восстановление или реконструкция суженных или полностью блокированных артерий (реже вен) в теле человека называется ангиопластикой (angioplasty). При чрескожной внутрипросветной ангиопластике (percutaneous transluminal angioplasty РТА balloon angioplasty) надутый баллончик, закреплённый на конце гибкого катетера, вводится в просвет поражённой артерии под рентгенологическим контролем (см. рис. 5-2-6.).
Так как баллон не является плоским, просвет между стенками артерии увеличивается, разрывая её внутреннюю оболочку (тем самым уменьшается вероятность повторного стеноза этой артерии). Чаще всего чрескожная внутрипросветная ангиопластика выполняется на коронарных, подвздошных, бедренных и подколенных артериях.
Таблица 5-2-2. Поглощение света структурами сосуда.
|
Оболочка аорты |
Длина волны, нм |
Коэффициент поглощения, см-1 |
|
tunica intima |
476 |
14,8 |
|
580 |
8,9 |
|
|
600 |
4,0 |
|
|
633 |
3,6 |
|
|
1064 |
2,3 |
|
|
tunica media |
476 |
7,3 |
|
580 |
4,8 |
|
|
600 |
2,5 |
|
|
633 |
2,3 |
|
|
1064 |
1,0 |
|
|
tunica externa |
476 |
18,1 |
|
580 |
11,3 |
|
|
600 |
6,1 |
|
|
633 |
5,8 |
|
|
1064 |
2,0 |
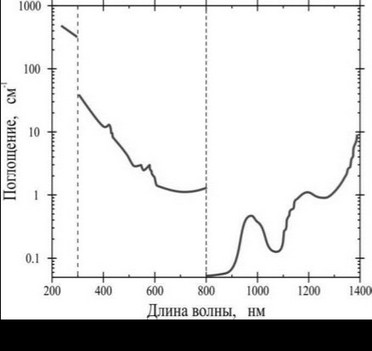
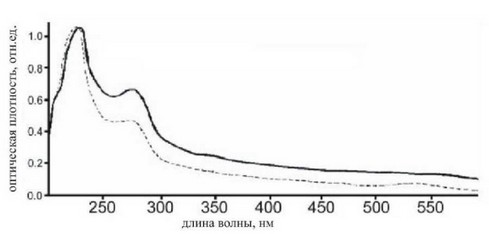
Рис.5-2-5. Спектры поглощения сосуда без патологии и с патологией (атеросклеротическая бляшка) в диапазоне длин волн 200-600нм. Сосуд без патологии (линия сплошная), с патологией (пунктирная).
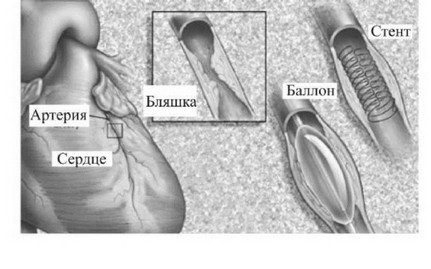
Рис. 5-2-6. Стент и баллонная ангиопластика.
Лазерная ангиопластика разрабатывалась в начале 1980-х годов как самостоятельная технология (как альтернатива баллонной ангиопластике, шунтированию, механической хирургии и т.д.). В настоящее время лазерная ангиопластика редко используется самостоятельно. Как правило, она применяется в сочетании с баллонной. В том случае, если бляшки полностью заблокировали артерию, лазерное излучение используется для разрушения бляшки до размеров, при которых становится возможным применение баллонной ангиопластики.
Для успешного проведения лазерной ангиопластики необходимо правильно выбрать длину волны и мощность лазера. Лазер должен удалять бляшки, не повреждая клетки крови или ткани сосудов. Существуют три различных метода лазерной ангиопластики: термический,
фототермический и абляция.
При термической лазерной ангиопластике излучение аргонового или неодимового лазера используется для нагревания биосовместимого металлического наконечника, присоединённого к оптоволоконному волновому проводнику. Температура металлического наконечника достигает +400°С. Хирург направляет зонд через препятствие (бляшку), создавая в нём маленькое отверстие для тока крови. Этот метод используется достаточно редко, так как может вызвать термическое разрушение окружающих бляшку здоровых тканей, например, карбонизацию и некроз стенок сосуда.
Фототермический метод предполагает непосредственный нагрев бляшки излучением неодимового лазера. Этот метод более продуктивен и безопасен, чем термический метод, но тем не менее всё ещё может повредить стенки сосудов.
Абляция предполагает использование эксимерного, гольмиевого или эрбиевого лазера. К числу наиболее распространённых следует отнести XeCl лазер с длиной волны 308 нм.
В работах Мельченко С.В. и др. ("Квантовая электроника", 24, № 10, 1997) и Oraevsky A.A. и др. ("Lasers in surgery and Medicine" 12, 585, 1990.) проводятся подробные морфологические исследования кратеров,
образованных в аорте in vitro с атеросклеротическим повреждением второй стадии лазерным излучением различного спектрального состава и различной интенсивностью (см. таблицу 5-2-3).
Видно, что при использовании первой гармоники YAG: Nd лазера величина глубины кратера достаточно велика при относительно невысокой удельной энергии испарения. Это связано, с одной стороны, с большой прозрачностью ткани в области длины волны 1,064 мкм, а с другой, - с высокой интенсивностью падающего излучения. Этот режим испарения можно охарактеризовать как режим теплового взрыва с быстрым выносом вещества из зоны лазерного воздействия.
Достаточно большую глубину проникновения имеет и лазерное излучение с длиной волны 0,532 мкм (YAG: Nd (2w)). Однако интенсивность света, которая достигается на облучаемой поверхности ткани, в 2,5 раза меньше, чем в режиме облучения первой гармоникой, поэтому кратер остаётся достаточно большим, но удельная энергия испарения значительно выше, чем в случае YAG: Nd лазера.
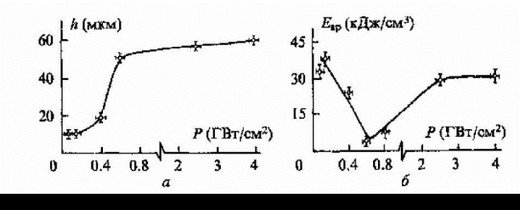
Очень разные результаты получаются при использовании XeCl лазера. Скорость роста кратеров и удельная энергия испарения в этих экспериментах сильно зависят от энергии лазерного излучения, диаметра лазерного пятна и длительности лазерного импульса. Нетрудно заметить, что все три указанных выше параметра могут быть сведены к одному - к интенсивности лазерного излучения. На рис. 5-2-7а представлена зависимость глубины кратера от интенсивности падающего излучения, а на рис. 5-2-7б - соответствующая зависимость удельной энергии испарения. Отметим, что максимальная глубина формируемого за один импульс XeCl лазера отверстия при интенсивности порядка 800 МВт/см и выше близка к 60 мкм.
Видно, что ткань испаряется тем легче, чем больше интенсивность лазерного луча на поверхности или, другими словами, чем больше энергия лазерного излучения, чем меньше длительность импульса и чем меньше диаметр пятна фокусировки. Однако при интенсивности порядка 600 МВт/см картина изменяется: глубина кратера практически перестаёт увеличиваться, а удельная энергия испарения начинает заметно возрастать. Одновременно регистрируется свечение на облучаемой поверхности. Это свечение может быть плазмой, экранирующей лазерный пучок от облучаемой поверхности.
Таким образом, с точки зрения скорости роста кратера и удельной энергии испарения ткани (эти два параметра характеризуют эффективность лазерного воздействия на ткань) ключевыми параметрами являются длина волны и интенсивность лазерного излучения. Если первый параметр естественным образом связан с оптическими характеристиками облучаемого вещества, то влияние второго параметра менее очевидно. Этот эффект следует рассматривать с точки зрения механизмов превращения поглощённой энергии света в веществе. Сразу следует заметить, что вода в исследуемой спектральной области поглощает слабо, поэтому основная доля поглощённой энергии приходится на липидно-белковые комплексы, которые накапливаются в бляшке. Релаксационные процессы, происходящие после поглощения лазерной энергии указанными комплексами, могут приводить либо к быстрому разогреву ткани и её взрывному испарению (термический механизм воздействия лазера), либо к фотодиссоционной модификации молекулярной структуры с изменением термодинамических свойств вещества. Следует также подчеркнуть, что в большинстве экспериментов удельная энергия испарения ткани была значительно выше, чем удельная энергия испарения воды (2,7 кДж/см3).
| Лазер | X„ мкм | Ер, мДж | t, нс | 0, мм | Е
кДж/см3 |
h, мкм |
| YAG: Nd | 1,064 | 120 | 10 | 0,3±0,1 | 20,4±1,3 | 54±3 |
| YAG: Nd (2w) | 0,532 | 50 | 10 | 0,3±0,1 | 47±5 | 34±3 |
| 60 | 60 | 1±0,1 | 38±5 | 12±2 | ||
| 150 | 60 | 1±0,1 | 24±4 | 20±2 | ||
| 250 | 60 | 1±0,1 | 12±3 | 48±5 | ||
|
XeCl |
0,308 |
30 | 60 | 0,5±0,1 | 4±1 | 52±4 |
| 150 | 60 | 0,5±0,1 | 32±3 | 60±3 | ||
| 300 | 60 | 0,5±0,1 | 33±4 | 65±4 | ||
| 70 | 200 | 1±0,1 | 26±3 | 14±2 | ||
| 150 | 200 | 1±0,1 | 28±2 | 14±2 | ||
| 0,308 | ||||||
| XeCl + ВКР | 0,353 | 60 | 60 | 1±0,1 | 20±4 | 22±2 |
| 0,414 |
Таблица 5-2-3. Удельная энергия испарения ткани Esp и глубина кратера h при различных параметрах лазерного излучения.
импульс XeCl лазера (а) и удельной энергии испарения ткани (б) от интенсивности лазерного излучения на поверхности.
Лишь при облучении УФ светом удаётся найти режим, при котором удельная энергия испарения ткани близка к указанному выше значению (4 кДж/см ). Логично предположить, что именно в этом режиме максимальная доля поглощённой лазерной энергии трансформируется по фотодиссоционному каналу.
Эксперименты с излучением свободной генерации YAG: Nd лазера с длиной волны 1,44 мкм показали, что при плотности мощности этого излучения 0,8 МВт/см скорость формирования отверстия в стенке патологически изменённой аорты человека in vitro составляет величину порядка 200 мкм/имп., что в свою очередь намного выше, чем показатели XeCl на длине волны 308 нм (мощность импульса в 800 МВт/см и скорость 60 мкм/имп.).
Рассмотрим более детально ход операции при лазерной ангиопластике. В ходе процедуры по артериям проводится лазерный катетер до места сужения соответствующего коронарного сосуда. Затем по инструментальному каналу продвигается зонд, который осторожно проталкивается через сужение в сосуде. Вслед за этим по зонду со скоростью 0,5^1 мм/с начинают продвигать катетер, по которому с экспозициями по 3^5 с подают лазерную энергию, необходимую для разрушения атеросклеротической бляшки, сужающей просвет сосуда.
Катетер могут продвигать непрерывно или импульсно. В последнем случае после каждых 10^12 импульсов его отводят назад. Подобная тактика (pulse and retreat) обеспечивает систематическое восстановление кровотока в ходе процедуры и способствует меньшему повреждению ткани миокарда по сравнению с операцией-прототипом, в ходе которой ткань подвергается непрерывной гипоксии в течение всего периода лазерной реканализации сосуда.
Затем лазерный катетер с зондом извлекают и на его место устанавливают баллонный катетер, с помощью которого сформированный лазерным излучением просвет в сосуде ещё более расширяют, а поверхность его разрыхлённой предыдущим инструментом стенки при этом уплотняется.
При использовании эксимерного лазерного излучения оптимальными для разрушения бляшки параметрами следует считать следующие: плотность энергии 30^100 Дж/см , длительность импульса 100^200 нс, частота следования лазерных импульсов 20^100 Гц. При использовании гольмиевого лазера (Л =2,12 мкм): плотность энергии 500^1000 Дж/см , длительность импульса 200^300 мкс, частота следования лазерных импульсов 5^10 Гц.
Достаточно перспективным является здесь излучение эрбиевого лазера (Л =2,94 мкм), которое способно более эффективно чем излучение эксимерного или гольмиевого лазеров разрушать ткани аорты, но при этом ударные волны, сопровождающие этот процесс, менее разрушительны.
Однако прогресс в области использования излучения эрбиевого лазера сдерживается отсутствием надёжных оптических волокон для его транспортировки.
Клинический успех операции лазерной ангиоплатики довольно высок, что однако не исключает осложнений. К ранним
послеоперационным осложнениям относятся перфорация сосуда с тампонадой сердца, резкое перекрытие просвета артерии (окклюзия) из-за его закупорки отслоившейся в ходе операции повреждённой катетерами тканью, спазм сосуда или инфаркт участка миокарда, питаемого данной артерией.
При перфорации обычно необходима срочная открытая операция на сердце. Окклюзия и вызванный ею инфаркт могут быть преодолены повторной лазерной процедурой, в любом случае необходима адекватная интенсивная терапия с помощью сильно и быстро действующих препаратов. Наиболее частым и вместе с тем труднопреодолимым осложнением лазерной ангиопластики считается повторный стеноз (рестеноз) коронарной артерии, который часто даёт и клинические проявления. Этот дефект не является следствием именно лазерного воздействия, так как при баллонной ангиопластике эти показатели могут быть даже выше из-за менее эффективного расширения сосуда в ходе операции. Причинами рестеноза являются образование тромба на обработанной поверхности сосуда, а также пролиферация элементов и утолщение интимы и мышечной оболочки артерии. Противодействие прогрессированию стеноза следует начинать уже в момент операции, делая всё возможное для минимальной травматизации ткани (многожильные катетеры, в том числе и с эксцентрически излучающим торцом, минимально возможная подача энергии на объект, исключение чрезмерного по объёму повреждения путём оперативного спектроскопического контроля состава облучаемой ткани, освещение места операции низкоинтенсивным когерентным или некогерентным излучениями в видимой области спектра и т.д.).
Перспективными, хотя ещё и далёкими от клинического воплощения, следует считать положительные результаты экспериментов с введением сразу же после процедуры ангиопластики гепарина (антикоагулянта) с его фиксацией к поверхности сосуда излучением неодимового лазера, что препятствовало бы формированию тромба по месту операции, "посев" с этой же целью по месту вмешательства культивированных эндотелиальных клеток, а также облучение места операции когерентным (He-Ne лазер, Л =632 нм) или некогерентным (ксеноновая лампа, Лмакс. =594 нм) светом, что подавляло бы пролиферацию гладкомышечных клеток. Показано, что в случае рестеноза процедура лазерной ангиопластики может быть с успехом повторена.
Следует отметить, что хотя для ангиопластики коронарных сосудов чаще применяют импульсные лазеры - эксимерный и гольмиевый - всё
ещё не оставлены попытки использовать с этой целью и непрерывно излучающие лазеры, причём в виде контактных, а не только дистанционных (баллонных) инструментов. В частности, было
экспериментально установлено, что воздействие излучения непрерывного YAG: Nd лазера с Л.=1,44 мкм (это излучение примерно в 35 раз сильнее поглощается в воде по сравнению с традиционной для YAG: Nd лазера Л=1,064 мкм) на ткани артерии, достоверно реже вызывает расслоение стенки артерии, её разрыв и интраоперационное тромбирование, а также в меньшей степени провоцирует развитие рестеноза.
Лазерную ангиопластику можно проводить не только для профилактики инфаркта миокарда, но и непосредственно после того, как он был диагностирован. Для этого больному в срочном порядке сначала вводят одножильный световод, торец которого нацеливают на тромб, а затем последний разрушают излучением импульсного лазера на красителе (Л =480 нм). После этого световод извлекают, заменяют лазерным многожильным катетером, а далее проводят стандартную процедуру с использованием эксимерного лазера.
Лазерную ангиопластику выполняют также при окклюзии или стенозе артерий нижних конечностей. При этом длин
