- Эндотоксикоз, достигающий максимальной напряженности при АС с ПОН, неизменно оказывает вторичное, агрессивное воздействие на организм больного одним, а чаще группами гуморальных факторов. При этом в данном организме они становятся причиной острого повреждения органов и тканей и развития связанных с ним функциональных расстройств. Эти факторы представляют как обычные, физиологически образованные вещества и молекулярные комплексы, так и необычные, патологически образованные вещества и молекулярные комплексы. Однако даже в случае образования физиологических субстанций при возникновении интоксикации правильнее говорить о нецелесообразном для данного организма метаболизме. Вредоносное действие таких субстанций формирует специфический синдром, который может быть назван эндогенной интоксикацией (ЭИ), по аналогии с вредоносным действием на организм ксенобиотиков или экзогенной интоксикацией. Сами факторы развития этого синдрома могут определяться как
эндогенные токсичные субстанции (ЭТС). Синдром ЭИ есть 7 проявление нарушения системных связей в организме больного или, иными словами, проявление нарушений процессов информационного обмена в организме больного (A.J1. Костюченко,
К.Я. Гуревич, Н.А. Беляков, 2002).
Острое действие ЭТС, как и последующее действие токсикантов-ксенобиотиков, при остром отравлении реализуется в специфический ответ организма больного на первичное и вторичные повреждающие действия ЭТС. Этот ответ может быть определен как острый эндотоксикоз, при котором диапазон продукции ЭТС будет расширяться, а эндогенная интоксикация будет терять свою специфичность. Считают, что существенный прогресс в лечении перитонита на современном этапе может быть достигнут на путях решения проблемы ликвидации эндогенной интоксикации и связанных с нею осложнений. Этот, как многим кажется, основной практический вывод связан с необходимостью совершенствования лечебного воздействия на главные патологические звенья тяжелых форм распространенного перитонита — эндотоксикоз и эндотоксемию. Увеличению токсичности крови больных с перитонитом предшествует нарастание токсичных веществ перитонеального содержимого и степени пареза кишечника. Известно, что используемые показатели эндотоксикоза представляют собой далеко не в полной мере токсичные компоненты, циркулирующие в крови, но они являются своеобразным триггером, запускающим механизмы аутодеструкции в различных органах, а связанные с ними нарушения общего гомеостаза могут становиться самостоятельными и прогрессировать. Из приведенных суждений следует естественный вывод о том, что наиболее эффективными мерами профилактики структурных повреждений различных органов и систем, ведущих к полиорганной недостаточности, может быть, с одной стороны, рациональное выведение токсичных продук-
7 тов из организма и подавление их образования в очаге поражения, с другой — применение средств, нейтрализующих токсичные вещества, циркулирующие в крови.
Основными источниками интоксикации являются воспаленная брюшина и кишечник, находящийся в состоянии глубокого пареза. Гнойно-воспалительный процесс, вегетирование микробов в брюшной полости сопровождаются накоплением токсичных продуктов, что вызывает нарушение микроциркуляции в полых органах желудочно-кишечного тракта, увеличивает проницаемость стенки кишки. Это в свою очередь способствует накоплению микробов и токсинов в свободной брюшной полости, откуда они поступают в лимфатическую, а затем и в кровеносную систему. Если учесть, что даже самая тщательная одномоментная санация брюшной полости при перитоните не позволяет сразу прервать его течение, то надо признать, что продолжающееся поступление токсинов из кишечника в брюшную полость, а также вегетация микробов в брюшной полости усугубляют токсемию и могут привести к развитию полиорганной недостаточности. Разрешение кризиса полиорганной недостаточности при перитоните, вызванном интоксикацией, должно заключаться не только в интенсификации реанимационно-де- токсикационных мероприятий, но и в пересмотре непосредственных воздействий на первичный очаг — воспаленную брюшину, являющуюся не только пусковым механизмом, но и катализатором развития эндотоксикоза. Решение этой задачи связано с созданием условий для непосредственного и максимального отведения токсинов из брюшной полости. Синдром эндогенной интоксикации у больных с перитонитом связан с активацией протеолиза в перитонеальном экссудате и накоплением токсичных веществ в сыворотке крови. Проводимая борьба с интоксикацией на этапах ее формирования с использованием лапаростомы (экстракорпоральная детоксикация) и местной
нейтрализации токсичных веществ в брюшной полости, а также 7
борьба с эндотоксемией позволяют избежать развития полиорганной недостаточности, улучшить результаты лечения перитонита. Проявления эндотоксикоза определяются органными и системными реакциями в организме больного с синдромом ЭИ. Органные реакции характеризуются теми или иными нарушениями функций органов жизнеобеспечения (легких, сердца, печени, почек, кишечника), тогда как системные ответы связаны с существенными нарушениями реологических свойств циркулирующей крови, ее коагуляционного потенциала либо персистирую- шим иммунным ответом организма на появление во внутренней среде чужеродных веществ, причем не обязательно адекватным.
В ходе развития острого эндотоксикоза даже при интенсивном поступлении ЭТС из источника или очага ЭИ быстро устанавливается относительное равновесие между циркулирующей кровью и тканевой жидкостью. Это равновесие определяется протеканием двух антагонистических процессов: ретенцией токсичных субстанций тканями и выведением их из организма с участием так называемой биотрансформации. В тех случаях, когда продукция ЭТС протрагируется или нарастает, накопление их в тканях происходит быстрее, чем биотрансформация и выведение. Это усиливает процессы продукции ЭТС, и эндотоксикоз переходит в стадию аутоагоессии.
В конечном счете, дальнейший ход развития эндотоксикоза зависит не только от сохранения или развития процессов, ведущих к накоплению факторов агрессии, представленных первичными и вторичными ЭТС, но и от эффективности детоксицирующих механизмов, играющих защитно-компенсаторную роль.
В целом эти механизмы образуют специфическую функциональную систему, которая может быть определена как функциональная система детоксикации (ФУС) и принципиальная конструкция которой представлена на рисунке 7.3.
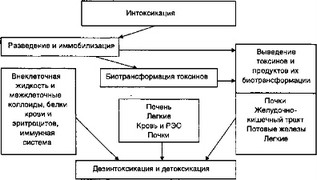
Рис. 7.3. Схема функциональной системы детоксикации
- Функциональная система детоксикации обеспечивает, прежде всего, биотрансформацию токсинов и токсичных субстанций. Как в отношении многих ЭТС, так и в отношении ксенобиотиков биотрансформация протекает в основном в печени, а также в легких и кишечнике. Благодаря биотранс- формационным механизмам, которые в большой мере реализует микросомальная система печени, основная часть продуктов обмена и ЭТС, резервированных из очагов ЭИ, превращается в менее токсичные, водорастворимые соединения. Они легче вступают в последующие реакции биотрансформации и именно в таком трансформированном виде больше всего экскретируются из организма.
Метаболизация многих субстанций, ставших токсичными в связи с изменением их количества во внутренней среде организма, включает в себя две фазы. В первой фазе происходят реакции микросомального окисления или гидролиза этих соединений.
Во второй фазе вещества с активными группами (-ОН, -NH2, 7
-SH, -СООН) вступают в реакции конъюгации (например, с глицином, глютатионом) или синтеза с образованием эфиров (спирты, альдегиды, фенолы), метилированием и ацетилирова- нием. Здесь уместно вспомнить об оксигеназных реакциях, которые происходят на уровне макрофагов при их контакте с бактериями и иммунными комплексами, что ведет к адсорбции многих ЭТС на поверхности макрофагов и полиморфноядерных лейкоцитов, но это уже ближе к другим защитным механизмам.
Начальная часть ФУС детоксикации представлена механизмами разведения и иммобилизации токсичных субстанций. Эти механизмы имеют разноуровневый характер. Наиболее древним механизмом, обеспечивающим разведение и уменьшение токсического воздействия ЭТС, является стрессорный ответ на агрессию с задержкой натрия и воды и расширением внеклеточного жидкостного пространства. Инфузионная поддержка (внутривенная, подкожная или интестинальная) широко используется в клинической практике и нередко составляет основу начальной дезинтоксикации.
Действие этого механизма подкреплено буферными системами крови и тканей, позволяющими связывать избыток ионов водорода и нелетучих органических кислот, которые могут представлять в определенном смысле ЭТС и, при достаточной емкости, ограничивающими действие такой гомеостатической составляющей эндотоксикоза, как метаболический ацидоз.
В связи с этим дефицит буферных оснований становится неблагоприятным фоном токсического действия продуктов обмена и тканевого распада.
В реализации механизмов иммобилизации токсичных субстанций существенную роль играют также процессы неспецифической сорбции, имеющие практически физический характер. Высокой сорбционной активностью обладают многие компо-
7 ненты тканевых структур, как клеточные (эритроциты, клетки ретикулоэндотелиальной системы (РЭС), эпителий ЖКТ), так и внеклеточные (мукополисахариды, коллаген, эластин и другие коллоиды).
Механизмы иммобилизации обязательно реализуются связыванием ЭТС с белковыми субстратами тканевой жидкости и крови. Среди них существенное место занимает альбумин с его свободными активными центрами, которые в значительной степени обеспечивают такую иммобилизацию.
В сочетании с неизбежной задержкой воды во внеклеточном пространстве и набуханием клеточных коллоидов сорбционные свойства этих образований играют роль первой линии защиты при прогрессировании ЭИ.
Физико-химическая иммобилизация лежит в основе регулирующих биоусгойчивость функций иммунной системы:
о взаимодействие «антиген — антитело» с образованием иммунных комплексов, которые могут быть циркулирующими или преципитированными в микроциркуляторном русле в местах органного поражения;
о последующая санация микроциркуляции и циркулирующей крови микрофагами — активированными лимфоцитами;
офагоцитоз крупномолекулярных ЭТС подвижными макрофагами и нейтрофилами;
° накопление патологических субстанций резидентными макрофагами печени и селезенки типа клеток Купфера.
Важнейшее звено иммунной защиты — взаимодействие антигена с антителом — является по своей сути адсорбционным процессом, основанным на образовании иммунного комплекса «антиген + антитело + комплемент». Во многих случаях такие комплексы утрачивают способность адсорбироваться на поверхности и проникать внутрь чувствительных к данному антигену клеток. Они задерживаются в зонах фагоцитоза, где захваты-
ваются активными клетками и подвергаются перевариванию 7 с помощью лизосомальных ферментов.
Свободнорадикальное окисление (СРО) липидов играет существенную роль в регуляции мембранной проницаемости и в транспорте веществ через мембраны клеток, в переносе электронов в цепи дыхательных ферментов, в синтезе простаг- ландинов и лейкотриенов, в метаболизме катехоламинов и стероидных гормонов, определяет скорость клеточного деления и дифференцировку клеток. Значительное возрастание интенсивности и избыточность ПОЛ с накоплением его первичных и вторичных продуктов приводит к широкому повреждению клеток (главным образом, липидов мембран) и тканей организма.
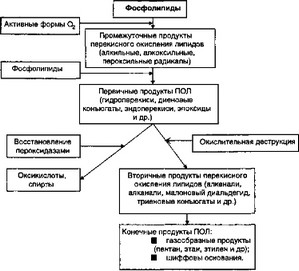
7 Одновременно с образованием продуктов ПОЛ вдет их распад
(окислительная деструкция, восстановление, потребление), причем большая часть продуктов ПОЛ (липидные радикалы, гидроперекиси) — вещества очень нестойкие, хотя и агрессивные. Условно их можно разделить на промежуточные продукты радикальной природы, первичные, вторичные и конечные продукты ПОЛ. В целом процесс их генерации представлен на рисунке 7.4.
Наконец, третий компонент ФУС детоксикации организма — экскреторные механизмы детоксикации. Их действие реализуется за счет функционирования почек, желудочно-кишечного тракта, потовых и сальных желез, легких. В целом в самом общем приближении структурная и функциональная организация экскреторных органов построена по общему типу. Рабочая часть этих органов — мембраны и физико-химические механизмы переноса веществ через них — во многом сходны, несмотря на различные функциональные задачи. Все мембраны составлены тремя основными слоями и имеют, как правило, эндотелиальный (со стороны кровеносной системы) и эпителиальный (со стороны просвета или выводного протока органа) слои, фиксированные на плотно соприкасающихся, а иногда и сливающихся базальных мембранах, которые представляют интерс- тиций функциональных единиц этих органов. Транспорт газов, воды, ионов и других веществ через эти мембраны идет как путем фильтрации по градиенту гидростатического давления, так и путем молекулярной или ионной диффузии по градиенту концентрации или заряда таких веществ. При этом изменение структурной организации экскреторного органа, наполнение воздухоносных пространств легких жидкостью изменяет условия и характер такого транспорта. В значительной части эти процессы происходят без затрат энергии клеточной структуры.
Вторая часть функциональной единицы экскреторного органа обеспечивает обратное всасывание биологически нужных ве-
ществ (канальцевый аппарат почек, выводные канальцы пото- 7 вых желез и др.). В этой зоне органа, наряду с диффузией, существуют сложные механизмы трансмембранного переноса с помощью дегидратирующих ионофоров и мембранных насосов.
Дня таких механизмов характерны высокие затраты энергии, например, реабсорбция натрия в почечных канальцах требует основной части кислорода, потребляемого почками.
Другие механизмы элиминации, в частности секреция, дополняют эти два принципиально-действующих противоположно процесса, которые обеспечивают экскреторную регуляцию гомеостаза в зависимости от ситуации, возникающей в организме, например, секреция ионов Н+ и реабсорбция ионов гидрокарбоната.
Наконец, все органы экскреции при необходимости могут дополнять или частично компенсировать друг друга, составляя единую функциональную систему детоксикаиии, в которой экскреция тесно связана с механизмами биотрансформации факторов ЭИ и сорбции ЭТС. Так, легкие выступают не только как орган удаления из организма избытка С02, но и других летучих веществ. Эта особенность легких проявляется запахами, специфичность которых в конкретных случаях ЭИ (например, foetur hepati- cus) нередко четко улавливается опытными клиницистами.
Хотя основная роль потовых желез у человека заключается в обеспечении терморегуляции, при некоторых заболеваниях и возрастании потоотделения (до 1—2 л/суг) с потом могут выводиться значительные количества мочевины и креатинина (при почечной недостаточности), глюкоза и кетоновые тела (при несостоятельности инсулярного аппарата и декомпенсации сахарного диабета), аммиак и желчные кислоты (при печеночной недостаточности).
Желудочно-кишечный тракт как орган экскреции играет роль одного из наиболее важных путей компенсации расстройств в ФУС детоксикации. Через кишечник проходит 15-
7 19 л ультрафильтрата плазмы крови, который экскретируется
с кишечными соками и всасывается в толстой кишке. Он имеет исключительное значение в выведении из организма липидов и, в частности, холестерина, конечных продуктов обмена гемоглобина (билирубин и другие железосодержащие соединения), в регуляции водно-элекгролитного обмена. По сути дела, это единственный механизм регуляции липидного и, особенно, холестеринового гомеостаза в организме. Только 3% холестерина превращается в стероидные гормоны, которые затем метаболи- зируюгся печенью и выводятся почками. При патологических состояниях, например, при почечной несостоятельности или блокаде этого пути детоксикации, с калом могут удаляться большие количества мочевины, креатинина, мочевой кислоты, фенолов и других продуктов обмена, которые стали ЭТС.
Главным органом экскреции ЭТС являются почки, обладающие, кроме того, метаболическими и эндокринными функциями, которые играют основную роль в поддержании водно- элекгролитного и кислотно-основного равновесия в организме. Почками выводятся не только конечные продукты азотистого обмена, электролиты, аммоний, но и соединения, не метаболи- зированные в организме больного. Почками же выводятся и продукты, образующиеся из комплексов «антиген — антитело», переваренные фагоцитами останки микроорганизмов (бактерий, вирусов, простейших). В обычных условиях поступления таких ЭТС скорость их выведения предотвращает субклиничес- кие проявления ЭИ. Очень важно, что при умеренном нарастании катаболизма, если функция почек сохранена, этот механизм существенно уменьшает клиническую и лабораторную выраженность интоксикации. Этот же механизм объясняет действие низкомолекулярных коллоидных кровезаменителей на основе поливинилпирролидона (гемодез) и поливинилового спирта (полидез), образующих с высокотоксичными вещества-
ми, циркулирующими в крови, неактивные комплексы, кото- 7 рые выводятся почками. Почки участвуют в выделении из организма и компонентов инфекционной ЭИ (A.J1. Костюченко).
В пользу признания исключительной роли этого органа в детоксикации свидетельствуют данные, полученные еще в 1956 г.
Е.В. Викториной, которая установила, что почки занимают одно из первых мест в организме человека по содержанию бактериальных эндотоксинов по сравнению с другими паренхиматоз-
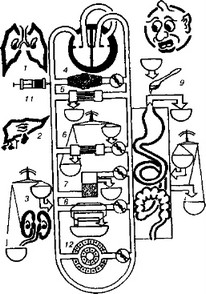
Рис. 7.5. Методы детоксикации
(по А.П Зильберу): стимуляция естественной детоксикации (1, 2, 3,), гемосорбция (4), самотечная гемофильтрация (5), принудительная гемофильтрация с замещением объема (6), плазмаферез (7), гемодиализ (8), энтеросорбция (9), перитонеальный диализ (10), антидотная терапия (11), искусственные органы (12).
7 ными органами при возникновении синдрома ЭИ инфекционного происхождения. Неповрежденные почки играют существенную роль в выделении из организма вирусов, хотя другие микроорганизмы, вегетирующие вне этого органа (бактерии, риккетсии), как правило, с мочой не выводятся. Характерно, что многие эндотоксины бактерий обезвреживаются и самой мочой, а потому могут быть обнаружены в моче только при усилении мочеотделения.
- Методы детоксикации представлены на рисунке 7.5.
Детоксикационная инфузия вливанием гемодилютантов или кровезаменителей детоксикационного действия в системный кровоток считается одним из наиболее простых лечебных воздействий в плане активной детоксикации. Уже простое увеличение плазменного объема крови и расширение внеклеточного жидкостного пространства в целом уменьшают внеклеточную и внутрисосудистую концентрацию эндогенных токсичных субстанций (ЭТС), способствуют снижению выраженности эндогенной интоксикации (ЭИ) и сдерживают прогрессирование эндотоксикоза. Особенно отчетливо это проявляется на фоне гиповолемии и дегидратации.
Детоксикация достигается благодаря уменьшению внеклеточной и внутрисосудистой концентрации ЭТС, что способствует их переходу в мобильную внеклеточную жидкость с поверхности клеточных мембран и из основного вещества тканей, а также из клеточного жидкостного пространства. Значение имеет не только простое разведение ЭТС, но и улучшение системного и периферического кровообращения, дезагрегация клеток крови, что оказывает нормализующее действие на метаболические процессы на клеточном уровне, в том числе и на процессы биотрансформации ЭТС.
Форсированный диурез (ФД) представляют собой систему инфузионных, медикаментозных и корригирующих внутрен-
нюю среду больного воздействий, направленных на поддержа- 7 ние высокого темпа диуреза в течение нескольких десятков часов или суток. В клинической практике форсированным считают мочеотделение более 2 мл/кг массы тела больного в час, т.е. примерно в 2 раза и более выше обычного темпа. Предполагается, что в процессе ФД усиливается выведение не только воды, но и всех осмотически активных веществ, которые являются компонентами внутренней среды организма.
Необходимым условием форсирования диуреза считается отсутствие глубоких некробиотических изменений в фильтрационной мембране и канальцевом эпителии почек, а также сохранение адекватной (гипердинамической) реакции сердечно-со- судистой системы на избыточную водную нагрузку, острую ги- перволемию и гемодилюцию. Этим ФД отличается от стимуляции диуреза, используемой в олигоанурической стадии ОПН, когда большими дозами салуретиков практически «выключают» канальцевую реабсорбцию без изменения клубочковой фильтрации и предварительной гидратации больного.
Выделяют два варианта ФД: инфузионно-форсированный и медикаментозно-форсированный диурез. В первом варианте мочеотделение форсируется интенсивной водной нагрузкой — влиянием изоосмотических или слабо гилеросмотических инфузи- онных сред, а при втором варианте одновременно с нагрузкой применяют лекарственные средства, быстро усиливающие недостаточное диуретическое действие инфузионной терапии. Предпочитают использовать препараты, уменьшающие реабсорбцию за счет изменения осморегуляции этого процесса (маннитол, сор- битол, трисаминол) либо за счет избирательного и обратимого подавления активности транспорта ионов натрия через стенку почечного канальца на уровне петли нефрона (петли 1енле).
Энтеросорбиия (ЭС) — метод активной детоксикации, основанный на связывании эндогенных веществ и субстанций, над-
7 молекулярных структур и клеток в просвете желудочно-кишеч- ного тракта и выведении их из него с лечебной или профилактической целью. Основу данного метода детоксикации составляет применение энтеросорбентов — лечебных препаратов различной структуры, осуществляющих связывание токсичных веществ и субстанций в желудочно-кишечном тракте путем адсорбции, ионообмена и комплексообразования.
Лечебное действие ЭС определяется сочетанием её прямых и опосредованных эффектов (табл. 7.8).
| Прямые эффекты | Опосредованные эффекты |
| Сорбция экзогенных токсинов, выделяемых в химус с желчью, секретом слизистых оболочек, поджелудочной железы | Снижение метаболической нагрузки на функциональную систему детоксикации |
| Сорбция эндогенных продуктов секреции и гидролиза | Коррекция обменных процессов и иммунного статуса. Улучшение состава внутренней среды |
| Сорбция биологически активных веществ — нейтропептидов, прос- тагландинов, гистамина, серотонина, аутоаллергенов и др. | Устранение дисбаланса биологически активных веществ |
| Сорбция бактериальных токсинов, факторов патогенности бактерий и микробных тел из кишечного содержимого | Восстановление проницаемости слизистой оболочки кишки для представителей микробиоты, их токсинов и продуктов обмена |
| Связывание кишечных газов | Устранение метеоризма, улучшение кровоснабжения кишечной стенки |
| Раздражение рецепторных зон в желудочно-кишечном тракте | Стимуляция кишечной моторики |
Таблица 7.8
Медикаментозное повышение эффективности биотоанс- формаиии менее разработано. Так, активный натрий гипохлорит, после периода ажиотажа применения, стал использоваться
ограничено: объем внутривенно вводимого натрия гипохлорита 7 не более 1/10 ОКЦ при оптимальной концентрации активного вещества 600 мг/л. Эффекты такого воздействия связывают в настоящее время в меньшей степени с гидрофилизацией ЭТС, а больше с разрушением таких комплексов, как глюкозирован- ный гемоглобин или «открытие» активных центров циркулирующего альбумина. Поддержание биотрансформации ЭТС может обеспечиваться за счет усиления транспорта кислорода в организме, особенно в тех органах, которые определяют патогенез ЭИ. Использование искусственных и естественных антиоксидантов как лекарственных средств является еще одним направлением повышения защитных механизмов в условиях различных вариантов эндотоксикоза с абсолютным или относительным повышением уровня ПОЛ.
По данным, представленным В. В. Гацурой и Л.Д. Смирновым (1992), по механизму действия антиоксиданты могут быть классифицированы следующим образом:
- Средства, тормозящие развитие ПОЛ.
- Ингибиторы фосфолипаз и стабилизаторы полиненасы- щенных жирных кислот в отношении фосфолипазы А2.
- Стабилизаторы эндогенной ферментной антиокисли- тельной системы (супероксидцисмутаза, церулоплазмин, глюгатионпероксидаза, каталаза).
- Ингибиторы ксантиноксидазы (аллопуринол и др.), ингибиторы миелопероксвдазы, циклооксигеназ, липоок- сигеназ и другие активаторов ПОЛ.
- Средства, взаимодействующие с активными формами кислорода, гидролипоперекисями и другими первичными формами ПОЛ, так называемые ловушки-тушители, scavengers:
о убихиноны (коэнзим Q);
о фенольные соединения (олифен);
о флавоноиды (пикногенол);
7 0 а-токоферсш, ионол-дибунол, пробукол и другие соединения;
о серосодержащие соединения (унитиол, ацетилцистеин и до.);
о соли селена.
- Донаторы протонов, потенцирующие эффект фенольных и серосодержащих антиоксиданотов (аскорбат, цитрат).
- Средства, содержащие катализ продуктов ПОЛ двухвалентными ионами металлов — железа, меди и др. (дефероксамин, церулоплазмин, гистидинсодержащие дипептиды — карнозин, ансерин; ЭДТА, цианиды).
- Структурные антиоксиданты, влияющие на стационарность обмена фосфолипидов в мембранных структурах (ГКС, этимизол, тирилазад, растительные мембраносгабилизаторы).
В комплексных программах нередко и оправдано используют сочетание тушителей с препаратами-реактиваторами первичных антиоксидантов — донаторами SH-rpynn (N-ацетилцисгеин, унигиол, цисгеин, тиосульфат натрия). Они являются не только донаторами сульфгидрильных групп, а потому защищают активные центры некоторых ферментов, но и стабилизируют энергетический обмен. Эти и другие, более экзотические серосодержащие препараты, такие как сульфаденозинметионин и сульфаденозинцистеин, в то же время считаются антиокислителями, разрушающими перекиси.
Появление эффективных пищевых добавок, содержащих высокоактивные антиоксиданты, такие как коэнзим Q или пикно- генол, позволяет продолжить терапию на этапе выхода из окси- дантного стресса или опираться на них в условиях умеренной выраженности ПОЛ.
Необходимо представлять, что афферентные детоксикаци- онные воздействия в значительной степени должны являться базисными для активной экстракорпоральной детоксикации, разработка и внедрение которой в практику лечения острых эндотоксикозов является одним из актуальных направлений клинической медицины.
- Деблокирование микроциркуляции занимает ос- 7 новное место в комплексной терапии эндотоксикоза. Тотальный характер нарушений микроциркуляции, скорее всего, вызывают комплексы взаимодействия ЛПС с комплементом, которые приводят к массовому повреждению клеток эндотелия сосудов, возникновению ДВС-синдрома, блокаде микроциркуляции с последующим СПОН и летальным исходом (А. П. Есь- ков, Р. И. Каюмов, А.Е. Соколов, 2003). В зависимости от особенностей клинического течения АС и перитонита, изменений показателей системы гемокоагуляции и фибринолиза, криоп- лазменно-антиферментный комплекс с целью деблокирования микроциркуляции применяют в трех вариантах (Е.А. Цейман):
- й вариант. Умеренные дозы свежезамороженной плазмы (300- 450 мл) и/или криосупернатантной плазмы (300—450 мл) и большие дозы гепарина (2500 ЕД гепарина на каждые 100 мл СЗП, вводится во флакон с плазмой, и по 5000 ЕД 4 раза подкожно).
Показания:
о Диффузный перитонит с ограничением процесса, серозногнойный или гнойный экссудат в брюшной полости, без бурных клинических проявлений;
о Гиперкоагуляция;
о Незначительное снижение AT-III (75—85%) и индекса резерва плазминогена (75—90%);
о Незначительная тромбинемия (ортофенантролиновый тест до 13,5г/л х 10 2);
о Незначительное повышение ПДФ и РФМК.
- й вариант. Большие дозы свежезамороженной плазмы (600—800 мл в сутки внутривенно капельно в 1—2 приема), малые или средние дозы гепарина (2500 ЕД гепарина на каждые 100 мл СЗП, вводится во флакон с плазмой и по 2500 ЕД 4 раза в сутки подкожно), средние дозы ингибиторов протеаз (контри- кал по 80000 АТЕ 3 раза в/в капельно в первые сутки и по
7 40000—50000 АТЕ Зраза в сутки внутривенно капельное последующие
3—5 дней, гордокс по 300000 ЕД через 12 часов в/в капельно в первые сутки и по 150000 ЕД 2 раза в/в капельно в последующие 3—5 дней). Показания:
о Разлитой перитонит с поражением нескольких этажей брюшной полости, гнойный или гнилостный экссудат в брюшной полости, выраженная клиническая картина; о Выраженное снижение AT-III (65—75%) и снижение активности плазминогена (ИРП 65—75%); о Ослабление ХНа-зависимого фибринолиза; о Умеренная тромбинемия (ОФТ 13,5—18,5 г/л 10~2); о Умеренное повышение ПДФ и РФМК.
- й вариант. Большие дозы свежезамороженной плазмы (600-800 мл) с малыми дозами гепарина (2500 ЕД на каждые 100 мл плазмы, вводится непосредственно во флакон с плазмой под контролем за показателями гемостаза) и большими дозами ингибиторов протеаз (контрикал по 100000 АТЕ 3 раза в день в/в капельно в первые сутки и по 80000 АТЕ 3 раза в/в в последующие 3—5 дней, гордокс по 500000 ЕД 2 раза в первые сутки внутривенно капельно и по 300000 ЕД каждые 12 часов в последующие 3—5 дней).
Показания:
о Общий перитонит с поражением всей брюшины, гнилостный или гнилостно-геморрагический экссудат в брюшной полости, бурное прогрессирование клинической картины; о Гипокоагуляция, геморрагии; о Гиперфибринолиз; о Гипофибриногенемия;
о Резкий дефицит AT-III (ниже 65%) и плазминогена (ИРП ниже 65%);
о Выраженная тромбинемия (ОФТ выше 18,5 г/л 10'2); о Значительное повышение ПДФ и РФМК.
Наряду с общепринятыми методами введения лекарствен- 7 ных средств при АС широко распространена эндолимфатичес- кая терапия. Резорбция микроорганизмов из брюшной полости при перитоните осуществляется преимущественно через лимфатическую систему, которая может стать очагом «дремлющей» инфекции и источником генерализации заболевания. Необходимо создание в лимфатической системе терапевтической концентрации препаратов, обеспечивающих санацию брюшной полости. Существующие способы прямой эндолимфатической терапии (антеградный и ретроградный) требуют выполнения оперативного вмешательства, что является существенным недостатком метода. Более перспективна непрямая эндолимфатичес- кая терапия, или регионарная лимфотропная терапия — введение препаратов через катетер, установленный во время операции в связки печени, желудка, брыжейку кишки (С.В. Петров).
Метод эндолимфатической терапии с лимфостимуляцией (ЭЛТ ЛС) основан на эвдолимфатическом введении стимуляторов моторики лимфангиона — тиротропин-рилизинг-гормона (ТРГ) и на увеличении объема эндолимфатических инфузий. Экспериментально доказано, что лекарственные препараты при их эвдолимфатическом введении оказывают влияние на сократительную функцию лимфангиона — основной фактор, обеспечивающий центростремительное движение лимфы. Все антибиотики в высоких концентрациях, особенно аминогликозиды, ее угнетают, а стимулирующее влияние на сократительную функцию лимфатических сосудов наиболее выражено у ТРГ.
Для увеличения объема и скорости лимфотока С.В. Петров с сотрудниками использовали: 1) разделение суточной дозы антибиотика при эвдолимфатическом введении на 2 с интервалом в 12 ч; 2) дополнительное введение эндолимфатически стимулятора моторики лимфатических сосудов ТРГ (12.5 мкг в 20 мл раствора); 3) применение в качестве растворителя только 0,9%
- раствора натрия хлорида, минимально угнетающего сократительную функцию лимфатических сосудов; 4) увеличение общего объема инфузии до 250-400 мл/сут.
Применение эндолимфатической терапии с лимфостимуля- цией положительно влияет на течение послеоперационного периода у больных перитонитом.
Высокая эффективность и явные преимущества эндолимфа- тических методов терапии при лечении перитонита обусловлены их воздействием на все звенья патогенетической цепи возникновения и развития СЭИ: на источник эндогенной интоксикации — брюшную полость, очаг деструкции, брюшину, кишечник; на токсины, циркулирующие в организме: а) всасывающиеся в лимфу через лимфатические капилляры и проходящие через лимфоузлы (биофильтры лимфатической системы); б) всасывающиеся в кровь через кровеносные капилляры и через систему воротной вены, поступающие в печень и легкие - барьерные органы кровеносной системы. Кроме того, эти методы нейтрализуют воздействие циркулирующих токсинов на органы и системы гомеостаза организма: а) повреждающее действие на функциональные клетки паренхиматозных органов и нервно- мышечный аппарат ЖКТ; б) возникновение диссеминированного микротромбоза с блоком МГЛЦ, развитие гипоксии, ацидоза и альтерации тканей; воздействуют на накопление токсинов в соединительной ткани с блоком процессов тканевого дыхания и обмена.
Таким образом, лимфологические методы терапии создают условия для одномоментной санации лимфатического и кровеносного русла, интерстициального пространства, самого очага воспаления, т. е. способствуют тотальной детоксикации организма с практически полной ликвидацией синдрома эндогенной интоксикации уже на 5—7-е сутки после операции и начала лечения.
Одним из высокоэффективных способов экстракорпораль- 7 ной детоксикации является плазмаферез. При обменном плаз- маферезе, кроме удаления из крови токсичных метаболитов, антител, вазоактивных веществ, иммунных комплексов, микробов и продуктов их деградации, уже в процессе проведения процедуры осуществляется коррекция белкового и электролитного состава крови, а также иммунных нарушений, постоянно сопутствующих тяжелой эндогенной интоксикации.
Принципы подбора индивидуальных программ состоят в следующем (В. М. Буянов):
- Предперфузионная подготовка, направленная на «разблокирование» сосудов микроциркуляторного русла путем улучшения реологических свойств крови и уменьшения спазма приводящих артериол, усиления лимфатического дренажа тканей и вывода токсинов из межклеточного пространства. С помощью инфузий восполняют дефицит объема циркулирующей крови (ОЦК) и добиваются гемодилюции, поддерживая гематокрит на уровне 0,30. Улучшение реологических свойств крови способствует улучшению фармакокинетики и фармакодинамики используемых антибактериальных и других лекарственных средств. Восстанавливая микроциркуляцию, уменьшают тканевую гипоксию, способствуют выводу токсичных продуктов обмена в активный кровоток для последующего их удаления методами эфферентной терапии.
- Объем эксфузий. Объем крови при однократной эксфузии рассчитывают с учетом выраженности степени эндотоксикоза и полиорганной недостаточности. Выполняют 2—3 забора крови с последующим удалением около 30% объем
