Общий артериальный ствол — ВПС, при котором один крупный сосуд отходит от основания сердца через единый полулунный клапан и обеспечивает коронарное, легочное и системное кровообращение [Bankl Н., 1980]. Другие названия: общий ствол, общий аортопульмональный ствол, персистирующий артериальный ствол (persistent truncus arteriosus). Первое описание порока принадлежит A. Buchanan (1864). Этот порок составляет 3,9 % всех ВПС по результатам патологоанатомических исследований [McNamara J. J., Gross R. Е., 1969] и 0,8—
Анатомия, классификация. Анатомическими критериями общего артериального ствола являются: отхождение от основания сердца одного сосуда, обеспечивающего системное, коронарное и легочное кровоснабжение; легочные артерии отходят от восходящей части ствола; имеется единое клапанное кольцо ствола. Термин «псевдотрункус» относится к аномалиям, при которых легочная артерия или аорта атрезированы и представлены фиброзными пучками. R. W. Collett и J. Е. Edwards (1949) выделяют 4 типа общего артериального ствола (рис. 65): I —единый ствол легочной артерии и восходящая аорта отходят от общего ствола, правая и левая легочные артерии — от короткого легочного ствола; II — левая и правая легочные артерии расположены рядом и отходят каждая от задней стенки трункуса;
При I типе общего артериального ствола длина общего ствола легочной артерии составляет 0,4—2 см, возможны аномалии развития легочной артерии: отсутствие правой или левой ветви, стеноз устья общего ствола. При II варианте размеры легочных артерий равны и составляют 2—8 мм, иногда одно меньше другого Клапан общего артериального ствола может быть одно- (4 %), двух- (32 %), трех- (49 %) и четырехстворчатым (15 %). F. Butto и соавт. (1986) впервые описали клапан с одной комиссурой при общем артериальном стволе, который, как и при стенозе аорты, создает схенотический гемодинамический эффект. Створки могут быть нормальными, утолщенными (22%) (по краю видны мелкие узелки, миксоматозные изменения), дисплас- тичными (50 %). Такое строение створок предрасполагает к клапанной недостаточности. С возрастом деформация створок увеличивается, у детей старшего возраста возможно развитие каль-
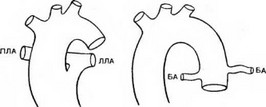
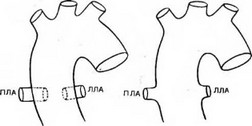
Рис. 65. Варианты общего артериального ствола (схема).
циноза. Створки клапана общего ствола фиброзно связаны с митральным клапаном, поэтому считается, что он в основном аортальный.
Место расположения трункуса над желудочками имеет значение при отборе больных на радикальную коррекцию порока. В наблюдениях F. Butto и соавт (1986) в 42 % он располагался в равной мере над обоими желудочками, в 42 % — преимущественно над правым ив 16 % — преимущественно над левым желудочком. В этих случаях выходом из желудочка, не соединяющегося со стволом, служит ДМЖП. По другим наблюдениям, отхождение трункуса от правого желудочка встречается в 80 % случаев, при этом закрытие ДМЖП во время операции приводит к субаортальной обструкции.
ДМЖП всегда имеется при общем артериальном стволе, он не имеет верхнего края, лежит непосредственно под клапанами и сливается с устьем ствола, инфундибулярная перегородка отсутствует.
Этот порок часто сочетается с аномалиями дуги аорты: перерыв, атрезия, праворасположенная дуга, сосудистое кольцо, коарктация.
Другими сопутствующими ВПС бывают открытый общий ат
риовентрикулярный канал, единственный желудочек, единая легочная артерия, аномальный дренаж легочных вен. Из экстра- кардиальных пороков встречаются аномалии желудочно-кишечного тракта, урогенитальные и скелетные аномалии.
Гемодинамика. Кровь из правого и левого желудочков попадает в единый сосуд через ДМЖП; давление в обоих желудочках, трункусе и ветвях легочной артерии равное, что объясняет раннее развитие легочной гипертензии; исключение составляют случаи со стенозом устья легочной артерии и ее ветвей или малым их диаметром. Правый желудочек при общем артериальном стволе преодолевает системное сопротивление, что вызывает гипертрофию его миокарда, дилатацию полости. Гемодинамичес- кие особенности порока определяются во многом состоянием кровообращения в малом круге. Можно выделить следующие варианты.
Сердечная недостаточность носит бивентрикулярный характер; выраженная недостаточность левого желудочка объясняется большим возвратом крови в его полость и нередко имеющимся препятствием к выбросу при преимущественном отхождении общего ствола от правого желудочка. При развитии высокой легочной гипертензии, ее склеротической фазы, состояние больных улучшается, уменьшаются размеры сердца и проявления сердечной недостаточности, но увеличивается выраженность цианоза. Учитывая анатомическое строение створок клапана ствола, возможно развитие их недостаточности и/или стеноза.
Клиника, диагностика. По клиническим проявлениям дети с этим пороком напоминают больных с большим ДМЖП. Ведущим признаком следует считать одышку по типу тахипноэ до 50—100 в минуту. В случаях уменьшенного легочного кровотока одышка выражена значительно меньше. Цианоз при общем артериальном стволе различен: он минимальный или отсутствует при увеличенном легочном кровотоке, выражен при склеротических изменениях в легочных сосудах (реакция Эйзенменгера) или стенозе легочной артерии. В последних случаях он сопро
вождается развитием симптомов «часовых стекол» и «барабанных палочек», иолицитемией. При кардиомегалии появляется сердечный горб. Тоны сердца громкие, II тон над легочной артерией акцентирован, может быть единым и расщепленным при наличии более трех створок. Часто определяется апикальный систолический клик. Грубый, продолжительный шум ДМЖП определяется в третьем и четвертом межреберьях слева у грудины, на верхушке может быть мезодиастолический шум относительного стеноза митрального клапана — признак гиперволе- мии малого круга кровообращения. Если структура створок вызывает стенотический эффект во втором и третьем межреберьях, слева или справа выслушивается систолический шум типа изгнания. При развитии недостаточности клапанов ствола вдоль левого края грудины появляется протодиастолический шум. Сердечная недостаточность выражена по право- и левожелудочковому типу вплоть до картины отека легкого; она меньше или отсутствует при гиповолемии малого круга кровообращения и склеротических изменениях в легочных сосудах.
Специфических электрокардиографических характеристик порока нет. Электрическая ось сердца расположена нормально или отклонена вправо (от -(-60 до 4-120°). У половины больных увеличены правое предсердие, правый желудочек (в отведении комплекс QRS типа R или qR), реже оба желудочка. При легочной гипертензии на ЭКГ появляются признаки перегрузки по типу „strain” в правых грудных отведениях (снижение интервала ST на 0,3—0,8 см, отрицательные зубцы Т в отведениях
Vi-з).
На ФКГ видны обычной амплитуды тоны на верхушке, во втором межреберье фиксируются аортальные клики; II тон чаще единый, но может быть широким и состоять из нескольких высокоамплитудных компонентов; фиксируется пансистолический шум, иногда высокочастотный с максимумом в третьем и четвертом межреберьях слева и протодиастолический шум — признак клапанной недостаточности.
На рентгенограмме органов грудной клетки легочный рисунок обычно усилен, при стенозе устья легочной артерии обеднен с двух сторон, при стенозе или атрезии одной из ветвей — с одной, при склеротической фазе легочной гипертензии — обеднен преимущественно по периферии и усилен в прикорневой зоне. Сердце чаще умеренно увеличено (кардиоторакальное отношение— от 52 до 80%), может стать яйцевидным с узким сосудистым пучком, что напоминает транспозицию магистральных сосудов, но с более прямым верхним левым краем. Увеличены, как правило, оба желудочка. Иногда сердце похоже по форме на таковое при тетраде Фалло, имеется характерное широкое основание сосуда с S-образным ходом. Правостороннее расположение дуги аорты находят у '/з больных, что в сочетании с усилением легочного кровотока и цианозом должно вызвать подозрение на общий артериальный ствол. Определенное диаг
ностическое значение может иметь высокое положение левой легочной артерии.
Характерным М-эхокардиографическим признаком порока является отсутствие непрерывного септально-аортального (переднего) продолжения, при этом широкий сосуд «верхом сидит» над ДМЖП. При преимущественном отхождении общего ствола от левого желудочка заднее (митрально-полулунное) продолжение сохранено. При сообщении артериального ствола преимущественно с правым желудочком регистрируется нарушение переднего и заднего непрерывного продолжений. Другими М-эхокар- диографическими признаками порока являются: невозможность определения второго полулунного клапана; диастолическое трепетание передней створки митрального клапана из-за недостаточности полулунного клапана общего артериального ствола; дилатация левого предсердия.
При двухмерном эхокардиографическом обследовании в проекции длинной оси левого желудочка определяется широкий магистральный сосуд, пересекающий («верхом сидящий») перегородку, большой ДМЖП, заднее продолжение сохранено. В короткой проекции на уровне основания сердца провожелу- дочковый выводной тракт и клапан легочной артерии не идентифицируются. Из супрастернального доступа в ряде случаев возможно определить место отхождения легочной артерии или ее ветвей от трункуса.
Катетеризация полостей сердца и ангиокардиография имеют решающее значение в диагностике. Венозный катетер входит в правый желудочек, где давление равно системному, но в сочетании с повышением насыщения крови кислородом свидетельствует
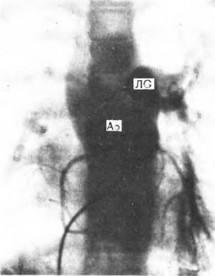
о ДМЖП. Далее катетер свободно проводится в трункус, где давление оказывается такое же, как в желудочках. Насыщение крови кислородом в общем артериальном стволе обычно колеблется в пределах 90—96 % в случаях с гиперволемией. Разница в насыщении кислородом крови легочной артерии и трункуса не превышает 10 %. Снижение насыщения крови кислородом до 80 % свидетельствует о склеротических изменениях в легочных сосудах и неоперабельности больных. При введении контрастного вещества в правый желудочек виден (лучше в боковой проекции) общий артериальный ствол, от которого отходят коронарные сосуды и легочная артерия (или ее ветви). Аортография позволяет окончательно подтвердить отхождение истинных легочных артерий непосредственно от ствола, детализировать тип порока и определить степень недостаточности клапана трункуса (рис. 66).
Дифференциальный диагноз следует проводить в случаях без цианоза с ДМЖП, при цианозе — с тетрадой Фалло (особенно при атрезии легочной артерии), транспозицией магистральных сосудов, синдромом Эйзенменгера.
Течение, лечение. Течение порока тяжелое с первых дней жизни больного из-за выраженной сердечной недостаточности и
1
 легочной гиперволемии; при цианозе тяжесть состояния пациента определяется степенью гипоксемии. Большинство детей умирают в первые месяцы жизни и только '/5 их переживает первый год, а 10% доживают до 1—3-го десятилетия [Calder L. et al., 1976j; известны случаи, когда пациенты доживали до 40—56 лет. В основном это были больные со склеротическими изменениями в легочных сосудах или со стенозом легочных ветвей.
легочной гиперволемии; при цианозе тяжесть состояния пациента определяется степенью гипоксемии. Большинство детей умирают в первые месяцы жизни и только '/5 их переживает первый год, а 10% доживают до 1—3-го десятилетия [Calder L. et al., 1976j; известны случаи, когда пациенты доживали до 40—56 лет. В основном это были больные со склеротическими изменениями в легочных сосудах или со стенозом легочных ветвей.
Дигоксин и мочегонные препараты (см. главу 22) дают незначительный эффект при общем артериальном стволе, особенно при клапанной недостаточности.
Методом выбора хирургического лечения у больных с общим артериальным стволом следует считать радикальную операцию по методу G. Rastelli и соавт. (1967) (см. главу 11). У новорожденных и младенцев с нарастающими признаками сердечной недостаточности, несмотря на медикаментозное лечение, может встать вопрос о срочном хирургическом вмешательстве. В возрасте до 3 мес таким больным чаще всего выполняли операцию сужения легочного ствола или обеих легочных артерий. Поскольку данная операция у больных с общим артериальным стволом сопровождается довольно высокой летальностью (в среднем 51 %), а у некоторых больных она не предотвращает развитие обструктивных изменений в легочных сосудах и нередко создает условия, в значительной степени затрудняющие выполнение в последующем радикальной коррекции, то операцию сужения легоч
ного ствола следует выполнять лишь как вынужденное хирургическое вмешательство. J. Stark и соавт. (1978) предпочитают производить корригирующую операцию у больных в возрасте до 1 года, так как риск выполнения в последующем повторной операции из-за небольшого диаметра первично имплантируемого кондуита будет небольшим.
Радикальная операция заключается в закрытий ДМЖП, разъединении легочных артерий от ствола и соединении их с правым желудочком с помощью клапансодержащего трубчатого протеза (кондуита). Первая в мире успешная операция по данной методике выполнена D. McGoon и соавт. (1968), а в нашей стране В. И. Бураковским и соавт. (1981). Следует отметить, что лишь единичные кардиохирургические клиники в мире располагают опытом коррекции общего артериального ствола.
Учитывая, что наиболее частой причиной летальных исходов является раннее развитие органических изменений в артериальном русле легких, в последнее время коррекцию порока производят в младенческом возрасте. Наилучшие результаты получены P. Ebert и соавт. (1981 —1984), которые прооперировали 112 детей в возрасте до 1 года с летальностью 11,6%, причем у 84 больных в возрасте до 6 мес летальность была меньше и составила 9,5%, тогда как у больных в возрасте от 6 до
Среди осложнений радикальной операции следует отметить кровотечение, сдавление протеза грудиной, острую сердечную недостаточность, обусловленную оставшимся высоким давлением в артериальном русле легких из-за обструктивной формы легочной гипертензии. Большую опасность после операции из-за возможности аррозивного кровотечения представляет гнойный меди- астенит, поскольку в средостении размещается больших размеров инородный материал, а операцию выполняют у ослабленных, отстающих в развитии младенцев и детей с явлениями тяжелой недостаточности кровообращения.
Отдаленные результаты благоприятные. Однако большому числу больных, оперированных в раннем возрасте, требуется повторная операция по замене кондуита. Среди больных, оперированных P. Ebert и соавт. (1984) в возрасте до 6 мес, повторная операция потребовалась в течение 4 лет 55 из 86 человек. Ухудшение состояния в отдаленные сроки может быть также связано с прогрессированием склеротических изменений в легочных сосу
дах. Примером могут служить данные R. DiDonato и соавт. (1983), согласно которым среди больных, оперированных в возрасте от 6 до 9 лет, выживаемость к 13 годам после операции составила 68%.
- 7% — по клиническим данным [Gasul В. М. et al., 1966; Kidd В., 1978].
Анатомия, классификация. Анатомическими критериями общего артериального ствола являются: отхождение от основания сердца одного сосуда, обеспечивающего системное, коронарное и легочное кровоснабжение; легочные артерии отходят от восходящей части ствола; имеется единое клапанное кольцо ствола. Термин «псевдотрункус» относится к аномалиям, при которых легочная артерия или аорта атрезированы и представлены фиброзными пучками. R. W. Collett и J. Е. Edwards (1949) выделяют 4 типа общего артериального ствола (рис. 65): I —единый ствол легочной артерии и восходящая аорта отходят от общего ствола, правая и левая легочные артерии — от короткого легочного ствола; II — левая и правая легочные артерии расположены рядом и отходят каждая от задней стенки трункуса;
- — отхождение правой, левой или обеих легочных артерий от боковых стенок трункуса; IV — отсутствие легочных артерий, из-за чего кровоснабжение легких осуществляется через бронхиальные артерии, отходящие от нисходящей аорты. Этот вариант в настоящее время не признается как тип истинного общего артериального ствола, при котором хотя бы одна ветвь легочной артерии должна отходить от трункуса. Таким образом, можно говорить в основном о двух типах пороков: I и II—III.
При I типе общего артериального ствола длина общего ствола легочной артерии составляет 0,4—2 см, возможны аномалии развития легочной артерии: отсутствие правой или левой ветви, стеноз устья общего ствола. При II варианте размеры легочных артерий равны и составляют 2—8 мм, иногда одно меньше другого Клапан общего артериального ствола может быть одно- (4 %), двух- (32 %), трех- (49 %) и четырехстворчатым (15 %). F. Butto и соавт. (1986) впервые описали клапан с одной комиссурой при общем артериальном стволе, который, как и при стенозе аорты, создает схенотический гемодинамический эффект. Створки могут быть нормальными, утолщенными (22%) (по краю видны мелкие узелки, миксоматозные изменения), дисплас- тичными (50 %). Такое строение створок предрасполагает к клапанной недостаточности. С возрастом деформация створок увеличивается, у детей старшего возраста возможно развитие каль-


Рис. 65. Варианты общего артериального ствола (схема).
циноза. Створки клапана общего ствола фиброзно связаны с митральным клапаном, поэтому считается, что он в основном аортальный.
Место расположения трункуса над желудочками имеет значение при отборе больных на радикальную коррекцию порока. В наблюдениях F. Butto и соавт (1986) в 42 % он располагался в равной мере над обоими желудочками, в 42 % — преимущественно над правым ив 16 % — преимущественно над левым желудочком. В этих случаях выходом из желудочка, не соединяющегося со стволом, служит ДМЖП. По другим наблюдениям, отхождение трункуса от правого желудочка встречается в 80 % случаев, при этом закрытие ДМЖП во время операции приводит к субаортальной обструкции.
ДМЖП всегда имеется при общем артериальном стволе, он не имеет верхнего края, лежит непосредственно под клапанами и сливается с устьем ствола, инфундибулярная перегородка отсутствует.
Этот порок часто сочетается с аномалиями дуги аорты: перерыв, атрезия, праворасположенная дуга, сосудистое кольцо, коарктация.
Другими сопутствующими ВПС бывают открытый общий ат
риовентрикулярный канал, единственный желудочек, единая легочная артерия, аномальный дренаж легочных вен. Из экстра- кардиальных пороков встречаются аномалии желудочно-кишечного тракта, урогенитальные и скелетные аномалии.
Гемодинамика. Кровь из правого и левого желудочков попадает в единый сосуд через ДМЖП; давление в обоих желудочках, трункусе и ветвях легочной артерии равное, что объясняет раннее развитие легочной гипертензии; исключение составляют случаи со стенозом устья легочной артерии и ее ветвей или малым их диаметром. Правый желудочек при общем артериальном стволе преодолевает системное сопротивление, что вызывает гипертрофию его миокарда, дилатацию полости. Гемодинамичес- кие особенности порока определяются во многом состоянием кровообращения в малом круге. Можно выделить следующие варианты.
- Повышенный легочный кровоток с низким сопротивлением в сосудах легкого, давление в легочных артериях равно системному, что свидетельствует о высокой легочной гипертензии. Чаще встречается у детей раннего возраста, сопровождается сердечной недостаточностью, резистентной к терапни. Цианоза может не быть, поскольку большое количество крови оксигенируется в легких и смешивается в желудочках из-за большого размера ДМЖП. Большой сброс в общий ствол, особенно при многостворчатом клапане, способствует появлению со временем клапанной недостаточности, которая еще более усугубляет тяжесть клинического течения заболевания.
- Нормальный или слабо увеличенный легочный кровоток вследствие новы шенного сопротивления в сосудах малого круга, предотвращающий большой сброс крови в общий ствол. Сердечная недостаточность отсутствует, при нагрузке появляется цианоз.
- Сниженный легочный кровоток (гиповолемия) может возникнуть при сужении устья ствола или ветвей легочной артерии или при прогрессирующем склерозе легочных сосудов. Постоянно отмечается выраженный цианоз, так как в легких оксигенируется незначительная часть крови.
Сердечная недостаточность носит бивентрикулярный характер; выраженная недостаточность левого желудочка объясняется большим возвратом крови в его полость и нередко имеющимся препятствием к выбросу при преимущественном отхождении общего ствола от правого желудочка. При развитии высокой легочной гипертензии, ее склеротической фазы, состояние больных улучшается, уменьшаются размеры сердца и проявления сердечной недостаточности, но увеличивается выраженность цианоза. Учитывая анатомическое строение створок клапана ствола, возможно развитие их недостаточности и/или стеноза.
Клиника, диагностика. По клиническим проявлениям дети с этим пороком напоминают больных с большим ДМЖП. Ведущим признаком следует считать одышку по типу тахипноэ до 50—100 в минуту. В случаях уменьшенного легочного кровотока одышка выражена значительно меньше. Цианоз при общем артериальном стволе различен: он минимальный или отсутствует при увеличенном легочном кровотоке, выражен при склеротических изменениях в легочных сосудах (реакция Эйзенменгера) или стенозе легочной артерии. В последних случаях он сопро
вождается развитием симптомов «часовых стекол» и «барабанных палочек», иолицитемией. При кардиомегалии появляется сердечный горб. Тоны сердца громкие, II тон над легочной артерией акцентирован, может быть единым и расщепленным при наличии более трех створок. Часто определяется апикальный систолический клик. Грубый, продолжительный шум ДМЖП определяется в третьем и четвертом межреберьях слева у грудины, на верхушке может быть мезодиастолический шум относительного стеноза митрального клапана — признак гиперволе- мии малого круга кровообращения. Если структура створок вызывает стенотический эффект во втором и третьем межреберьях, слева или справа выслушивается систолический шум типа изгнания. При развитии недостаточности клапанов ствола вдоль левого края грудины появляется протодиастолический шум. Сердечная недостаточность выражена по право- и левожелудочковому типу вплоть до картины отека легкого; она меньше или отсутствует при гиповолемии малого круга кровообращения и склеротических изменениях в легочных сосудах.
Специфических электрокардиографических характеристик порока нет. Электрическая ось сердца расположена нормально или отклонена вправо (от -(-60 до 4-120°). У половины больных увеличены правое предсердие, правый желудочек (в отведении комплекс QRS типа R или qR), реже оба желудочка. При легочной гипертензии на ЭКГ появляются признаки перегрузки по типу „strain” в правых грудных отведениях (снижение интервала ST на 0,3—0,8 см, отрицательные зубцы Т в отведениях
Vi-з).
На ФКГ видны обычной амплитуды тоны на верхушке, во втором межреберье фиксируются аортальные клики; II тон чаще единый, но может быть широким и состоять из нескольких высокоамплитудных компонентов; фиксируется пансистолический шум, иногда высокочастотный с максимумом в третьем и четвертом межреберьях слева и протодиастолический шум — признак клапанной недостаточности.
На рентгенограмме органов грудной клетки легочный рисунок обычно усилен, при стенозе устья легочной артерии обеднен с двух сторон, при стенозе или атрезии одной из ветвей — с одной, при склеротической фазе легочной гипертензии — обеднен преимущественно по периферии и усилен в прикорневой зоне. Сердце чаще умеренно увеличено (кардиоторакальное отношение— от 52 до 80%), может стать яйцевидным с узким сосудистым пучком, что напоминает транспозицию магистральных сосудов, но с более прямым верхним левым краем. Увеличены, как правило, оба желудочка. Иногда сердце похоже по форме на таковое при тетраде Фалло, имеется характерное широкое основание сосуда с S-образным ходом. Правостороннее расположение дуги аорты находят у '/з больных, что в сочетании с усилением легочного кровотока и цианозом должно вызвать подозрение на общий артериальный ствол. Определенное диаг
ностическое значение может иметь высокое положение левой легочной артерии.
Характерным М-эхокардиографическим признаком порока является отсутствие непрерывного септально-аортального (переднего) продолжения, при этом широкий сосуд «верхом сидит» над ДМЖП. При преимущественном отхождении общего ствола от левого желудочка заднее (митрально-полулунное) продолжение сохранено. При сообщении артериального ствола преимущественно с правым желудочком регистрируется нарушение переднего и заднего непрерывного продолжений. Другими М-эхокар- диографическими признаками порока являются: невозможность определения второго полулунного клапана; диастолическое трепетание передней створки митрального клапана из-за недостаточности полулунного клапана общего артериального ствола; дилатация левого предсердия.
При двухмерном эхокардиографическом обследовании в проекции длинной оси левого желудочка определяется широкий магистральный сосуд, пересекающий («верхом сидящий») перегородку, большой ДМЖП, заднее продолжение сохранено. В короткой проекции на уровне основания сердца провожелу- дочковый выводной тракт и клапан легочной артерии не идентифицируются. Из супрастернального доступа в ряде случаев возможно определить место отхождения легочной артерии или ее ветвей от трункуса.
Катетеризация полостей сердца и ангиокардиография имеют решающее значение в диагностике. Венозный катетер входит в правый желудочек, где давление равно системному, но в сочетании с повышением насыщения крови кислородом свидетельствует
о ДМЖП. Далее катетер свободно проводится в трункус, где давление оказывается такое же, как в желудочках. Насыщение крови кислородом в общем артериальном стволе обычно колеблется в пределах 90—96 % в случаях с гиперволемией. Разница в насыщении кислородом крови легочной артерии и трункуса не превышает 10 %. Снижение насыщения крови кислородом до 80 % свидетельствует о склеротических изменениях в легочных сосудах и неоперабельности больных. При введении контрастного вещества в правый желудочек виден (лучше в боковой проекции) общий артериальный ствол, от которого отходят коронарные сосуды и легочная артерия (или ее ветви). Аортография позволяет окончательно подтвердить отхождение истинных легочных артерий непосредственно от ствола, детализировать тип порока и определить степень недостаточности клапана трункуса (рис. 66).
Дифференциальный диагноз следует проводить в случаях без цианоза с ДМЖП, при цианозе — с тетрадой Фалло (особенно при атрезии легочной артерии), транспозицией магистральных сосудов, синдромом Эйзенменгера.
Течение, лечение. Течение порока тяжелое с первых дней жизни больного из-за выраженной сердечной недостаточности и
1
 легочной гиперволемии; при цианозе тяжесть состояния пациента определяется степенью гипоксемии. Большинство детей умирают в первые месяцы жизни и только '/5 их переживает первый год, а 10% доживают до 1—3-го десятилетия [Calder L. et al., 1976j; известны случаи, когда пациенты доживали до 40—56 лет. В основном это были больные со склеротическими изменениями в легочных сосудах или со стенозом легочных ветвей.
легочной гиперволемии; при цианозе тяжесть состояния пациента определяется степенью гипоксемии. Большинство детей умирают в первые месяцы жизни и только '/5 их переживает первый год, а 10% доживают до 1—3-го десятилетия [Calder L. et al., 1976j; известны случаи, когда пациенты доживали до 40—56 лет. В основном это были больные со склеротическими изменениями в легочных сосудах или со стенозом легочных ветвей.
Дигоксин и мочегонные препараты (см. главу 22) дают незначительный эффект при общем артериальном стволе, особенно при клапанной недостаточности.
Методом выбора хирургического лечения у больных с общим артериальным стволом следует считать радикальную операцию по методу G. Rastelli и соавт. (1967) (см. главу 11). У новорожденных и младенцев с нарастающими признаками сердечной недостаточности, несмотря на медикаментозное лечение, может встать вопрос о срочном хирургическом вмешательстве. В возрасте до 3 мес таким больным чаще всего выполняли операцию сужения легочного ствола или обеих легочных артерий. Поскольку данная операция у больных с общим артериальным стволом сопровождается довольно высокой летальностью (в среднем 51 %), а у некоторых больных она не предотвращает развитие обструктивных изменений в легочных сосудах и нередко создает условия, в значительной степени затрудняющие выполнение в последующем радикальной коррекции, то операцию сужения легоч
ного ствола следует выполнять лишь как вынужденное хирургическое вмешательство. J. Stark и соавт. (1978) предпочитают производить корригирующую операцию у больных в возрасте до 1 года, так как риск выполнения в последующем повторной операции из-за небольшого диаметра первично имплантируемого кондуита будет небольшим.
Радикальная операция заключается в закрытий ДМЖП, разъединении легочных артерий от ствола и соединении их с правым желудочком с помощью клапансодержащего трубчатого протеза (кондуита). Первая в мире успешная операция по данной методике выполнена D. McGoon и соавт. (1968), а в нашей стране В. И. Бураковским и соавт. (1981). Следует отметить, что лишь единичные кардиохирургические клиники в мире располагают опытом коррекции общего артериального ствола.
- Appelbaum и соавт. (1976) представили результаты хирургического лечения 22 больных' с летальностью 41 %, которая была выше у детей в возрасте до 2 лет и составила 80%, тогда как в более старшей группе — 8 %. С. Marcelletti и соавт. (1977) среди 92 оперированных больных летальный исход отметили у 23 (25%) и 8 больных (12%) умерли в поздние сроки.
Учитывая, что наиболее частой причиной летальных исходов является раннее развитие органических изменений в артериальном русле легких, в последнее время коррекцию порока производят в младенческом возрасте. Наилучшие результаты получены P. Ebert и соавт. (1981 —1984), которые прооперировали 112 детей в возрасте до 1 года с летальностью 11,6%, причем у 84 больных в возрасте до 6 мес летальность была меньше и составила 9,5%, тогда как у больных в возрасте от 6 до
- мес — 17,8 %. В нашей стране наибольшим опытом хирургического лечения располагают В. И. Бураковский и соавт. (1986), которые оперировали 9 больных с двумя летальными исходами (22,2%).
Среди осложнений радикальной операции следует отметить кровотечение, сдавление протеза грудиной, острую сердечную недостаточность, обусловленную оставшимся высоким давлением в артериальном русле легких из-за обструктивной формы легочной гипертензии. Большую опасность после операции из-за возможности аррозивного кровотечения представляет гнойный меди- астенит, поскольку в средостении размещается больших размеров инородный материал, а операцию выполняют у ослабленных, отстающих в развитии младенцев и детей с явлениями тяжелой недостаточности кровообращения.
Отдаленные результаты благоприятные. Однако большому числу больных, оперированных в раннем возрасте, требуется повторная операция по замене кондуита. Среди больных, оперированных P. Ebert и соавт. (1984) в возрасте до 6 мес, повторная операция потребовалась в течение 4 лет 55 из 86 человек. Ухудшение состояния в отдаленные сроки может быть также связано с прогрессированием склеротических изменений в легочных сосу
дах. Примером могут служить данные R. DiDonato и соавт. (1983), согласно которым среди больных, оперированных в возрасте от 6 до 9 лет, выживаемость к 13 годам после операции составила 68%.
