Отхождение магистральных сосудов от правого желудочка относится к редким порокам сердца, частота его не превышает 1 % всех ВПС [Gasul В. et al., 1966]. Порок впервые описан Т. В. Peacock (1866). Существует несколько названий этого порока: частичная транспозиция, двойной выход из правого желудочка, аномалия Тауссиг — Бинга, двойное отхождение магистральных сосудов (ДОМС) от правого желудочка.
Анатомия, классификация. Основными признаками ДОМС от правого желудочка является: а) полное отхождение аорты и легочной артерии от правого желудочка; б) наличие двух конусов
Рис. 54. Варианты топографии дефекта межжелудочковой перегородки при от- хождеиии магистральных сосудов от правого желудочка Объяснение в тексте.
в правом желудочке, образующих отдельные выводные отделы для аорты и легочной артерии; в) отсутствие фиброзного продолжения между полулунными и атриовентрикулярными клапанами; г) опорожнение левого желудочка только через дефект межже- л'удочковой перегородки (ДМЖП), который может располагаться под клапанами аорты или легочной артерии, д) расположение клапанов аорты и легочной артерии на одном уровне.
Согласно классификации М. Lev и соавт. (1972) при ДОМС от правого желудочка выделяются 4 типа локализации ДМЖП:
а) подаортальный, б) подлегочный, в) под обоими магистральными сосудами, г) несообщающийся или отдаленный от магистральных сосудов (рис. 54).
Следует остановиться на таком признаке ДОМС, как отсутствие полулунно-атриовентрикулярного фиброзного продолжения. В норме фиброзное основание передней створки митрального клапана переходит непосредственно в фиброзное основание задней (некоронарной) и левой коронарной створок аортального клапана в области их соприкосновения с мембранозной частью межжелудочковой перегородки. Вследствие этого передняя створка митрального клапана и задняя створка аортального клапана имеют общую точку прикрепления и пути притока и оттока левого желудочка разделены только передней створкой митрального клапана. В нормальном сердце трикуспидальный и легочный клапаны всегда разобщены париетальной ножкой наджелудочкового гребня. Отсутствие резорбции бульбарно-вентрикулярного гребня в процессе эмбриогенеза приводит к отхождению аорты от правого желудочка и отсутствию митрально-аортального фиброзного продолжения. При этом отсутствует и легочно-трикус- пидальное продолжение, т. е. оба полулунных клапана отделены от атриовентрикулярных мышечной тканью.
При первом классическом варианте порока (по М. Lev и соавт., 1972) ДМЖП обычно большой, расположен кзади и под септальной ножкой наджелудочкового гребня, со стороны левого желудочка он занимает мембранную часть межжелудочковой перегородки. Расположение магистральных сосудов вариабельно и может быть таким же, как при полной корригированной транспозиции аорты и легочной артерии. Второй вариант порока (аномалия Тауссиг — Бинга) отличается от первого расположением ДМЖП, который находится кпереди от септальной ножки наджелудочкового гребня и над ней. При третьем варианте ДМЖП расположен высоко под обоими магистральными сосудами. При четвертом, наиболее сложном варианте порока, ДМЖП находится в трабекулярной части перегородки в стороне от магистральных сосудов.
Почти в 60 % случаев ДОМС сочетается с другими ВПС — стенозом легочной артерии, аномалиями коронарных артерий, открытым общим атриовентрикулярным каналом и др.
Гемодинамика обусловлена анатомической формой порока и состоянием легочного кровотока. При первом варианте порока венозная кровь из правого желудочка в виде отдельного потока поступает в легочную артерию, в то время как из левого желудочка благодаря подаортальной локализации ДМЖП артериальная кровь преимущественно направляется в аорту (см. рис. 54). Поскольку в большой круг кровообращения поступает в основном артериальная кровь, артериальная гипоксемия, как правило, отсутствует. Такие условия гемодинамики обычно наблюдаются У больных без стеноза легочной артерии. У них с рождения определяются гиперволемия малого круга кровообращения и легоч
ная гипертензия. Лишь с повышением легочного сосудистого сопротивления, которое превышает периферическое сопротивление, правому желудочку становится легче нагнетать кровь в аорту, чем в легочную артерию; происходит уменьшение легочного кровотока — все это обусловливает появление артериальной гипоксемии.
Однако в ряде случаев, несмотря на отсутствие органических изменений в малом круге кровообращения и «благоприятное, физиологическое» направление потоков крови, может наблюдаться частичное смешивание потоков крови в полости правого желудочка. Следствием этого являются поступление части венозной крови в аорту и легкая артериальная гипоксемия.
При втором варианте порока в аорту нагнетается венозная кровь из правого желудочка, а в легочную артерию, в силу подлегочного расположения ДМЖП, поступает преимущественно артериальная кровь из левого желудочка (см. рис. 54). У таких больных наряду с гиперволемией малого круга кровообращения и легочной гипертензией наблюдается выраженная артериальная гипоксемия. В разной степени артериальная гипоксемия присутствует и при других вариантах порока.
При стенозе легочной артерии вследствие уменьшения легочного кровотока в аорту поступает венозная кровь, объем которой зависит от сопротивления стеноза, вследствие этого возникает артериальная гипоксемия.
Клиника, диагностика. Клиническая картина первого варианта порока без стеноза легочной артерии сходна с таковой при ДМЖП (см. главу 6) с легочной гипертензией и большим арте- риовенозным сбросом: рано развивается гипотрофия II—III степени, характерны рецидивирующие пневмонии, рефрактерная к лечению сердечная недостаточность. В первые месяцы жизни у больных в связи с повышенным общелегочным сопротивлением может наблюдаться цианоз. Появление его у взрослых больных указывает на развитие склероза легочных сосудов. При наличии стеноза легочной артерии клиническая картина напоминает симптоматику тетрады Фалло (см. главу 10); возможно возникновение одышечно-цианотических приступов.
При втором варианте порока (аномалии Тауссиг—Бинга) клиническая картина аналогична той, которую наблюдают при полной транспозиции аорты и легочной артерии (см. главу 12): наряду с признаками легочной гипертензии обычно определяются цианоз и сердечная недостаточность. Степень цианоза может быть различной — от незначительной до резко выраженной. При стенозе легочной артерии состояние больных менее тяжелое. Клиническая картина третьего и четвертого вариантов порока также определяется наличием или отсутствием легочного стеноза и характером легочной гипертензии.
На ЭКГ при первом варианте порока без стеноза легочной артерии отмечаются отклонение электрической оси сердца как влево, так и вправо, признаки выраженной гипертрофии миокарда
правого и в меньшей степени левого желудочка, замедление атриовентрикулярной проводимости. Изолированная гипертрофия левого желудочка при этом варианте порока не описана. Проявления значительной гипертрофии левого предсердия и желудочка наблюдаются при небольшом ДМЖП, создающем значительные препятствия для опорожнения левого желудочка. Изолированная гипертрофия миокарда правого желудочка может указывать на увеличенный легочный кровоток. При сочетании со стенозом легочной артерии отмечаются отклонение электрической оси сердца вправо, гипертрофия правого предсердия и желудочка (ЭКГ аналогична таковой при тетраде Фалло); признаки гипертрофии левого желудочка в этой ситуации свидетельствуют о небольшом ДМЖП. При аномалии Тауссиг — Бинга на ЭКГ отмечаются отклонение электрической оси сердца вправо, признаки гипертрофии правого предсердия и желудочка; гипертрофия левого желудочка наблюдается у детей раннего возраста и при сопутствующих ВПС (коарктация аорты, гипоплазия или атрезия аорты).
ФКГ у больных без стеноза легочной артерии напоминает таковую при изолированном ДМЖП, при наличии стеноза — идентична тетраде Фалло.
Рентгенологическая картина неспецифична; при первом варианте порока без стеноза легочной артерии изменения такие же, как при изолированном ДМЖП с легочной гипертензией. В тех случаях, когда размеры сердца не увеличены, можно думать о развитии склеротических изменений в легочных сосудах. У больных с аномалией Тауссиг — Бинга наряду с усилением легочного рисунка и кардиомегалией определяется резкое выбухание ствола легочной артерии. При стенозе легочной артерии рентгенологические изменения такие же, как при тетраде Фалло.
Характерными признаками двойного отхождения магистральных сосудов от правого желудочка при одновременной эхокардиографии являются отсутствие заднего митрально-полулунного продолжения (смещение вперед задней стенки аорты по отношению к передней створке митрального клапана) и гипоплазия левого желудочка. Двухмерная эхокардиография позволяет непосредственно определить место отхождения аорты, при этом в проекции длинной оси сосуды лежат параллельно, образуя отдельные выходы из правого желудочка без фиброзного продолжения между полулунными и атриовентрикулярными клапанами. В проекции короткой оси выявляются две округлые тени сосудов, при этом клапаны аорты и легочной артерии находятся на одном уровне. В продольных и коротких сечениях определяется локализация ДМЖП. На рис. 55 (верхушечная проекция, продольное сечение) видна аорта, отходящая от полости ПЖ, хорошо выражена бульбовентрикулярная складка; стрелкой указан подаортальный. дефект межжелудочковой перегородки.
При катетеризации полостей сердца выявляется свободное прохождение катетера из правого желудочка в аорту, одинаковое давление в аорте, легочной артерии и обоих желудочках.
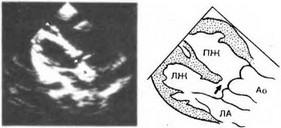
Рис. 55. Отхождение магистральных сосудов от правого желудочка с подаорталь- иым дефектом межжелудочковой перегородки. Эхокардиограмма.
Наличие систолического градиента между левым желудочком, с одной стороны, и аортой и правым желудочком — с другой, может указывать на относительно маленькие размеры ДМЖП. При выраженном стенозе легочной артерии данные зондирования не позволяют отличить ДОМС от тетрады Фалло. У больных с аномалией Тауссиг — Бинга характерным признаком является более высокое насыщение крови кислородом в легочной артерии, чем в аорте, вследствие преимущественного кровотока из левого желудочка в легочную артерию.
Ангиокардиография является основным методом диагностики. Первый вариант порока характеризуется следующими признаками (рис. 56): 1) одновременное контрастирование из правого желудочка аорты и легочной артерии, причем вследствие преимущественного поступления неконтрастированной крови из левого желудочка в аорту последняя контрастируется слабее легочной артерии; 2) расположение в прямой проекции клапанов аорты и легочной артерии в одной горизонтальной плоскости, аортальный клапан — справа от легочного, иногда чуть выше или ниже его; в боковой проекции — декстропозиция аорты; 3) двойной конус в правом желудочке, образующий отдельные выходные отделы для аорты и легочной артерии, а также языкообразный дефект наполнения между клапанами аорты и легочной артерии; 4) расположение ДМЖП под клапанами аорты, он является единственным выходом из левого желудочка; 5) в боковой проекции — дефект наполнения между митральным и аортальным клапаном, свидетельствующий об отсутствии митрально-аортального фиброзного продолжения (основной признак ДОМС), через подаор- тальный дефект межжелудочковой перегородки (указан стрелками на рис. 56) контрастируется ЛЖ.
При втором варианте аорта контрастируется раньше и плотнее легочного ствола, последний резко расширен, ДМЖП располагается под клапанами легочной артерии кзади и левее наджелудочкового гребня. В боковой проекции отмечается дефект наполнения между митральными и легочными клапанами, свидетельствующий об от-
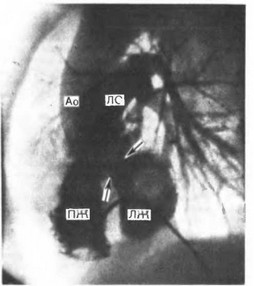
Рис. 56. Отхождение магистральных сосудов от правого желудочка (боковая проекция). Правая вентрикулограмма. Объяснение в тексте.
сутствии митрально-легочного фиброзного продолжения. Аналогичная картина наблюдается при третьем и четвертом типах порока.
Дифференциальный диагноз первого варианта порока проводят с ДМЖП, открытым общим атриовентрикулярным каналом, при стенозе легочной артерии — с тетрадой Фалло, при сочетании ДОМС с передним расположением аорты необходимо исключить полную транспозицию магистральных сосудов. Аномалию Тауссиг — Бинга дифференцируют с полной транспозицией аорты и легочной артерии с большим ДМЖП и высокой легочной гипертензией.
Течение, лечение. Без хирургического лечения прогноз заболевания неблагоприятный, большинство больных с легочной гипертензией погибают на первом году жизни. Продолжительность жизни увеличивается при сочетании порока со стенозом легочной артерии; описаны случаи, когда больные доживали до 35 лет. Причинами смерти неоперированных больных являются сердечная недостаточность на фоне двусторонней пневмонии, спонтанное закрытие ДМЖП.
Показания к операции аналогичны таковым при ДМЖП и тетраде Фалло. Паллиативные операции заключаются в наложении межартериальных анастомозов у больных со стенозом легочной артерии и сужением легочной артерии при увеличенном легочном кровотоке. Впервые радикальная коррекция первого
варианта порока выполнена J. Kirklin в 1961 г. Основным принципом радикальной коррекции является создание адекватного сообщения между левым желудочком и большим кругом кровообращения с помощью заплаты, вшиваемой внутри полости правого желудочка и соединяющей в виде туннеля дефект межжелудочковой перегородки с устьем аорты. При маленьких размерах дефекта, когда он меньше устья аорты, производят расширение дефекта, иссекая передневерхний край его, так называемую под- аортальную кональную мышцу. Стеноз легочной артерии устраняют обычным путем. В тех случаях, когда не представляется возможным адекватное устранение стеноза легочной артерии, выпол няют операцию Растелли — экстракардиальное создание сообщения между правым желудочком и легочной артерией с помощью трубчатого протеза («кондуита»), т. е. создают искусственную легочную артерию.
В связи с тем что при аномалии Тауссиг — Бинга трудно создать прямое сообщение между левым желудочком и аортой в силу отдаленности межжелудочкового дефекта от устья аорты, вначале устанавливают с помощью заплаты сообщение левого желудочка с устьем легочной артерии, создавая таким образом функциональную полную транспозицию аорты и легочной артерии, затем производят коррекцию транспозиции по методу W. Mustard. В 1968 г. D. L. Patric и D. С. McGoon предложили оригинальную операцию внутрижелудочковой коррекции аномалии Тауссиг—Бинга, при которой сформированный из синтетической ткани туннель в полости правого желудочка направляет артериальную кровь из левого желудочка в аорту, не создавая препятствия для выброса крови из правого желудочка в легочную артерию.
При сложных формах порока, обусловленных локализацией ДМЖП или множественными ДМЖП типа «швейцарского сыра» и сочетающихся со стенозом легочной артерии, для избежания высокого риска радикальной операции может быть применена операция гемодинамической коррекции с использованием принципа Фонтена [Бураковский В. И. и др., 1988).
Операция состоит в выключении из кровообращения правого желудочка посредством закрытия трикуспидального и легочного отверстий и соединений правого предсердия с легочной артерией.
Учитывая плохие результаты операции с повышенным общелегочным сопротивлением, некоторые авторы считают нецелесообразным проводить операцию больным, у которых общелегочное сопротивление превышает 10 ед/м2. У детей раннего возраста рекомендуют выполнять операцию сужения легочной артерии (летальность около 50%), а вторым этапом в возрасте
- 5 лет — радикальную коррекцию. По данным Г. Э. Фальковско- го и Л. А. Бузиновой (1986), из 10 детей первых лет жизни с ДОМС от правого желудочка после радикальной операции (созда ние внутрисердечного туннеля, соединяющего дефект с устьем аорты с помощью синтетической или ксеноперикардиальной заплаты) умерло двое (20%).
Радикальная коррекция ДОМС от правого желудочка сопровождается высокой летальностью (около 30%) [Harvey J. et al., 1977; Stark J., de Leval М., 1983]. Наибольшее число неблагоприятных исходов приходится на подлегочную и мышечную локализацию ДМЖП, ранний детский возраст, сочетание ДОМС от правого желудочка с другими пороками.
В нашей стране самым большим опытом радикальной коррекции располагают В. И. Бураковский и соавт. (1988); ими прооперировано 55 болных, летальность — 14,5%.
Причиной послеоперационной летальности чаще всего является сердечная недостаточность. Среди осложнений отмечают реканализацию ДМЖП, полную поперечную блокаду, развитие субаортального стеноза.
Отдаленные послеоперационные результаты при ДМЖП, располагающемся под аортой или под обоими магистральными сосудами, как правило, хорошие. Пациенты активны и хорошо переносят физические нагрузки. Значительно хуже результаты при других локализациях ДМЖП.
По данным R. Stewart и соавт. (1979), выживаемость после коррекции неосложненных форм ДОМС от правого желудочка (с суб- аортальной локализацией ДМЖП) составила 86 % к 7 годам после операции, тогда как после коррекции ДОМС с подлегочной лока лизацией ДМЖП — только 38 % к 6 годам. Из осложнений в отдаленном периоде отмечают нарушения ритма сердца и прогрессирование изменений легочных сосудов. Повторные операции обычно связаны с отхождением заплаты, образующей туннель, и остаточным стенозом легочной артерии.
