Клинические проявления
Бронхиальная астма чаще характеризуется пароксизмально- стью кашлевой реакции или удушья в определенное время суток (чаще ночью), наличием экспираторной одышки со свистом на фоне удлиненного выдоха. Внезапность этих проявлений—неприятный сюрприз для больного — требует неотложной помощи. Приступ удушья может так же быстро закончиться с отхож- дением незначительного количества слизистой по характеру
мокроты, при отсутствии каких-либо клинических проявлений в межприступный период.
Однако при сезонной бронхиальной астме, обусловленной пыльцой растений, чаще заболеванию сопутствуют или предшествуют проявления поллиноза (ринита, конъюнктивита, атопического дерматита), в межсезонный период проявления БА отсутствуют. Частота пароксизмальных приступов удушья зависит от степени тяжести БА.
Диагноз
Главные концептуальные направления диагностики БА отражены в ряде национальных программ по борьбе с бронхиальной астмой, которые позволяют выделить из перечня обструктивных болезней органов дыхания БА в самостоятельную нозологическую форму (А.Г. Чучалин, 1998). В настоящее время идет интенсивное изучение основных биологических маркеров БА.
- БА — персиетирующее воспаление, ведущее к хрониза- ции патологического процесса.
- При БА среди воспалительных клеток преобладают эозино- филы, которые под воздействием факторов адгезии прилипают к стенке сосудов и пронизывают все стенки бронхов, проникая в просвет последних.
Морфометрические параметры этих клеток в очаге воспаления обращают на себя внимание тем, что они крайне активизированы и, дегранулируя, осуществляют активный синтез ряда пептидов. Это большой основной протеин, эозинофильный катионный протеин, эозинофильная пероксидаза, эозинофильный протеин X, ряд активных медиаторов воспаления — фактор активации тромбоцитов, лейкотриены (LTC4), усиливающих брон- хоконстрикцию, проницаемость сосудов и активирующих ряд других клеточных образований (Э.Х. Анаев, А.Г. Чучалин, 1997).
- Основным маркером бронхиальной астмы является массовая десквамация клеток мерцательного эпителия, оголение и деструкция базальной мембраны бронхиального дерева на фоне активации эозинофилов, макро- и микрофагов с поражением эпителиальных и эндотелиальных клеток и высоким содержанием эндотелина—белка эпителиальных клеток — мощного провокатора бронхоспазма.
- Пароксизмальная гиперреактивность бронхиального дерева, выявляемая с помощью ингаляционных проб с гистамином, метахолином, ацетилхолином к специфическим и неспецифическим макро- и микроэкологическим факторам.
- В диагностике БА в ряде случаев актуально исследование бронхиопярно-альвеопярного лаважа, который позволяет определить клеточный состав и продукты функциональной активности клеток воспаления (табл. 20).
Табл. 20. Цитограмма бронхиолярно-альвеолярноголаважа у здоровых и больных БА (О.М. Гробова, АЛ. Черняев, 1998)
|
Показатель |
Здоровые |
Больные БА |
|
|
|
некурящие |
курящие |
|
|
Цитоз (в 1 мл) |
(0,1—0,3)-106 |
Более 0,3-106 |
_ |
|
Альвеолярные |
|
|
|
|
макрофаги |
82—98 % |
94% |
Особенно повышены у детей |
|
Лимфоциты |
7—12% |
- |
- |
|
Т-лимфоциты |
70% |
- |
Повышены |
|
Т-хелперы |
50% |
|
Повышены |
|
Т-супрессоры |
30% |
- |
Повышены |
|
В-лимфоциты |
5—10% |
- |
- |
|
Нуль-клетки |
19% |
- |
- |
|
Нейтрофилы |
1—2% |
0,8 % |
Повышены в позднюю фазу аллергии |
|
Эозинофилы |
lt; 1 % |
0,6 % |
Повышены в раннюю фазу аллергии |
|
Базофилы |
lt; 1 % |
|
|
|
Триптаза |
|
|
Повышена |
|
Гистамин |
|
|
Повышен |
- Маркером активности воспаления при БА является повышение концентрации оксида азота (NO) в выдыхаемом воздухе.
- Высокое наследственное предрасположение при аллергической БА.
- При оценке иммунологического гомеостаза обращают на себя внимание: а) высокое содержание общего и особенно специфического IgE, б) переключение ТхО на Тх2 с выбросом ИЛ-4 и ИЛ-5, усиливающих экспрессию В-лимфоцитами IgE.
- Естественно, что в условиях поликлиники практический врач не сумеет использовать весь этот арсенал биологических маркеров в диагностике БА. Поэтому наряду с вышеприведенными опорными признаками БА принимаются во внимание аллергологический анамнез; клинические особенности заболевания; аллергологическое тестирование.
- Более сложна диагностика неаллергической БА, так как клинические проявления ее во внеприступный период имеют много общих черт с хроническим бронхитом (см. Хронический бронхит).
- Исследование функциональных показателей внешнего
дыхания с проведением фармакологических проб является одним из важных этапов в диагностике БА, принятии экспертных решений и проведении реабилитации.
Среди предлагаемых функциональных тестов заслуживают особого внимания те из них, которые выполняются в скоростном режиме на выдохе и вдохе, в частности: 1) объем форсированного выдоха за 1 с (ОФВ|); 2) анализ петли «объем—поток» (пнев- мотахография); 3) пиковая (максимальная) скорость выдоха — ПСВ (пикфлоуметрия) при мониторировании в амбулаторных условиях. Мониторирование ПСВ в течение суток дает возмож- ' ность установить степень выраженности обструкции, а также вариабельность ее и определить степень тяжести течения БА.
Наряду с этим фармакологические пробы с р2-агонистами и анализ изменения петли «объем—поток» или ПСВ позволяют также судить о наличии обратимой или необратимой обструкции. Фармакологическая проба с гистамином или метахолином в период ремиссии БА с проведением до и после нее пневмота- хографии или исследованием ПСВ дает возможность зарегистрировать степень выраженности гиперреактивности слизистой оболочки бронхиального дерева к воздействию различных триггеров, что имеет определенное значение при проведении экспертизы пациентов в случае длительной ремиссии Б А. Аналогичную реакцию можно получить при исследовании функциональных показателей внешнего дыхания до и после ступенчатой физической нагрузки при проведении велоэргометрии.
Объем форсированного выдоха за 1 с — весьма ценный функциональный показатель в динамике и при проведении различных фармакологических проб в сопоставлении с ФЖЕЛ. Уменьшение данного показателя ниже 75 % свидетельствует о выраженности обструктивных изменений, а существенное его увеличение на фоне фармакологической пробы с р2-агонистами подтверждает обратимый характер их.
Весьма удобным и наглядным функциональным показателем является анализ петли «поток—объем» при пневмотахографии, которая в отличие от ОФВ| позволяет дифференцировать уровень (крупные, средние, мелкие бронхи) обструктивных изменений дыхательных путей, поэтому, естественно, ценность ее при проведении фармакологических проб резко возрастает (рис. 5).
Особенно демонстративна кривая выдоха, которая при БА имеет вогнутый характер с непропорционально низкими объемными скоростями при анализе потока из мелких бронхов, тогда как петля вдоха не претерпевает существенных изменений. Если изменяются петли потока существенно на выдохе и вдохе, то обструкция часто захватывает и верхние отделы дыхательных путей.
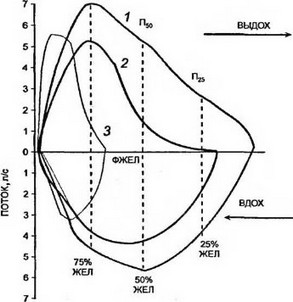
Рис. 5. Анализ петли «поток—объем» при пневмотахографии:
1 — петля—поток в норме; 2 — петля—поток (обструктивный тип); 3 — петля—поток (рестриктивный тип); П„ — максимальный поток— выдох; П75 — поток из кру"ных бронхиальных структур; — лоток из средних бронхиальных структур; П25 — поток из мелких бронхиальных структур
Пикфлоуметрия — метод измерения пиковой (максимальной) скорости выдоха (ПСВ), удобный портативный способ мо- ниторирования в течение суток с приведением показателей на специальном бланке. С помощью этого метода можно определить:
а) провоцирующее влияние профессиональных и непрофессиональных индукторов аллергии;
б) триггерное воздействие различных неспецифических факторов на течение БА;
в) вариабельность изменений ПСВ в течение суток по формуле:
ПСВМШ(С(л/мин) - ПСВМ11Н (л/мин)
ПСВсут(%) = 100;
ПСВ (л/мин)
|
|
|
|
|
|
Возраст, лет |
|
|
|
|
|
||
|
Рост |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
50 |
55 |
60 |
65 |
70 |
|
160 |
530 |
570 |
595 |
605 |
Мужчины 610 605 600 |
585 |
570 |
555 |
535 |
520 |
||
|
168 |
545 |
580 |
605 |
620 |
625 |
620 |
615 |
600 |
585 |
565 |
550 |
530 |
|
175 |
555 |
590 |
615 |
630 |
635 |
635 |
625 |
610 |
595 |
580 |
560 |
540 |
|
183 |
565 |
600 |
630 |
640 |
650 |
645 |
635 |
625 |
605 |
585 |
570 |
550 |
|
191 |
575 |
610 |
635 |
650 |
660 |
655 |
650 |
635 |
620 |
600 |
580 |
570 |
|
152 |
445 |
475 |
470 |
475 |
Женщины 475 470 |
460 |
445 |
435 |
425 |
410 |
395 |
|
|
160 |
455 |
480 |
485 |
490 |
485 |
480 |
470 |
455 |
445 |
430 |
420 |
405 |
|
168 |
465 |
485 |
495 |
500 |
500 |
490 |
480 |
465 |
455 |
440 |
425 |
415 |
|
175 |
475 |
495 |
505 |
510 |
505 |
500 |
490 |
475 |
465 |
450 |
435 |
425 |
г) объем (глюкокортикоиды в мкг) проводимой лекарственной терапии, т.е. управлять заболеванием, с одной стороны, а с другой — иметь возможность предупредить нарастающую обструкцию на этапах, когда клинически явное ухудшение состояния пациента еще нельзя идентифицировать.
Мониторирование ПСВ позволяет больному вовремя обратиться к врачу за корректировкой лечения или, приобретая соответствующие навыки в астма-школе, самому принять адекватное решение, не ожидая субъективного ухудшения состояния.
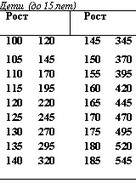
Приводим шкалу стандартных значений пиковой объемной скорости выдоха (табл. 21).
Мониторировать показатели ПСВ больной может после обучения по специальной программе, обеспечивающей адекватное представление больного о характере заболевания, что позволяет ему ориентироваться в изменении своего состояния и принимать правильное решение.
Пациента необходимо обучить принципам самонаблюдения: рекомендовать вести дневник и оценивать свое состояние по специальной шкале, правильно пользоваться методом пикфлоумет- рии (рис. 6,7).
Дифференциальный диагноз
Заключение врача о выраженности симптомов астмы, определение степени тяжести не означают окончательного установления тяжести заболевания. БА отличается, например, от хрони-
Рис. 7. Последовательность использования пикфлоуметра:
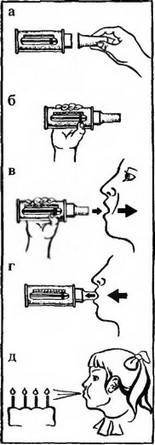 а — надеть мундилуковую головку на пикфлоуметр;
а — надеть мундилуковую головку на пикфлоуметр;
б — встать и держать пикфлоуметр горизонтально, убедиться, что бегунок неподвижен и находится в начале шкалы;
в—г глубоко вдохнуть, обхватить губами мундштук и выдохнуть как можно быстрее; отметить результат, дважды повторить стадии б—г, выбрать нанвысший результат, сравнить полученные данные с должными; д — детям объяснить, что выдохнуть нужно так, чтобы можно было погасить свечи на праздничном торте.
ческого бронхита (ХБ) большей вариабельностью течения, даже более полной обратимостью нарушенной бронхиальной проходимости при адекватной терапии. Поэтому прогноз течения БА значительно утяжеляется при наличии на фоне ее ХБ, поскольку обратимость обет ¦ руктивного синдрома в таких случаях менее вероятна. При сочетании БА и ХБ межприступ- ный период менее четкий по субъективным и объективным данным вследствие преобладания инфекционно-воспалительного процесса в бронхиальном дереве. Подобное течение БА на фоне ХБ чаще ассоциируется с понятием инфекционной (неатопической) астмы.
Эти различия ярко продемонстрированы В.И. Пыцким с со- авт. (1999) в таблице дифференциальной диагностики различных форм бронхиальной астмы.
Мы заимствовали клинико-патогенетические данные указанных авторов и адаптировали их с учетом клинико-патогенетических представлений (табл. 22) об аллергической и неаллергической БА.
Табл. 22. Диагностика и клинические проявления аллергической и неаллергической бронхиальной астмы
Наследственное
предрасположение
Аллергены
Аллергологический анамнез
Тип аллергической реакции
Аллергологическое тестирование Кожные пробы Общие IgE Специфические IgE
Начало заболевания
Патология носа и придаточных пазух
Бронхолегочные инфекции
Начало приступа
Межприступный период
Элиминация аллергена
Специфическая иммунотерапия
Тест с физической нагрузкой
Триггерные реакции
Угроза развития астматического статуса Менее вероятна
Низкое (10%)
Аллергологический анамнез неопределенный
Чаще после 30—40 лет
Г ипертрофический ринит, полипы в полости носа, хронический этмоидит
Часто хронический бронхит
Чаще постепенное, медленное обратное развитие
Хрипы сухие на фойе жесткого дыхания
Чаще положительный Более отчетливы
Весьма вероятна
При первичной диагностике БА нередко трудно дифференцировать неаллергическую БА и хронический бронхит или каш- левой вариант БА и трахеобронхиальную дискинезию, центральный рак легких, хронический бронхит.
При дифференциальной диагностике БА и ХБ необходимо принимать во внимание наличие характерных для этих двух заболеваний биологических маркеров (см. диагностика и классификация БА и ХБ).
При трахеобронхиальной дискинезии (ТБД) в отличие от БА отсутствует аллергологический анамнез, не наблюдается вариабельность показателей пикфлоуметрии при мониторировании их в течение суток (более 20—30 %).
Исследования В.П. Скибы (1994) показывают, что чаще всего для ТБД характерен приступообразный «лающий» кашель днем (в 90,9 % случаев) или в ночное время (в 18,1 % случаев); у 47,3 % больных кашель заканчивается затрудненным дыханием, переходящим в выраженные приступал уцушья (чаще на фоне физической нагрузки вследствие повышения экспираторного внут- ригрудного давления, усиливающего пролапс в просвет трахеи и крупных бронхов мембранозной стенки).
Весьма показательным исследованием при ТБД является запись форсированного выдоха с наличием отрицательных зубцов в виде провалов на отрезке, характеризующем «поток—объем» крупных бронхиальных структур.
Фибробронхоскопическая картина при ТБД весьма своеобразна. В зависимости от степени выраженности экспираторный пролапс мембранозной стенки дыхательных путей прослеживается на участке от 1/2 до 2/3 просвета трахеи и бронхов. У подобных больных при физической нагрузке наряду с приступообразным кашлем может возникать экспираторная одышка. При ТБД у певцов в процессе исполнения арии при появлении столь выраженного экспираторного пролапса на выдохе может внезапно обрываться мелодия или возникать пароксизмальный кашель вследствие выбухания мембранозной части задней стенки — сильного раздражения рецепторов вагуса (рефлексогенной каш- левой зоны) экспираторным коллапсом задней стенки трахеи и бронхов.
Следует отметить, что наличие спонтанного или приступообразного кашля возможно за счет набухания (отека) слизистой оболочки крупных бронхов, трахеи вследствие воспаления аллергического генеза или медленно нарастающего кашля — вследствие отека инфекционно-воспалительного генеза. Похожая ситуация может возникнуть в процессе дифференциальной диагностики этих состояний, которые на фоне лечения легко устраняются. Однако если кашлевая реакция не исчезает, необходимо
углубленное обследование больного с помощью фибробронхо- скопии для исключения новообразований с проведением гисто- морфологических исследований подозрительных участков слизистых оболочек на выявление метаплазии, анаплазии, гиперплазии.
Бронхиальная астма с ночными приступами удушья. При
дифференциальной диагностике не всегда удается принять однозначное решение у пациентов с проявлениями ночных приступов удушья или ночных пароксизмальных кашлевых реакций. Наряду с так называемой «ночной бронхиальной астмой» у подобных больных необходимо исключать гастроэзофагеальный рефлюкс с микроаспирацией желудочного содержимого, а также сердечную астму вследствие подострой (или острой) систолической недостаточности. Казалось бы, эти состояния принципиально отличаются друг от друга. Однако они могут создавать определенные трудности при установлении заключительного диагноза. Тем более, что наличие аллергологического анамнеза, сенсибилизация к экзоаллергенам с повышением содержания общих и специфических IgE, интерлейкинов (ИЛ-4, ИЛ-5, ИП-6) играют решающую роль в диагностике атопической БА (реаги- новый тип), тогда как при неаллергической (неатопической) БА эти критерии могут отсутствовать. В таких случаях приходится принимать во внимание широкий диапазон других клинико-ди- агностических маркеров.
Как отмечают С.Т. Холгейт (1997) и др., в случае атопической и неатопической БА при исследовании клеточного состава брон- хиолярно-альвеолярного лаважа, биопсии слизистой оболочки бронхиального дерева наряду с лимфоцитами повышено содержание тучных клеток и эозинофилов, продуктов экспрессии их — гистамина, триптазы, эйкозаноидов—просгагландина D2, цисте- нил-лейкотриенов, которые в конечном итоге посредством нейронных эффекторных механизмов провоцируют кашлевую и бронхоспастическую реакцию. Определенную значимость в диагностике БА имеет повышение в выдыхаемом воздухе содержания окиси азота (N0). Это новый интересный диагностический тест. N0 продуцируется многими клетками респираторного тракта и существенно возрастает в выдыхаемом воздухе вследствие активации клеток воспаления (С.А. Харитонов с соавт., 1997).
Таким образом, исходя из главного патогенетического аргумента о воспалении при БА, в настоящее время предложен ряд биологических маркеров воспаления, которые позволяют дифференцировать БА с другими состояниями, провоцирующими ночные приступы удушья. Однако этого недостаточно и требуется ряд дополнительных исследований. Приступы ночного кашля и удушья, связанные с рефлюкс-эзофагитом, микроаспираци
ей желудочного содержимого, слюны или слизеобразной массы при воспалении носоглотки, могут быть расшифрованы при углубленном обследовании рельефа слизистой оболочки носоглотки, исследовании желудочно-кишечного тракта.
Что касается заболеваний сердечно-сосудистой системы, связанных с первичным исходным наличием систолической недостаточности левого желудочка и наблюдаемыми эпизодами сердечной астмы, то должны исключаться:
- ИБС с атеросклеротическим или посгинфарктным склерозом миокарда;
—дилатационная миокардиопатия;
- перегрузка левых отделов сердца давлением (гипертензия, аортальный стеноз);
- диастолическая перегрузка объемом (недостаточность аортальных клапанов) и др.
При этом учитывается: отсутствие аллергического анамнеза, наличие инспираторной одышки при физической нагрузке, наличие тахикардии, концентрической, эксцентрической или асимметричной гипертрофии левых отделов сердца, снижение систо- шческого и пульсового давления, высокая эффективность при ночных приступах удушья не только р2-агонистов, но нитратов и другой патогенетической терапии, проводимой при сердечнососудистой патологии (применение гипотензивных средств при гипертензии).
Дифференциальная диагностика и диагностика профессиональной бронхиальной астмы. Развитие профессиональной бронхиальной астмы вследствие сенсибилизации рабочих к аллергенам в условиях производства зависит от многих обстоятельств (В.Г. Артамонова, В.Ф. Жданов, E.JI. Лашина, 1997) и может прогнозироваться при:
- предрасположении вследствие наследственной отягощен- ности и собственного аллергологического анамнеза;
- ингаляционном пути поступления аллергена, так как органы дыхания — наиболее чувствительная система в формировании аллергии;
- наличии сильных аллергенов 1-го класса опасности (урсол, бихромат, соли никеля, кобальта, фенилендиамин, аминазин, кормовые дрожжи и др.);
- периодическом превышении предельно допустимых концентраций гаптенов в воздушной среде, так как при первичной сенсибилизации имеет значение концентрация аллергена, при развитии же аллергии — приступы бронхиальной астмы провоцируются аллергенами в концентрации, значительно ниже предельно допустимой;
- сочетанном действии аллергенов с другими вредными фак
торами (неаллергенами), различными поллютантами (пылью, газообразными и масляными аэрозолями), оказывающими повреждающее действие на физиологические барьеры и способствующими тому, что даже слабые аллергены могут вызывать сенсибилизацию.
Существует три основных варианта формирования профессиональной бронхиальной астмы:
- аллергическая форма, возникающая первично без предшествующих аллергических поражений верхнего отдела дыхательного тракта, кожных покровов;
- аллергическая форма в сочетании с развившимися первично в местах наибольшего воздействия производственного аллергена профессиональным аллергическим дерматитом на открытых участках кожных покровов (кисти, кожные покровы шеи, лица), риноконъюнктивитом;
- аллергическая и неаллергическая—смешанная форма БА, развившаяся на фоне предшествующего хронического профессионального бронхита. В данной ситуации возможен вариант неаллергической БА.
Первые два варианта профессиональной бронхиальной астмы развиваются у работающих в контакте с аллергенами 1 -го и 2- го класса опасности. При этом наблюдается повышение аллергоспецифических IgE. Третий вариант профессиональной астмы (смешанная или эндогенная формы) выявляется у работающих в контакте с поллютантами, в составе которых имеются слабые или умеренные аллергены. Порог риска при этом может составлять 10—12 и более лет работы в контакте с аллергенами, концентрация которых превышает предельно допустимую.
Профессиональный аллергический анамнез — появление аллергических реакций на работе и исчезновение их вне ее — важный клинический и диагностический критерий заболевания.
Мониторинг показателей внешнего дыхания, в частности данных портативной пикфлоуметрии—до работы, во время и после нее, является весьма важным и часто решающим объективным тестом для профессионального аллергического анамнеза в диагностике БА.
Наряду с функциональным мониторингом показателей внешнего дыхания осуществляются по общепринятым диагностическим критериям скарификационные кожные тесты и внутрикож- ные аллергические пробы со стандартизованными профессиональными аллергенами.
Провокационные ингаляционные диагностические пробы с профессиональными агентами проводятся в тех случаях, когда отсутствует корреляция между данными аллергологического анамнеза, экспозиционных тестов и данными накожного тести
рования. Провокационный ингаляционный диагностический тест с профессиональными аллергенами осуществляется в предусмотренных и разрешенных концентрациях (не выше ПДК) в меж- приступном периоде в условиях стационара. При испытании неоактериальных аллергенов животного или растительного происхождения, содержащих 10 ООО PNU, готовят двукратные разведения (1:2,1:4, 1:8 и т.д. до 1:2048), для ингаляционных проб с химическими аллергенами—десятикратные разведения (1:100, 1:1 ООО и тд. до 1:100 000) химического соединения, если оно является жидкостью.
До проведения провокационного ингаляционного теста и через 30^—90 мин и 24 ч после него регистрируются аускультативные данные и функциональные показатели внешнего дыхания в виде мониторинга, а также проводится тест деструкции тучных клеток (ТДТК). Данные ТДТК через 24 ч после провокационной ингаляционной пробы с профессиональными аллергенами резко повышаются по сравнению с исходными (до пробы) вследствие индукции аллергоспецифических IgE при наличии сенсибилизации к производственному аллергену, с которым проводилась провокационная проба.
В настоящее время в диагностике профессиональной бронхиальной астмы используются реакции клеток крови на гаптен in vitro (реакция специфической агломерации лейкоцитов крови — РСАЛ, реакция специфического повреждения базофилов крови — РСПБ), серологические реакции с химическими аллергенами (реакция связывания комплемента — РСК, реакция пассивной гемагглютинации — РПГА), специфические клеточные реакции гиперчувствительност!: in vitro (реакция торможения прилипания клеток—РТПК, реакция специфического розетко- образования — РОК, реакция торможения миграции лейкоцитов крови — РТМЛ).
Источник: Н. А. Скепьян, «Аллергические болезни: дифференциальный диагноз, лечение» 2000