Острый инфаркт миокарда — заболевание, обусловленное возник
новением одного или нескольких участков ишемического некроза в сердечной мышце вследствие абсолютной или (реже) относительной недостаточности коронарного кровообращения [124].
История изучения инфаркта миокарда, а также достигнутые в пос- лед-ние годы успехи в исследовании патогенеза, разработке инструментальных и лабораторных методов диагностики, интенсивной терапии, медикаментозного и хирургического лечения больных инфарктом миокарда тесно связаны с именами отечественных ученых (К.Кнопф,1878; В.Н.Керниг,1892; В.П.Образцов и Н.Д.Стражеско,1909; А.Ф.Самой- лов,1910; Е.И.Чазов,1971,1992,1997; И.К.Шхвацабая,1975; М.Я.Руда и А.П.Зыско,1981; П.С.Акчурин,1992 и многих других). Однако, несмотря на прогресс в области диагностики и лечения острого инфаркта миокарда, это заболевание продолжает сохранять за собой печальное первенство в структуре смертности населения экономически развитых стран, в том числе и России.
Основным механизмом развития острого инфаркта миокарда в настоящее время считается разрыв атеросклеротической бляшки, часто даже при умеренном стенозе (менее 70%) коронарной артерии [9]. При этом обнажаются коллагенные волокна, происходит активация тромбоцитов, запускается каскад реакций свертывания, что приводит к острой тромботической окклюзии коронарной артерии [124]. Если восстановления перфузии не происходит, то развертывается ишемический некроз миокарда, дисфункция пораженного желудочка (в подавляющем большинстве случаев — левого), возникают нарушения ритма и проводимости сердца.
Тромботическая окклюзия коронарной артерии наблюдается примерно у 80-90% больных, она ведет к трансмуральному некрозу миокарда и появлению патологического зубца Q на ЭКГ. Инфаркт миокарда без патологических зубцов Q чаще всего возникает при спонтанном восстановлении перфузии или хорошо развитых коллатериях. В этих случаях размер некроза миокарда меньше, функция левого желудочка страдает не столь сильно, больничная летальность ниже. Однако, в связи с тем, что оставшийся жизнеспособный миокард кровоснабжается пораженной коронарной артерией, частота повторных инфарктов миокарда больше, чем в случаях с патологическими зубцами Q. Поэтому при инфаркте миокарда без патологических зубцов Q придерживаются более активной лечебно-диагностической тактики.
Около 15-20% больных острым инфарктом миокарда погибают на догоспитальном этапе, еще 15% — в больнице; общая летальность составляет 30-35%. В США от инфаркта миокарда ежедневно погибает 140 человек [9]. Большая часть больничной летальности приходится на первые двое суток, поэтому интенсивные лечебные мероприятия проводят именно в этот период.
Первое, с чем приходится сталкиваться врачу у постели больного острым инфарктом миокарда, — это с длительным болевым приступом, который необходимо быстро купировать не только потому, что любая боль требует успокоения, но и потому, что она может способствовать развитию шока. Сейчас медицина располагает большими возможностями в борьбе с болями, позволяющими ограничить, а в большинстве случаев исключить использование наркотических анальгетиков [9,124,125].
В настоящее время для лечения больных в остром периоде инфаркта миокарда применяются тромболитические препараты (стрептокиназа, проурокиназа и др.), антитромботические средства (гепарин, аспирин) и в-адреноблокаторы [9,127,129].
Тромболитическая терапия. Как отмечалось выше, основной непосредственной причиной развития инфаркта миокарда является тромби- рование одной из венечных артерий сердца. Поэтому становится понятным и первый принцип терапии тромбоза коронарных артерий - быстрая имитация противосвертывающей реакции путем введения гепарина и веществ, усиливающих фибринолитическую активность крови. При отсутствии противопоказаний к применению антикоагулянтов назначать гепарин и фибринолитические средства необходимо как можно раньше.
Наибольшее рпспространение получили 2 способа проведения тром- болитической терапии с использованием стрептокиназы (стрептазы): 1) внутривенное капельное введение 200-250 тысяч ЕД фермента в течение 30 минут, через 7,5 часов (при отсутствии побочных реакций) введение еще 750 тысяч ЕД стрептокиназы и через 6 часов начало гепари- нотерапии; 2) одновременное внутривенное введение стрептокиназы в дозе 750 тысяч ЕД и 10000 ЕД гепарина [124].
Данные, полученные в клинике, показывают, что эффект от тромбо- литической терапии при остром инфаркте миокарда наблюдается лишь в тех случаях, когда лечение начато не позднее 5-6 часов от начала заболевания, и эффект гораздо выше, если лечение начинается в первые 3-4 часа заболевания.
Среди побочных эффектов тромболизиса могут наблюдаться следующие: аллергические реакции, лихорадка, озноб, артериальная гипотония, геморрагии, инсульт, повторные тромбозы, эмболии фрагментами тромба, реперфузионные аритмии [9,124].
Повышение специфичности и эффективности тромболитиков было достигнуто созданием новых препаратов, в частности, ацилированного плазминоген-стрептокиназного активаторного комплекса, тканевого активатора плазминогена, проурокиназы, антистреплазы, алтеплазы.
Благодаря применению тромболической терапии у больных острым инфарктом миокарда внутрибольничную смертности удалось снизить с 25 до 6-8%. Терапевтическая эффективность этого метода лечения в зна
чительной мере ограничивается развитием ретромбоза (реокклюзии) ин- фарктсвязанной коронарной артерии, который после успешного тром- болизиса встречается примерно в 15-20% случаев [126]. Для предупреждения ретромбоза используются аспирин и гепарин.
Бета-адреноблокаторы в современной терапии инфаркта миокарда имеют важное значение при назначении их в ранние сроки заболевания в комбинации с тромболитическими средствами и аспирином [9,23,128,129].
Сомнения в эффективности в-адреноблокаторов у больных острым инфарктом миокарда окончательно рассеялись после оглашения результатов крупных рандомизированыых исследований.
В исследовании MIAMI (Metoprolol in Acute Myocardial Infarction) изучали эффекты метопролола в сравнении с плацебо у 5778 больных острым инфарктом миокарда. Метопролол применяли вначале внутривенно в дозе 15 мг, а затем внутрь по 200 мг/сут. За 15 дней наблюдения смертность в основной группе была на 13% ниже, чем в контрольной.
Ретроспективный анализ позволил выделить подгруппу больных с высоким риском (возраст старше 60 лет, изменения на ЭКГ, наличие в анамнезе стенокардии, артериальной гипертонии, сердечной недостаточности или сахарного диабета), в которой применение метопролола уменьшало смертность на 29%. В подгруппе больных острым инфарктом миокарда с наличием патологических зубцов Q на ЭКГ метопролол снижал смертность на 18,1% и несколько увеличивал ее в подгруппе больных без патологического зубца Q. Исследование было прекращено на 90-й день, общее снижение летальности среди больных, получивших метопролол составило 36% [127].
Таким образом, в исследовании MIAMI была обнаружена определенная зависимость эффективности в-адреноблокаторов в остром периоде инфаркта миокарда от наличия или отсутствия патологического зубца Q на ЭКГ. Развитию инфаркта миокарда с зубцом Q, как правило, предшествует подъем сегмента ST на ЭКГ, записанной в первые часы после возникновения болевого синдрома [124,125]. Поэтому в-адреноблока- торы рекомендуют назначать в первую очередь больным с клиническими симптомами острого инфаркта миокарда и подъемом сегмента ST не менее, чем на 1 мм, по меньшей мере, а двух стандартных отведениях ЭКГ [9,23].
В другом крупном исследовании ISIS-I (First International Study of Infarct Survival), включавшем 16027 больных острым инфарктом миокарда, оценивали эффективность атенолола (5-10 мг внутривенно, затем внутрь по 100 мг/сут). В первые сутки заболевания в группе больных, получавших атенолол, смертность была на 32% ниже, чем в контрольной группе. За
7 дней наблюдения отмечено уменьшение сердечно-сосудистой смерт
ности на 15% при использовании атенолола за счет уменьшения числа случаев разрыва сердца и первичной фибрилляции желудочков [130], а также повторных инфарктов миокарда и внутричерепных кровоизлияний после тромболизиса [9]. Таким образом, наиболее эффективным оказалось применение атенолола в первые сутки острого инфаркта миокарда.
По сводным данным контролируемых исследований, ранняя терапия p-адреноблокаторами больных острым инфарктом миокарда уменьшает общую летальность за 7 дней наблюдения на 14%, частоту реинфаркта — на 18% и частоту остановки сердца или фибрилляции желудочков — на 15%. Наибольшее снижение летальности (в среднем на 25%) наблюдается в первые двое суток заболевания, что еще раз указывает на необходимость как можно более раннего начала терапии р-адренобло- каторами у больных с подозрением на инфаркт миокарда [23,129,130].
В первые часы инфаркта миокарда p-адреноблокаторы рекомендуют вводить внутривенно струйно медленно, под контролем ЧСС, АД и ЭКГ, затем переходить на поддерживающую пероральную терапию. Бета-адреноблокаторы не назначают или их внутривенное введение прекращают, если ЧСС становится менее 50 уд/мин, систолическое АД — ниже 100 мм рт.ст., появляются признаки застойной сердечной недостаточности, интервал P-Q превышает 0,22 с или развивается атриовентрикулярная блокада II-III степени. Бета-адреноблокаторы противопоказаны больным бронхиальной астмой или тяжелым обструктивным бронхитом. Считается, что в остром периоде инфаркта миокарда Pj-селективные адреноблокаторы (метопролол, атенолол и др.) более безопасны, чем неселективные (пропранолол, тимолол и др.), так как они не увеличивают ОПСС при внутривенном введении, а значит, не повышают постнагрузку левого желудочка. Предполагают, что при наличии относительных противопоказаний к назначению р-адреноблокаторов может оказаться полезным применение препарата сверхкороткого действия эсмолола [23,128].
В исследовании TIMI (Thrombolysis in Myocardial Infarction) показано, что при сочетании метопролола и тканевого активатора плазмино- гена (алтеплазы) значительно увеличивается эффективность тромболи- ческой терапии инфаркта миокарда. Достоверное снижение общей частоты сердечных событий отмечено среди больных, которым р-адреноб- локатор и тромболитический препарат вводили в первые два часа после развития инфаркта миокарда [126].
Бета-адреноблокаторы являются весьма полезными в качестве средств вторичной профилактики после инфаркта миокарда [129]. По сводным данным контролируемых исследований, длительная терапия Р-адреноблокаторами приводит к уменьшению общей летальности в среднем на 22 %, внезапной смерти — на 32% и частоты нефатального
повторного инфаркта миокарда - на 27% за период наблюдения от 2 до 6 лет после инфаркта миокарда [9,23,128,129].
Антагонисты кальция всех трех групп, как свидетельствуют данные литературы по крайней мере не оказывают благоприятного влияния на течение острого инфаркта миокарда в первые недели заболевания [17,18,27]. В настоящее время перспектива использования дигидропи- ридиновых антагонистов кальция, в частности, нифедипина, в лечении и профилактике некоторых групп больных ИБС представляется весьма сомнительной [17].
На одной из кардиологических конференций (Давос, Кипр, 1995) настоящей сенсацией явились данные мета-анализа контролируемых исследований, представленные профессором C.Furberg (США). Он показал, что: а) у больных с нестабильной стенокардией и острым инфарктом мио-карда нифедипин приводит к увеличению смертности на 19% при приеме препарата в дозе 60 мг/сут и в 3 раза больше — в дозе 80 мг/ сут; б) нимодипин вызывает аритмогенный эффект и увеличивает частоту тяжелых геморрагических осложнений; в) дилтиазем у больных острым инфарктом миокарда увеличивает частоту геморрагических осложнений в 5 раз [17,36].
Таким образом, по современным представлениям, антагонисты кальция, как правило, не рекомендуется использовать в остром периоде инфаркта миокарда. И лишь в отдельных случаях ранней постинфарктной стенокардии у больных, перенесших острый инфаркт миокарда без рубца Q на ЭКГ, может быть оправданным применение дилтиазема [9,27].
Остается открытым вопрос о целесообразности использования ве- рапамила и дилтиазема в лечении наджелудочковых аритмий в остром периоде инфаркта миокарда. На наш взгляд, если возникшая тахиаритмия сопровождается существенными гемодинамическими нарушениями, то для ее купирования безопаснее применить электроимпульсную терапию, чем эмпирически подбирать эффективный и одновременно безопасный антиаритмический препарат.
Сернокислая магнезия, основным действующим началом которой являются ионы магния (единственного природного и физиологического антагониста кальция), привлекает сегодня внимание кардиологов всего мира универсальностью действия. В отличие от всей группы антагонистов кальция, которые по механизму действия являются блокаторами кальциевых каналов кардиомиоцитов, ионы магния конкурируют с ионами кальция на всех уровнях клетки: на мембране, в миоплазме, на сократительных элементах, в саркоплазматическом ретикулуме, в митохондриях. Ионы магния в жизнедеятельности кардиомиоцита отвечают за процессы его расслабления и выведения избыточного количества внутриклеточного кальция, перегрузка клетки которым может привести к ее гибели. Кроме того, первой реакцией клетки на ишемию яв
ляется потеря ею ионов магния [131].
Данные экспериментальных исследований указывают на то, что введение солей магния до, во время окклюзии коронарной артерии или в течение короткого времени после реперфузии может приводить к существенному (более, чем на 60%) уменьшению очага некроза в миокарде. Однако в случае введения препарата позднее, чем через 15-45 мин после реперфузии или длительной окклюзии коронарной артерии, когда в бассейне ее кровоснабжения не остается жизнеспособного миокарда, вмешательство перестает быть эффективным [132]. Предполагается, что магний способен уменьшать реперфузионное повреждение миокарда [133,134].
Поэтому высказывается мнение, что при остром инфаркте миокарда магний является эффективным только в случае начала его введения до реперфузии инфарктсвязанной артерии или в ближайшее время после нее [135].
В клинических исследованиях, в которых тромболитическая терапия не проводилась, наибольшая эффективность магния продемонстрирована при начале его введения в первые 4-7 ч после развития ангинозного приступа [136].
К настоящему времени накоплен достаточно большой опыт клинического применения сернокислой магнезии в остром периоде инфаркта миокарда [22,133-136]. Разработаны различные методики введения этого препарата: 1) интракоронарного — с целью профилактики репер- фузионных повреждений миокарда после реканализации инфарктсвя- занной артерии [133]; 2) внутривенного — для коррекции показателей центральной гемодинамики, свертывающей системы крови, для лечения и профилактики нарушений ритма сердца. В последнем случае применялась следующая методика лечения: 20 мл 25%-ного раствора сернокислой магнезии в 80 мл 5%-ного раствора глюкозы вводили внутривенно капельно за 30 мин. После повторного исследования больного продолжали капельное введение препарата в дозе 0,5-0,6 г/ч. Суточная доза магнезии не превышала 17,5 г. На 2-е и 3-е сутки больные получали по 40 мл (10 г) сернокислой магнезии внутривенно [133].
Несмотря на большое число проведенных исследований, дискуссия о целесообразности внутривенной инфузии солей магния в остром периоде инфаркта миокарда продолжается [18,22]. Полагают, что вмешательство может оказаться эффективным в случае раннего повышения содержания ионов магния в крови (до развития коронарной репрефузии) [135], когда можно ожидать продемонстрированного в эксперименте уменьшения реперфузионного повреждения миокарда [132,134]. Для проверки этой гипотезы в США проводится исследование MAGIC (Magnesium in Coronaries) [137].
Ингибиторы АПФ у больных ИБС предупреждают прогрессирующую
дилатацию левого желудочка. Кроме того, активация ренин-ангиотен- зиновой системы в первые несколько дней острого инфаркта миокарда может способствовать повышению ЧСС и ОПСС, снижению перфузии коронарных артерий, которые приводят к распространению очага некроза сердечной мышцы [138].
Однако до недавнего времени оставалось неясным, следует ли всем больным острым инфарктом миокарда немедленно назначить ингибитор АПФ, или такое лечение целесообразно начинать позднее только у больных группы риска, то есть с нарушенной функцией левого желудочка. Впервые на этот вопрос попытались ответить в исследовании CONSEN-SUS-II (Cooperative New Scandinavian Enalapril Survival Study), в котором у 6090 больных острым инфарктом миокарда эналаприл в первые часы вводили внутривенно (в виде эналаприлата), а затем назначали внутрь и наблюдали больных в течение 6 мес. Под влиянием эналап- рила частота прогрессирующей сердечной недостаточности снизилась, однако смертность достоверно не изменилась [139]. Кроме того, было установлено, что ингибиторы АПФ следует назначать в первые сутки острого инфаркта миокарда только больным с подъемом сегмента ST, который обычно предшествует формированию патологического зубца Q на ЭКГ, причем необходимо проявлять осторожность при внутривенном введении этих препаратов [138,140].
Сравнение результатов различных рандомизированных исследований показывает, что наибольшее снижение ранней смертности больных инфарктом миокарда под влиянием ингибиторов АПФ наблюдалось в тех исследованиях, в которых эти препараты назначали пациентам с явной или скрытой дисфункцией левого желудочка [140].
При стабильной гемодинамике ингибиторы АПФ можно назначать в первые сутки после развития острого инфаркта миокарда, однако в большинстве случаев терапию, по-видимому, безопаснее начинать в более поздние сроки — после стабилизации гемодинамики и инструментальной оценки функции левого желудочка. В исследовании AIRE (Acute Infarction Ramipril Efficacy), в котором терапию рамиприлом начинали на 3-10-й день острого инфаркта миокарда, отмечено значительное улучшение выживаемости больных даже при сравнительно позднем начале лечения [141]. Результаты исследований SAVE (Survival and Ventricular Enlargement Trial) также указывают на необязательность начала терапии ингибиторами АПФ в первые 48 ч после развития острого инфаркта миокарда [142].
В какие бы сроки острого инфаркта миокарда ни начиналась терапия ингибиторами АПФ, начальная их доза должна быть очень небольшой. Так, в контролируемых исследованиях начальная доза каптоприла при приеме внутрь составляла 6,25 мг. Через 2 ч при отсутствии головокружения и резкого снижения АД назначали 12,5 мг каптоприла. В даль
нейшем больные получали каптоприл по 12,5 мг 3 раза в день [22,142]. Начальные дозы других ингибиторов АПФ у больных острым инфарктом миокарда должны быть такими: квинаприл (аккупро) — 2,5 мг, лизи- ноприл (привинил) — 5 мг, эналаприл (ренитек) — 2,5 мг, зофеноприл — 7,5 мг [140].
Представители координационных групп и главные исследователи, которые принимали участие в крупных исследованиях ингибиторов АПФ (ISIS-4 [22], AIRE [141], SAVE [142] и др.) приняли общие рекомендации по применению ингибиторов АПФ при остром инфаркте миокарда [143]: 1) передний инфаркт миокарда у больных, не получавших тромболитической терапии; 2) больные с передним инфарктом миокарда с патологическими зубцами Q на ЭКГ; 3) повторный инфаркт миокарда; 4) факторы высокого риска смерти в постинфарктном периоде (женский пол, возраст старше 60 лет, артериальная гипертензия, сахарный диабет).
Таким образом, исследователи пришли к выводу, что ингибиторы АПФ при отсутствии противопоказаний можно назначать всем больным острым инфарктом миокарда уже в первые сутки заболевания. Если по данным эхокардиографии у пациента не развивается дисфункция левого желудочка, то через 4-6 нед лечение можно прекратить. В противном случае и тем более при наличии клинических проявлений сердечной недостаточности терапию ингибиторами АПФ следует продолжать в течение длительного времени (возможно, пожизненно).
Хирургическое лечение острого инфаркта миокарда.
Чрескожная транслюминальная коронарная ангиопластика (ЧТКА), произведенная в первые 3-4 ч от начала инфаркта миокарда, по некоторым данным, более эффективна, чем тромболитическая терапия, даже с использованием внутрикоронарного введения стрептокиназы [9,124,144].
В исследовании PAMI (Primary Angioplasty in Myocardial Infraction study) показано, что первичная ЧТКА уменьшает частоту повторных инфарктов миокарда и нарушений мозгового кровообращения после тром- болизиса, сокращает продолжительность пребывания больных в стационаре, снижает летальность в группе высокого риска [145], а также улучшает сократимость миокарда и увеличивает выживаемость больных при кардиогенном шоке до 50% [146], тогда как при медикаментозном лечении выживаемость таких больных не превышает 20% [9,125].
Однако большинство исследователей считает, что ЧТКА надо проводить тем больным острым инфарктом миокарда, у которых тромбо- литическая терапия оказалась неэффективной или недостаточно эффективной (а это 25-50% больных, которым она проводится), и тем больными, которым тромболитическая терапия противопоказана
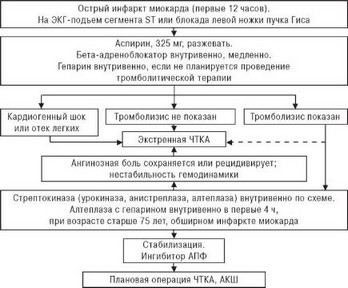
Рис. 6.7. Примерная схема обследования и лечения больных острым инфарктом миокарда.
[9,124,144,145].
Известно, что после восстановления проходимости коронарной артерии в ходе тромболитической терапии, как правило, сохраняется резидуальный стеноз высокой степени, при котором нередко имеются технические возможности проведения ЧТКА [124,126]. По данным ряда исследований, ЧТКА оказалась успешной у 77-78% больных острым инфарктом миокарда с тромботической окклюзией коронарной артерии в тех случаях, когда предшествующая тромболитическая терапия с помощь стрептокиназы или тканевого активатора плазминогена не оказала эффекта [124,145]. Несмотря на довольно высокую частоту реокклюзий после ЧТКА, все же считается целесообразным проведение этой процедуры при неуспешном тромболизисе.
Операции прямой реваскуляризации миокарда, в частности, АКШ, при развивающемся остром инфаркте миокарда не могут быть рекомендованы всем заболевшим. Это прежде всего связано с невозможностью
организации ранней реваскуляризации для всех больных. Во-вторых, летальность при таких операциях гораздо выше, чем при медикаментозном лечении и по разным данным составляет от 9 до 20% [147,148]. Тем не менее при идеальных условиях в ряде наблюдений удавалось с помощью операции АКШ значительно уменьшить зону некроза или даже предотвратить его развитие [147,149].
Основной задачей экстренной операции при инфаркте миокарда все же следует считать предотвращение и ликвидацию таких осложнений, как разрыв межжелудочковой перегородки, пролабирование створки митрального клапана как результат инфаркта сосочковой мышцы, а также некроз и перфорация стенки желудочка или предсердия с признаком тампонады сердца [147].
Перспективным направлением является выполнение операции АКШ после тромболитической терапии у больных острым инфарктом миокарда [149]. При этом дополнительная реваскуляризация в значительной мере будет способствовать улучшению сократимости ишемизированного миокарда и профилактике повторных инфарктов.
Период времени от начала острого инфаркта миокарда до момента хирургической реваскуляризации во многом определяет успех операции, оцениваемый как по состоянию метаболизма, регионарной и интегральной сократимости миокарда, так и по летальности, внутрибольничной и отдаленной [148,149]. Однако и поздняя хирургическая реваскуляри- зация может быть успешной вследствии того, что она: 1) обрывает течение болезни в случаях ее прогрессирования; 2) предупреждает ретромбозы и повторные инфаркты после успешного тромболизиса; 3) улучшает кровоснабжение других зон миокарда при одновременном много- браншевом шунтировании.
В заключение надо заметить, что диагностическая и лечебная тактика при остром инфаркте миокарда в течение последних десятилетий претерпела значительные изменения (рис 6.7). В настоящее время с помощью ряда инвазивных и неинвазивных методов исследования можно выделить больных, относящихся к группе высокого риска, а активное применение методов восстановления перфузии сердечной мышцы позволило улучшить результаты лечения этого тяжелого заболевания.
Ремоделирование левого желудочка.
Утрата части сократительного миокарда вследствие инфаркта, повторяющихся эпизодов ишемии, а также хроническая перегрузка сердца объемом или давлением сопровождаются комплексом структурных изменений, включающих как поврежденные, так и неповрежденные участки миокарда [150]. Эти изменения в структуре и геометрии камер сердца, именуемые "ремоделированием сердца" [151], часто предшествуют клиническому проявлению сердечной недостаточности, могут самостоятельно усугублять систолическую и диастолическую дисфункцию же
лудочков и отрицательно влиять на качество жизни и выживаемость больных [152]. В более широком понимании ремоделирование сердца означает процесс комплексного нарушения структуры и функции сердца в ответ на повреждающую перегрузку или утрату части функционирующего мио-карда. Процесс ремоделирования сердца а первую очередь включает прогрессирующее увеличение массы миокарда, дилата- цию полостей, а также изменение геометрических характеристик желудочков [151,153]. Другими словами, под ремоделированием сердца сейчас понимают процесс прогрессирующего нарушения структуры и функции сердца, включающий гипертрофию и фиброз миокарда, а также дилатацию и изменение геометрии полостей, ведущий к появлению и развитию синдрома хронической сердечной недостаточности [154].
Процесс раннего ремоделирования левого желудочка при остром инфаркте миокарда включает нарушение топографии как пораженных, так и непораженных областей [151]. В пораженной области распространение инфаркта с региональным его расширением и истончением некротической зоны наблюдается в первые 24 ч от начала заболевания [151,154,155]. Причем дилатация левого желудочка в остром периоде инфаркта миокарда может быть отнесена к компенсаторному механизму, поддерживающему конечный систолический объем левого желудочка и возникающему при поражении более 20% сердечной мышцы [154].
Распространение зоны некроза наблюдается у 59% с передним трансмуральным инфарктом миокарда в 1-е сутки заболевания и сопряжено с более выраженными нарушениями геометрии переднебазальной области левого желудочка.
Ранние изменения объема и геометрии левого желудочка имеют важное прогностическое значение для больных острым инфарктом миокарда. Показано, что относительно небольшое увеличение КДО и КСО левого желудочка после инфаркта миокарда в 4-5 раз увеличивает риск смерти. Причем величина КСО левого желудочка спустя 1 мес после инфаркта миокарда является самым строгим предиктором выживаемости больных, превышающим прогностическое значение фракции выброса [156].
При позднем постинфарктном ремоделировании в процесс вовлекается преимущественно оставшийся непораженным сократительный миокард. При мелкоочаговых и трансмуральных инфарктах функция и геометрия желудочка могут вернуться к своим нормальным характеристикам в фазе восстановления, тогда как при обширных некрозах миокарда наблюдается прогрессирующее ремоделирование с дополнительным увеличением объема и дальнейшим расстройством геометрии левого желудочка [151,153,155]. Прогрессирующее нарушение динамического изменения конфигурации левого желудочка ухудшает его диастолическое наполнение, которое становится более зависимым от растя
жения и активного расслабления кардиомиоцитов [157]. Эти нарушения систолической и диастолической функций сердца, связанные с изменением формы и геометрии левого желудочка, могут способствовать развитию застойной сердечной недостаточности [153,154].
В последние годы завершились несколько перспективных рандомизированных исследований (AIRE [141], SAVE [142], SOLVD [150], SMILE [158]), в которых убедительно показано, что процесс ремоделирования левого желудочка после инфаркта миокарда может продолжаться медленно, но прогрессировать на протяжении длительного времени без дополнительных эпизодов ишемии, и что раннее использование ингибиторов АПФ может благоприятно влиять на процессы ремоделирования серд-ца, качество жизни пациентов и прогноз заболевания.
В исследовании SAVE раннее применение каптоприла у больных с ост-рым инфарктом миокарда предотвращало возникновение структурно-геометрических изменений левого желудочка и развитие недостаточности кровообращения. Тормозящее влияние эналаприла на ремоделирование левого желудочка у больных с уже имеющейся сердечной недостаточностью продемонстрировано в исследовании SOLVD. Имеются сообщения об аналогичных эффектах и других препаратов из группы ингибиторов АПФ (рамиприл, зофеноприл) [141,158].
Крайне важным является то, что положительное воздействие на процессы ремоделирования левого желудочка может трансформироваться в улучшение прогноза больных с хронической недостаточностью кровообращения. Именно с положительным влиянием ингибитора АПФ каптоприла на процессы ремоделирования левого желудочка связывают улучшение выживаемости больных, перенесших инфаркт миокарда [142,151].
При сравнении эффекта 3-месячного лечения больных с недостаточностью кровообращения ингибитором АПФ эналаприлом и сердечным гликозидом дигоксином четко выявлены преимущества ингибитора АПФ. Показано, что эналаприл не только улучшает клиническое состояние больных, но и блокирует процессы ремоделирования левого желудочка, восстанавливая его адаптационный характер, и стабилизирует структурно-гемодинамические показатели сердца. Дигоксин не может считаться средством выбора в лечении данной категории больных, так как при минимальном влиянии на клинические показатели он не улучшает структурно-функциональных характеристик сердца [159].
При проведении дальнейших исследований в области лечения больных, перенесших инфаркт миокарда, должна учитываться динамика ремоделирования левого желудочка как один из ключевых факторов развития, течения и прогрессирования застойной сердечной недостаточности.
Сердечная недостаточность.
В основе сердечной недостаточности лежит дисфункция миокарда, которая вызывает снижение сердечного выброса. При этом включается ряд компенсаторных механизмов, таких, как активация ренин-ангио- тензин-альдостероновой системы и симпатической нервной системы, направленная на поддержание нарушенной функции сердечной мышцы, но вместе с тем влияющая на другие органы и системы организма и приводящая к повышению ОПСС и задержке жидкости.
Сердечную недостаточность определяют по-разному, однако ни одно из предложенных толкований не является вполне адекватным.
В некоторых определениях выделяется основное нарушение при этом синдроме: "Это состояние, при котором сердце неспособно обеспечить кровообращения, необходимого для удовлетворения потребностей организма" [160]. Другие определения основываются на том, что сердечная недостаточность — это заболевание, при котором нарушаются функция не только сердечно-сосудистой системы, но и других органов и систем [161] или "Это патологическое состояние, при котором дисфункция миокарда приводит к неспособности сердца перекачивать кровь со скоростью, необходимой для удовлетворения метаболических потребностей тканей, или же эти потребности обеспечиваются только за счет повы-
Таблица 6.9
Классификация сердечной недостаточности и функционального состояния кардиологических больных Нью-Йоркской ассоциации сердца (NYHA) [168].
|
Функциональный Определение класс |
Терминология |
|
|
I класс |
Заболевания сердца, не ограничивающие физической активности больных; обычная нагрузка не вызывает повышенной утомляемости, тахикардии, одышки или приступа стенокардии |
Бессимптомная дисфункция левого желудочка |
|
II класс |
Заболевания сердца, которые приводят к умеренному ограничению физической активности; обычная нагрузка вызывает утомляемость, тахикардию или приступ стенокардии; в покое комфорт сохранен |
Легкая сердечная недостаточность |
|
III класс |
Заболевания сердца, при которых значительно ограничена физическая активность; умеренная нагрузка вызывает утомляемость, тахикардию, одышку, приступ стенокардии |
Сердечная недостаточность средней степени тяжести |
|
IV класс |
Заболевания сердца, лишающие больных возможности выполнять какую-либо физическую нагрузку без чувства дискомфорта; симптомы сердечной недостаточности или ангинозная боль могут быть и в покое; любая нагрузка усиливает дискомфорт |
Тяжелая сердечная недостаточность |
шения давления наполнения желудочков" [162]. И, наконец, под недостаточностью кровообращения понимается неспособность сердечно-сосудистой системы обеспечить организм достаточным количеством крови в покое и при физической нагрузке [163].
Традиционно синдром сердечной недостаточности рассматривается как комплекс функциональных расстройств, связанных с нарушением насосной функции желудочков. Лишь на поздних стадиях хронической сердечной недостаточности начинает играть роль и фактор органических изменений сердца, легких, почек, печени [161,163]. Разграничение дисфункции желудочков на систолическую и диастолическую подчеркивает функциональные расстройства процесса сокращения и расслабления миокарда [157,164]. Однако функция левого желудочка тесно связана с его структурой.
Возникновение дисфункции левого желудочка сопровождается включением комплекса компенсаторных механизмов как срочных, так и долговременных, направленных на поддержание насосной функции сердца и сердечного выброса. Срочные компенсаторные механизмы включают активацию механизма Франка-Старлинга, а также повышение хроно- и ино-тропной активности миокарда в ответ на активацию симпатико-адреналовой системы [151,162,163].
Длительное повреждающее воздействие патогенных факторов на миокард ограничивает значение срочных компенсаторных механизмов и способствует установлению длительных компенсаторных механизмов, включающих увеличение объема и массы миокарда левого желудочка, которые наряду с изменением геометрии камеры составляют описанный выше процесс ремоделирования левого желудочка. Поэтому в исследованиях последних лет систолическую дисфункцию, выражающуюся в снижении сократимости миокарда, предлагают рассматривать как следствие структурного изменения желудочков, в первую очередь, их дилатации [153,163,165].
Дилатация полости является ранним ответом желудочков на повреждающие воздействия и преследует своей целью сохранение нормального ударного объема за счет увеличения КДО расширенного левого желудочка. Это структурное нарушение, скорее всего, представляет собой собственно морфологическое изменение желудочка, которое со временем прогрессирует в ответ на действующий этиологический фактор (эпизоды ишемии, некроз или фиброз миокарда) [153,155,165].
В нашей стране принята классификация недостаточности кровообращения, предложенная Н.Д.Стражеско, В.Х.Василенко и Г.Ф.Лангом и утвержденная на XII Всесоюзном съезде терапевтов в 1935 г. В ней выделяют острую и хроническую недостаточность кровообращения [163], и эта классификация до наших дней сохраняет свое клиническое значение.
Ф.И.Комаров и Л.И.Ольбинская предложили классификацию начальной стадии сердечной недостаточности, в которой на основании анализа и математического сопоставления показателей инотропной функции миокарда, объемов полостей сердца, системной и легочной гемодинамики и физической работоспособнос
