Лечебные мероприятия при стенокардии включают изменение образа жизни, устранение факторов риска ИБС или противодействие им, назначение медикаментозных препаратов или хирургическое лечение.
Изменение образа жизни. Врач должен правильно информировать больного о сущности ИБС, объяснить, почему возникают приступы стенокардии, и как их предупредить ситуационным приемом антиангиналь- ных препаратов короткого действия. Следует разъяснить больному, каких результатов можно ожидать от назначенных лекарственных препаратов, как правильно их принимать.
Следует обратить внимание на факторы риска, имеющиеся у больного, и настоятельно убедить его в необходимости и возможности их устранения. Кроме того, полезны дозированные динамические физические тре
нировки, уровень которых определяется функциональным классом стенокардии.
К важнейшим общим мероприятиям относится назначение низкокалорийной диеты, направленной на устранение ожирения, нередко сопутствующего ИБС. Здесь же надо особенно подчеркнуть необходимость коррекции имеющихся у больного нарушений липидного обмена с помощью средств и методов, описанных в предыдущей главе, причем уровень ХС-ЛПНП не должен превышать 100 мг/дл (2,6 ммоль/л), независимо от уровня общего холестерина в крови. Соответствующие диетические ограничения назначаются при сопутствующей артериальной гипертонии (поваренная соль), явных и латентных нарушениях углеводного обмена (простые углеводы).
Курение является одним из самых опасных факторов риска ИБС, поэтому врач должен приложить максимум усилий, чтобы помочь больному преодолеть эту привычку [10].
Применение антиангинальных препаратов.
Основой лечения стабильной стенокардии являются антиангиналь- ные средства, действие которых в основном объясняется уменьшением потребности миокарда в кислороде за счет снижения пред- и постнагрузки сердца или уменьшения его инотропной активности.
Эти препараты можно разделить на три группы: 1) нитраты и нитратоподобные средства; 2) бета-адреноблокаторы и антиадренергические препараты; 3) антагонисты кальция (блокаторы кальциевых каналов).
Для назначения антиангинальных средств и, особенно, контроля эффективности лечения используют пробу с физической нагрузкой (на велоэргометре, тредмиле) и суточное амбулаторное мониторирование ЭКГ В последние годы этим двум методам придают особое значение, учитывая появление большого числа сообщений о высокой частоте бессимптомной (безболевой) ишемии миокарда и ее неблагоприятной прогностической роли [11]. Антиангинальная терапия, уменьшая число приступов стенокардии, далеко не всегда одновременно приводит к уменьшению числа эпизодов безболевой ишемии миокарда, которые могут быть зарегистрированы при Холтеровском мониторировании.
Нитраты являются средствами первого ряда как для купирования приступов стенокардии, так и для их профилактики; механизм действия нитратов подробно описан в литературе [10,12,13] и сводится к следующим влияниям на сердечно-сосудистую систему.
- Физиологическая стимуляция эндотелийзависимого релаксирую- щего фактора при дисфункции эндотелия вследствие атеросклероза.
- Снижение интрамиокардиального напряжения в результате уменьшения пред- и постнагрузки.
- Снижение сопротивления коронарных артерий, особенно, при динамических стенозах с эксцентрической бляшкой.
- Улучшение регионарного кровоснабжения ишемизированного миокарда путем увеличения ретроградного кровотока.
- Снижение преднагрузки (улучшение геометрии левого желудочка) и постнагрузки (снижение импеданса выброса) понижает потребность миокарда в кислороде.
- Эффекты торможения агрегации тромбоцитов.
С целью предупреждения приступов используют пролонгированные формы нитроглицерина (сустак, нитронг), изосорбида динитрат (нит- росорбид, кардикет), изосорбида-5-мононитрат (эфокс, изомонат). Послед-ний является наиболее активным метаболитом изосорбида динитрата [12].
Главным недостатком пролонгированных форм нитроглицерина является низкая биодоступность, связанная с биотрансформацией препарата при его первом прохождении через печень. В связи с этим даже при приеме таблеток-форте концентрация нитроглицерина в крови находится на нижней границе терапевтического уровня или не достигает его. Использование таблеток-мите вообще нецесообразно, так как по эффективности они не отличаются от плацебо [14].
В последние годы в лечебной практике широко применяется мазь нитроглицерина. Нанесение мази, содержащей 15-20 мг нитроглицерина, на кожу обеспечивает интенсивное и равномерное всасывание препарата, необходимую концентрацию нитроглицерина в крови, которая достигается в пределах 1 ч после аппликации, обычно на кожу предплечья, живота, грудной клетки. Антиангинальный эффект нитроглицериновой мази сохраняется от 3-4 до 8 ч.
В США и Западной Европе популярны более удобные лекарственные формы для чрескожного введения нитроглицерина, так называемые "трансдермальные терапевтические системы", в виде пластырей и дисков, представляющих собой матрицы, импрегнированные нитроглицерином (депонит, нитродерм, ниродиск), обеспечивающих замедленное поступление препарата в кровь через кожу в течение длительного времени (до 24 ч). Эти формы имеют преимущества перед таблетками и капсулами, однако их достоинства не следует преувеличивать (нестабильная биодоступность, местные побочные реакции, более высокая стоимость).
К настоящему времени оптимальным для лечения стенокардии считают применение изосорбида динитрата и изосорбида-5-мононитрата (последний обладает практически полной биодоступностью) в виде форм средней, до 12 ч, продолжительности действия [14].
Следует иметь в виду, что нитраты противопоказаны больным с закрытоугольной формой глаукомы, повышением внутричерепного давления, инсультом [10].
Помимо побочных эффектов, связанных с избыточной вазодилата-
цией, основной проблемой при лечении нитратами является развитие толерантности (привыкания), возможными причинами которой считают активацию нейрогормональных факторов, увеличение внутрисосу- дистого объема жидкости, истощение внутриклеточных запасов сульф- гидрильных кофакторов (цистеина), необходимых для превращения нитроглицерина в оксид азота (NO) или S-нитрозотиолы [15,16].
Вместе с тем механизм развития толерантности к нитратам является сложным, и ни одна из предложенных гипотез не позволяет полностью объяснить причины развития толерантности к нитратам и обосновать подходы к ее предупреждению или устранению. В качестве мер предупреждения развития привыкания к нитратам предлагаются следующие способы.
- Увеличение дозы препарата, что, как правило, дает временный эффект, так как высока вероятность развития толерантности и к увеличенной дозе препарата.
- Обеспечение прерывистого приема нитратов в течение суток, с тем чтобы свободный период от поступления препарата в кровь составлял 10-12 ч [14].
- Чередование в течение суток приема нитрата (например, изосор- бида динитрата) и антагониста кальция (например, нифедипина). Такая схема может быть обоснована и тем, что действие нитратов частично обусловлено опосредованным их влиянием на баланс ионов кальция в миоцитах сосудистой стенки [17].
- Добавление аскорбиновой кислоты (витамина С-ретард в дозе 1,0 г 3 раза в сутки) предупреждает прогрессирование повышения активности тромбоцитов, отмечаемого во время развития толерантности к нитратам при их непрерывном приеме [16,18].
- Применение так называемых корректоров вместе с нитратами, особенно при появлении признаков развития толерантности к нитратам. Такими корректорами, в частности, могут быть, донаторы SH-групп (метионин, N-ацетилцистеин), ингибиторы ангиотензинпревращающего фермента (каптоприл), диуретики (фуросемид), гидралазин [17,18].
В заключение надо указать, что при исследовании нитратов на клеточной культуре они не влияли на пролиферативную активность клеток и практически не изменяли содержания внутриклеточного холестерина [19], то есть нитраты не обладают антиатерогенным и антиатеросклеротическим эффектами.
Близкими к нитратам гемодинамическими свойствами обладают препараты из группы сиднониминов, в частности, молсидомин (корватон, сиднофарм). Действуя на периферические сосуды, он уменьшает нагрузку на сердце, не оказывая прямого влияния на коронарные артерии [10].
Очень существенно то, что молсидомин, как и нитраты, является аналогом эндотелийзависимого релаксирующего фактора, то есть, факти
чески, эти препараты через различные механизмы продуцируют NO, обладающий выраженным сосудорасширяющим эффектом [20].
В отличие от нитратов, к которым может развиваться толерантность, связанная с окислением сульфгидрильных групп нитратных рецепторов и снижением образования цГМФ внутри клетки [12,16,17], действие активных метаболитов молсидомина на гладкомышечные клетки не уменьшается в зависимости от времени экспозиции, так как они стимулируют гуанилатциклазу прямо, а нитраты опосредуют свое действие через S-нитрозотиол с участием сульфигидрильных групп и цистеина [18,20].
После однократного приема внутрь 2 мг молсидомина (1 таблетка) действие препарата начинается через 20 мин и продолжается около 6 ч. При сублингвальном приеме эффект наступает еще быстрее. Препарат назначают по 2 мг 2-4 раза в сутки в зависимости от тяжести стенокардии [10].
Следует соблюдать осторожность в назначении молсидомина (корвато- на) при исходной гипотензии, склонности к кровоточивости, геморрагическом инсульте, а также беременным в III триместре [21]. Кроме того, для молсидомина, как и для нитратов, характерна индивидуальная невосприимчивость (рефрактерность), в этом случае увеличение дозы не усилит эффекта.
Бета-адреноблокаторы и антиадренергические средства уже более 30 лет с успехом используются при лечении больных ИБС. Эти препараты, уменьшая адренергические влияния на сердце, снижают ЧСС, систолическое АД, реакции сердечно-сосудистой системы на физическую нагрузку и эмоциональный стресс, благодаря чему уменьшается потребность миокарда в кислороде, и устраняется дисбаланс между запросами миокарда и возможностями доставки кислорода к ишемизированной зоне.
Бета-адреноблокаторы подразделяют на кардиоселективные, действующие преимущественно на сердечные Pj-рецепторы, и некардио- селективные, которые влияют как на Pj-рецепторы, так и на Р2-рецеп- торы, находящиеся в бронхах и периферических артериях. Кроме того, эти лекарства разделяются также в зависимости от способности проявлять собственную симпатомиметическую активность. Препарат с таким свойством, обладая высоким сродством к рецептору, незначительно стимулирует, но зато и полностью блокирует его, и уже никакие другие симпатические влияния не могут взаимодействовать с рецептором [10,13].
Выраженность антиангинального эффекта бета-адреноблокаторов не находится в прямой зависимости от кардиоселективности, симпатомиме- тической активности и мембраностабилизирующих (хинидиноподобных) свойств, а определяется дозой и особенностями фармакокинетики препарата [10,14].
Бета-адреноблокаторы не только обладают высокой антиангиналь- ной активностью, но и дают целый ряд других благоприятных эффектов, прежде всего — противоаритмический и антигипертензивный. Вдобавок, бета-адреноблокаторы являются эффективными средствами вторичной профилактики инфаркта миокарда, в то время как нитраты не влияют на прогноз больных, перенесших инфаркт миокарда ( в связи с этим распространенная практика длительного применения нитратов в постинфарктном периоде при отсутствии стенокардии или инструментальных признаков ишемии миокарда не имеет большого смысла) [22].
К сожалению, практические врачи недооценивают положительные свойства бета-адреноблокаторов и преувеличивают риск побочных эффектов, часто используя эти препараты в неадекватных дозах. Необходимо учитывать, что урежение ЧСС на фоне приема бета-адреноблокаторов свидетельствует о наличии эффекта и в большинстве случаев не должно служить поводом для их отмены, естественно, при отсутствии выраженной брадикардии.
Основной препарат этой группы — пропранолол, разработанный в 1964 г., не утратил своего значения и до сих пор успешно применяется в клинической практике. Причем у большинства больных нет особых оснований для его замены бета-адреноблокаторами, обладающими кардиоселективностью, собственной симпатомиметической активностью или вазодилатирующими свойствами. Правда, важным достоинством некоторых новых бета-адреноблокаторов (надолол, атенолол и др.) является длительность действия, позволяющая назначать их 1-2 раза в сутки [14].
Лечение бета-адреноблокаторами предусматривает подбор эффективной дозы индивидуально для каждого больного. Лечение начинают с минимальных доз, которые ступенчато повышают до достижения ге- модинамического и клинического эффекта. Подобранную дозу назначают длительное время с целью поддерживающей терапии. Важно, что, в отличие от нитратов, при длительном приеме бета-адреноблокаторов к ним не развивается привыкание. Однако надо заметить, что при внезапном прекращении длительного лечения бета-адреноблокаторами в больших дозах у больных возможны учащение приступов стенокардии напряжения, появление стенокардии покоя и даже развитие инфаркта миокарда.
Общепризнанные противопоказания к назначению бета-адренобло- каторов следующие: 1) застойная сердечная недостаточность, не компенсируемая сердечными гликозидами и диуретиками (для некоторых кардиоселективных бета-адреноблокаторов эта позиция сейчас пересматривается); 2) бронхиальная астма и тяжелая обструктивная дыхательная недостаточность; 3) брадикардия при ЧСС ниже 50 в мин; 4) артериальная гипотония (систолическое АД 100 мм рт.ст. и ниже); 5)
синдром слабости синусового узла; 6) атриовентрикулярная блокада II и III степени.
Относительными противопоказаниями являются : 1) перемежающаяся хромота и синдром Рейно; 2) инсулинзависимый сахарный диабет;
- язвенная болезнь желудка и 12-перстной кишки в фазе обострения [10].
Существенный недостаток бета-адреноблокаторов, в особенности, некардиоселективных, состоит в том, что они оказывают неблагоприятное влияние на плазменные уровни липидов и липопротеинов, повышая концентрацию триглицеридов и снижая уровень антиатерогенного ХС-ЛПВП. С появлением новых бета-адреноблокаторов значительно расширились возможности их использования при лечении больных ИБС в сочетании с гиперлипидемией. Так, в отличие от традиционных препаратов этой группы, пиндолол и лабеталол не вызывают существенных сдвигов в липидном составе крови, а новые бета-адреноблокаторы, такие, как краведилол и целипролол, улучшают его, снижая содержание триглицеридов и повышая уровень ХС-ЛПВП [23].
В экспериментах in vitro было изучено влияние бета-адреноблокато- ров и нитратов на антиатерогенные эффекты антагонистов кальция. С одной стороны, метопролол и нитроглицерин, добавленные в культуру атеро-склеротических клеток одновременно с нифедипином, не снижали антиатерогенного эффекта антагониста кальция, а с другой — в комбинации с нитратом или антагонистом кальция метопролол полностью утрачивал свои атерогенные свойства [19]. Этот факт позволяет надеяться, что путем создания фиксированной комбинации бета-адреноблока- тора с агентом, устраняющим его атерогенность, можно будет получить бета-адреноблокатор, лишенный побочных атерогенных эффектов. Это особенно важно в связи с тем, что один из новых препаратов этой группы метопролол (уже показавший свою клиническую эффективность при лечении стабильной и нестабильной стенокардии, инфаркта миокарда, артериальной гипертонии и сердечной недостаточности [24]) по данным эксперимента in vivo, обладает прямым антиатеросклеротическим эффектом путем ингибирования атерогенных реакций, контролируемых Pj- адренорецепторами, вследствие чего под влиянием метопролола увели1- чивается биосинтез простациклина и уменьшается отложение тромбоцитов на интиме артерий [25].
Амиодарон (кордарон) обладает сложным механизмом действия. Одним из ведущих компонентов является торможение (но не блокада!) реакции а- и Р-рецепторов на симпатическую стимуляцию.
Амиодарон снижает потребление кислорода миокардом за счет разгрузки сердца вследствие сосудорасширяющего эффекта, уменьшения чСс и снижения периферического сосудистого сопротивления. Основное свойство препарата — антиаритмический эффект.
В связи с медленным действием кордарона, кумуляцией в тканях и побочными явлениями дозирование следует проводить в две фазы. В период насыщения (1-2 нед) препарат назначают по 400-600 мг/сут, при тяжелой стенокардии, аритмиях дозу можно повысить до 1200 мг/сут. При появлении признаков передозировки, на что указывает развитие бради- кардии, дозу препарата необходимо уменьшить. В период поддерживающей терапии кордарон назначают по 200-400 мг/сут в течение 5 дней недели. Как и бета-адреноблокаторы, кордарон хорошо сочетается с нитратами [10].
Антагонисты кальция (или антагонисты, ингибиторы, блокаторы кальциевых каналов), как лекарственные средства, имея хорошую переносимость, обладают широким спектром фармакологических эффектов: антиангинальным, антиишемическим, антигипертензивным, анти- аритмическим, антиспастическим, антитромботическим, антиатероген- ным, цитопротекторным и другими свойствами [10,26,27].
Для лучшего понимания механизмов действия антагонистов кальция необходимо рассмотреть физиологическое значение кальция, точнее, его ионизированной формы (Са++).
Наиболее важная роль ионов кальция как внутриклеточных регуляторов заключается в том, что они обеспечивают связь между электрическими и механическими процессами (электромеханическое сопряжение) в миокарде, скелетной мускулатуре и гладкомышечных клетках. По существу, пусковым механизмом (триггером) эффекторных процессов в клетках являются не сами ионы кальция, а изменение их концентрации в цито-плазме и саркоплазматическом ретикулуме.
Основная часть внеклеточных ионов кальция проникает через мембрану кардиомиоцитов и гладкомышечных клеток по специализированным кальциевым каналам, которые открываются при частичной деполяризации клеточных мембран, то есть во время потенциала действия. Поэтому эти кальциевые каналы относят к группе потенциал-зависи- мых каналов. В мембранах кардиомиоцитов имеются также потенциалзависимые натриевые и калиевые каналы. По кальциевым каналам перенос электрического заряда происходит с меньшей скоростью, чем по натриевым каналам. В связи с чем существует понятие о медленных кальциевых и быстрых натриевых каналах [28].
Потенциал-зависимые кальциевые каналы следует отличать от ре- цептор-зависимых (управляемых) кальциевых каналов, которые обнаружены в мембранах гладкомышечных клеток сосудистой стенки и не обнаружены в кардиомиоцитах, где основным путем проникновения Са++ в клетку являются потенциал-зависимые (медленные) кальциевые каналы [27,28].
До недавнего времени различали три типа потенциал-зависимых кальциевых каналов: L (long acting) — длительно действующие; Т
(transient) — преходящие; N (neuronal) — нейронные. Каналы L- и T- типов впервые были обнаружены в сердечной мышце и гладкой мускулатуре сосудов, а каналы N-типа в мембранах нейронов [29].
В дальнейших исследованиях были выявлены различия среди каналов L-типа в мышечных клетках и нервной системе, а также обнаружено несколько новых типов кальциевых каналов: каналы Р-типа (Purkinje) в клетках Пуркинье мозжечка и R-типа в эндотелиальных клетках [30].
На мембранах кардиомиоцитов, гладкомышечных и эндотелиальных клеток сосудистой стенки имеются потенциал-зависимые каналы L- , T- и R-типов, и синтезированы вещества, способные инактивировать каналы этих трех типов, которые могут использоваться для лечения сердечно-сосудистой патологии. Препараты, инактивирующие кальциевые каналы N- и T-типов, применяются для лечения неврологических заболеваний [27].
К антагонистам кальция не относятся блокаторы рецептор-зависи- мых кальциевых каналов (празозин, лозартан), антагонисты кальмоду- лина (фендилин, трифторперазин), "внутриклеточные антагонисты кальция" (рианодин). Не могут считаться лекарственными средствами неорганические вещества (например, ионы бария, кадмия, кобальта, лантана, марганца), приводящие к гибели клеток вследствие необратимой блокады кальциевых каналов [26].
Единственным исключением среди неорганических веществ, обладающих свойствами антагониста кальция, которое применяется в медицине, является магний (магния сульфат). Его ионы (Mg++) действительно могут тормозить вход внеклеточного Са++ внутрь кардиомиоцитов и гладкомышечных клеток по потенциал-зависимым и рецептор-зависимым каналам
[27].
Итак, за редкими исключениями, применяемые в настоящее время антагонисты кальция являются органическими веществами синтетичес-
Тип I Подобные верапамилу
Тип II Подобные нифедипину
Тип III Тип IV
Подобные Подобные
дилтиазему флунаризину
Тип VI Другие (кароверин, лидофлазин,
Тип V пергексилин)
Подобные
прениламину
Рис. 6.1.
Классификация антагонистов кальция, предложенная Комитетом экспертов ВОЗ [31].
кого происхождения.
В 1987 г. Комитетом экспертов ВОЗ была предложена классификация антагонистов кальция, которая учитывала не только их электрофи- зиологические свойства и химическую структуру, но и фармакологические эффекты [31]. Все известные антагонисты кальция разделены на две основные группы в зависимости от наличия или отсутствия у них селективности в отношении медленных кальциевых каналов миокарда, а в зависимости от химической структуры выделены 6 типов (классов) антагонистов кальция (рис. 6.1). Как показали клинические наблюдения, достаточно эффективными и вместе с тем безопасными для лечения сердечно-сосудистых заболеваний были препараты I, II и III классов, тогда как антагонисты кальция IV класса оказались полезными в неврологии [26-28].
Дальнейшие исследования пошли по пути создания новых антагонистов кальция с высокой специфичностью в отношении потенциалзависимых кальциевых каналов миокарда. Появились вещества, которые несколько отличались по химической структуре от препарата — прототипа (антагонисты кальция первого поколения), и некоторые из новых препаратов превосходили своих предшественников силой и продолжительностью действия, а также тканевой селективностью; поэтому их стали называть антагонистами кальция второго поколения.
Среди производных фенилалкиламина анипамил и галлопамил отличаются от прототипа (верапамила) более сильным и продолжительным действием. Среди производных бензотиазепина клентиазем оказался в
- раза сильнее дилтиазема. Некоторые новые антагонисты кальция из группы дигидропиридина отличаются от препарата-прототипа (нифе- дипина) более продолжительным сосудорасширяющим действием (ам- лодипин, лацидипин, нитрендипин) и большей вазоселективностью (фе- лодипин, амлодипин). По данным отдельных исследований, нимоди- пин отличается определенной избирательностью в отношении мозговых артерий, никардипин и нисолдипин — в отношении коронарных артерий, а манидипин и эфонидипин — в отношении почечных артерий [27,28].
Из антагонистов кальция с иной химической структурой заслуживают упоминания бепридил, монатепил и мибефрадил. Бепридил — неселективный антагонист кальция: он активирует не только кальциевые, но и натриевые и калиевые каналы в мембранах кардиомиоцитов, то есть соединяет в себе свойства антиаритмических препаратов I, II и III классов, и намного эффективнее, чем верапамил и дилтиазем [29].
Монатепил — антагонист кальция со свойствами aj-адреноблокатора, который обладает выраженным сосудорасширяющим эффектом, а также отчетливым гиполипидемическим и антиатеросклеротическим действием
[27].
Мибефрадил — селективный антагонист кальция, который по химической структуре является производным тетрамина и первым блокато- ром кальциевых каналов миокарда T-типа; его особенность заключается в избирательном вазодилатирующем действии на коронарные артерии [32].
Говоря о многочисленных антагонистах кальция с разнообразными фармакологическими свойствами, следует иметь в виду, что в клинической практике в действительности под разными патентованными названиями используется чуть более десятка производных трех групп антагонистов кальция.
- Производные фенилалкиламина:
- верапамил (изоптин, финоптин, лекоптин, вералог, калан, верапабе- не, дигновер, кардилокс и др.);
- галлопамил (прокорум).
- Производные бензотиазипина:
- дилтиазем (кардил, тилдием, дилзем, кардизем, дилакор, алдизем, бри- тиазим и др.);
- клентиазем.
- Производные дигидропиридина:
- нифедипин (адалат, коринфар, кордипин, фенигидин, нифелат, ги- пернал, кордафен, нифегексал и др.);
- амлодипин (норваск, амлор, истин и др.);
- исрадипин (ломир, прескал, дайнацирк);
- лацидипин (лаципил);
- никардипин (карден, баризин, нердипил, лексен);
- нимодипин (нимотоп, немотан);
- нисолдипин (сискор, баймикард);
- нитрендипин (байпресс, байотензин, байпресол, унипрес, нитрепин);
- риодипин (форидон, риосидин);
- фелодипин (плендил, флодил, модип, сплендил, ренедил).
В последние годы в клинике широко используются ретардные (с замедленным всасыванием) формы верапамила, дилтиазема, нифедипи- на, а также исрадипина, никардипина, нисолдипина и фелодипина, которые можно назначать всего 1-2 раза в сутки. Ретардные формы антагонистов кальция выпускаются либо под особыми названиями, либо под теми же названиями, что и обычные формы соответствующих препаратов, но с буквенным обозначением, указывающим на то, что речь идет о препарате с постепенным высвобождением.
Для обозначения ретардных форм антагонистов кальция чаще всего используются следующие символы: R (retard), CC (coat core), CD (controlled delivery), CR (controlled release), ER (extended release), LA (long acting), LP (liberation prolongee), GITS (gastrointestinal therapeutic system),
SRO (sustained release oral), а также XL, XR и OROS [27].
У больных ИБС потенциально полезными являются следующие фармакологические эффекты антагонистов кальция [26-29]:
- увеличение доставки кислорода к миокарду вследствие коронарной вазодилатации, улучшения коллатерального кровообращения, а также (для некоторых препаратов) замедления ЧСС, ведущего к увеличению диастолической перфузии левого желудочка;
- уменьшение потребности миокарда в кислороде за счет снижения системного АД, ЧСС и сократительной активности сердца;
- уменьшение конечного диастолического давления в левом желудочке вследствие улучшения процессов диастолического расслабления сердечной мышцы;
- антиаритмическая активность и уменьшение пророста ЧСС при нагрузке (эффекты, присущие верапамилу и дилтиазему);
- уменьшение накопления кальция в ишемизированных кардиоми- оцитах и тем самым предупреждение их повреждения в результате каль-
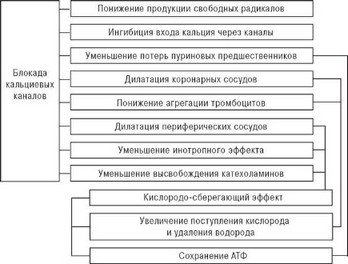
Рис. 6.2 Схема механизмов кардиопротектарного влияния блокады кальциевых каналов при развитии ишемии миокарда, вызванной коронарным стенозом и окклюзией.
ций-зависимой активации протеолитических ферментов и АТФ-азы;
- торможение агрегации тромбоцитов и высвобождения из них биологически активных веществ с вазоконстрикторными и прокоагулянт- ными свойствами;
- антиатерогенные свойства.
Таким образом, антагонисты кальция способны устранять или ослаблять ишемию миокарда, уменьшая его потребность в кислороде и одновременно увеличивая доставку кислорода с кровью, а также оказывая прямое кардиопротекторное действие (рис. 6.2).
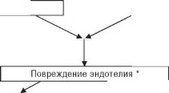
Из дополнительных фармакологических свойств антагонистов кальция особое внимание привлекает антиатерогенное и, возможно, анти- атеросклеротическое действие. Результаты экспериментальных исследований на моделях атеросклероза аорты, сонных и коронарных артерий у кроликов, крыс и обезьян дают основание предполагать, что в основе антиатерогенного действия антагонистов кальция лежит способность их изменять внутриклеточный метаболизм холестерина и ЛПНП,
Холестерин в плазме крови
 7
7
- Кальций перегрузка * Ригидность сосудистой стенки
Натяжение стенки
Агрегация тромбоцитов * i
Выделение PDGF * i
Пролиферация и миграция гладкомышечных клеток * i
Избыточная секреция эластина, коллагена, -> глюкозаминогликанов *
Рис. 6.3 Схема некоторых звеньев патогенеза атеросклероза и возможное воздействие антагонистов кальция (АК) на кальций-зависимые процессы [28,33]
предотвращать перегрузку клеток кальцием, тормозить пролиферацию гладкомышечных клеток и хемотаксис макрофагов и нейтрофилов, подавлять синтез компонентов внеклеточного матрикса (коллагена, эластина, протео-гликанов) [19,33], а также способность этих препаратов тормозить адгезию и агрегацию тромбоцитов. Примечательно, что ан- тиатерогенное действие антагонистов кальция отчасти объясняют их влиянием на функциональную активность тромбоцитов, макрофагов и нейтрофилов, в мембранах которых отсутствуют потенциал-зависимые кальциевые каналы L-типа. Отсюда становится ясно, что спектр фармакологической активности препаратов не ограничивается влиянием только на процессы, регулируемые переносом Са++ по потенциал-зави- симым кальциевым каналам.
Экспериментальные данные побудили исследователей к изучению возможного действия антагонистов кальция на прогрессирование атеросклероза коронарных артерий у больных ИБС. В нескольких многоцентровых клинических исследованиях было показано, что нифедипин при 2-3-летнем применении подавляет (замедляет) прогрессирование коронарного атеросклероза, судя по появлению новых стенозов, обнаруживаемых при количественной оценке повторных коронарных ангиограмм [33,34]. По-видимому, антагонисты кальция оказывают позитивное (корригирующее) влияние на кальций-зависимые механизмы атерогенеза (рис. 6.3), и, хотя антиатеросклеротическая активность антагонистов кальция значительно меньше, чем у гиполипидемических препаратов из группы статинов, нельзя исключить, что комбинирование антагониста кальция и статина окажется полезным при длительном лечении ИБС и/или артериальной гипертонии в сочетании с дислипоп- ротеинемией [27].
Как уже указывалось, в клинической практике наиболее широкое применение получили нифедипин, верапамил, дилтиазем и их производные.
Показания. Нифедипин особенно эффективен при вазоспастической стенокардии, то есть при спонтанной стенокардии со смещением сегмента ST верх от изоэлектрической линии [6]. Он является препаратом выбора при изолированной типичной вариантной стенокардии. В этих случаях прием препарата распределяют в течение суток в зависимости от того, когда наблюдается максимальное число приступов.
Нифедипин не угнетает синусовый узел и атриовентрикулярную проводимость. Отрицательный инотропный эффект клинически не выражен, при необходимости его можно сочетать с бета-адреноблокаторами, сердечными гликозидами. Нифедипин эффективен при артериальной гипертонии [10].
Вместе с тем, говоря о нифедипине, нельзя обойти вниманием тот факт, что в середине 1995 года в зарубежной литературе появились сообщения о
неблагоприятном влиянии нифедипина на риск развития осложнений и смерт-ность больных артериальной гипертонией и ИБС, которые вызвали бурную дискуссию по вопросам практического применения антагонистов кальция.
В статье B.Psaty и соавт. [35] были приведены результаты ретроспективного исследования на основании анализа "case-control" (случай-контроль), и сообщалось о том, что применение антагонистов кальция короткого действия у больных артериальной гипертонией на 60% увеличивает риск развития инфаркта миокарда по сравнению с таковым при лечении другими антигипертензивными препаратами. В другой работе C.Furberg и соавт. [36] провели мета-анализ исследований, в которых больные ИБС получали нифедипин в различных дозах; они сообщили, что смертность от инфаркта миокарда была тем больше, чем выше доза нифедипина. Оба исследования проводили на основе ретроспективного анализа историй болезни, зарегистрированных кооперативной службой здоровья (GHC).
Такой эффект нифедипина авторы объясняют его проишемическим, отрицательным инотропным, прогеморрагическим, проаритмическим действием. На основании полученных результатов сделан вывод о не- благо-приятном влиянии нифедипина, а заодно и всех остальных ди- гидропиридинов, на больных ИБС.
Следует особенно подчеркнуть, что повторный статистический анализ тех же данных, проведенный L.Opie иF.Messerli [37], не подтвердил абсолютной справедливости выводов о вреде нифедипина. Оказалось, что в группе больных с высокой смертностью были преимущественно пациенты с нестабильной стенокардией или полной коронарной окклюзией; далее были последовательно опровергнуты все постулаты, касающиеся механизмов и выраженности побочного действия антагонистов кальция.
В другом исследовании было изучено влияние антагонистов кальция на смертность у 11575 больных ИБС. Не нашел подтверждения тот факт, что прием антагонистов кальция при хронической ИБС (с перенесенным инфарктом миокарда или без него) сопряжен с увеличением риска смерти в течение 3,2 лет наблюдения. Повозрастной коэффициент риска был равен лишь 1,08 (цит. по [18]).
Надо заметить, что многих недостатков нифедипина лишены антагонисты кальция второго поколения, к которым относят новые производные дигидропиридинов, отличающиеся по химической структуре, и новые лекарственные формы препаратов-прототипов. Последние включают в себя лекарственные формы с замедленным высвобождением препарата (например, коринфар-ретард), с двухфазным высвобождением (адалат SL) и терапевтические системы 24-часового действия (адалат GITS, прокардия XL) [27].
Вместе с тем, учитывая разноречивость проведенных исследований, окончательный ответ о безопасности и эффективности длительного применения антагонистов кальция как быстрого, так и медленного действия, можно дать лишь после проведения рандомизированных клинических исследований.
Верапамил по механизму антиангинального действия сходен с ни- федипином, но имеет некоторые особенности, в частности, он угнетает функ-цию синусового узла, замедляет атриовентрикулярную проводимость и снижает ЧСС. Верапамин дает выраженный отрицательный инотропный эффект, сопоставимый с действием бета-адреноблокато- ров, его эффективность при вазоспастической стенокардии сопоставима с эффективностью нифедипина. Верапамил считается препаратом выбора при "смешанной" стенокардии и особенно хорошо сочетается с нитратами [10,27,28].
Способность верапамила влиять на атриовентрикулярную проводимость делает его одним из эффективных антиаритмических препаратов [9,13].
Дилтиазем является производным бензотиазипина и по основным фармакологическим свойствам занимает как бы промежуточное положение между нифедипином и верапамилом: угнетает функцию синусового узла и атриовентрикулярную проводимость меньше, чем верапа- мил, и снижает АД слабее, чем нифедипин [10].
Выбор антиангинальных препаратов и их эффективные дозы для лечения стабильной стенокардии напряжения представлены далее в табл. 6.3 и 6.4.
Противопоказания к назначению антагонистов кальция следующие [27].
Абсолютные:
- беременность и грудное вскармливание;
- артериальная гипотония (систолическое АД ниже 90 мм рт.ст.);
- систолическая дисфункци
