ФИЗИОЛОГИЯ И ПАТОФИЗИОЛОГИЯ КОРОНАРНОГО КРОВООБРАЩЕНИЯ
Несмотря на огромное количество исследований, посвященных проблеме физиологии и патофизиологии коронарного кровообращения, конкретное содержание механизмов регуляции и компенсации, обеспечивающих адекватное кровоснабжение сердца, до конца не изучено. Существующие разногласия в объяснении тех или иных механизмов регуляции коронарной гемодинамики обусловлены несколькими причинами.
Во-первых, это связано с тем, что на скорость и величину кровотока в коронарном русле влияют многочисленные физические, нейрогумо- ральные и метаболические факторы, совокупность которых чрезвычайно сложно оценить даже в экспериментальных условиях.
Во-вторых, существующие на сегодняшний день методы изучения коронарного кровотока не лишены недостатков, которые затрудняют, а нередко и способствуют ошибочной интерпретации полученных данных. Наиболее сложной задачей является оценка коронарного крово
обращения в условиях клиники, так как до сих пор не существует метода, позволяющего точно измерить весь комплекс гемодинамических параметров этого сосудистого бассейна.
В-третьих, следует обратить особое внимание на необходимость крайне осторожной экстраполяции результатов экспериментальных исследований применительно к человеческому организму, в особенности при атеросклеротическом (и ином) поражении венечных артерий.
Вместе с тем ситуация не является абсолютно безнадежной. К на- сто-ящему времени на основании результатов фундаментальных исследований в экспериментальной и клинической кардиологии сложилась вполне аргументированная концепция, объясняющая механизмы коронарного кровообращения.
Как известно, кровоснабжение сердца человека обеспечивается разветвлением двух мощных артериальных стволов: правой и левой венечных артерий, которые берут начало из соответствующих правого и левого синусов Вальсальвы и, следовательно, являются первыми ветвями аорты.
Левая коронарная артерия (ЛКА) представляет собой крупный сосуд, диаметр которого может достигать 6 мм. Длина ее 8-10 мм. Артерия располагается между ушком левого предсердия и легочной артерией и делится, как правило, на две основные ветви: переднюю межжелудоч- ковую и огибающую.
Передняя межжелудочковая ветвь является наиболее мощной; она располагается в передней продольной венечной борозде и доходит до верхушки сердца, заходя иногда на его заднюю поверхность. Передняя межжелудочковая артерия отдает три группы ветвей: 1) к правому желудочку; 2) к левому желудочку; 3) к межжелудочковой перегородке.
Огибающая ветвь ЛКА — крупный сосуд диаметром от 2 до 4 мм. На протяжении первых 3-5 см артерия бывает покрыта жировой тканью, а также небольшими участками мышечной ткани, которые перекидываются через нее, как мостик. Огибающая ветвь заканчивается обычно между тупым краем сердца и задней продольной венечной бороздой, где отдает 2-3 артерии тупого края, кровоснабжающие боковую поверхность сердца, и 3-6 артерий, питающих заднюю стенку левого желудочка.
В ряде случаев ЛКА делится не на две, а на большее число ветвей. Наиболее постоянной из дополнительных ветвей является диагональная ветвь, которая распространяется в латеральной части левого желудочка, снабжая ее кровью.
Правая коронарная артерия (ПКА) в начальном отделе располагается позади основания легочной артерии, кпереди и под ушком правого предсердия. Далее артерия проходит по атрио-вентрикулярной борозде на заднюю поверхность сердца, где образует заднюю межжелудочковую
ветвь. В области верхушки сердца ПКА анастомозирует с ветвями ЛКА. Кроме того, ПКА, отдавая 12-14 септальных ветвей, участвует в кровоснабжении задней трети межжелудочковой перегородки. В ряде случаев эта артерия может переходить на заднюю стенку левого желудочка, принимая участие в ее кровоснабжении.
На передней стенке правого желудочка от ПКА отходят 1-2 передние нисходящие ветви, питающие эту стенку. Одной из наиболее крупных ветвей ПКА является артерия острого края сердца (маргинальная ветвь). Эта артерия питает боковую стенку желудочка и достигает верхушки, где анастомозирует с ветвями ЛКА и ПКА [16].
При делении коронарных артерий и их распределении в миокарде могут иметь место индивидуальные вариации. Наиболее непостоянным является кровоснабжение задней стенки сердца (диафрагмальной поверхности).
В толще миокарда коронарные артерии распадаются на артериолы и густую сеть капилляров. Венозные концы капилляров, анастомозируя между собой, образуют венулы и вены и формируют два пути оттока крови — через коронарный синус и передние вены сердца, каждый из которых впадает в правое предсердие.
Своеобразие венечного оттока заключается также в том, что в сердце человека каждую артерию сопровождает одна вена и, кроме того, существует система сосудов Вьессена-Тебезия, представляющая собой сеть анастомозирующих каналов, открывающихся во все камеры сердца. При нарушениях кровотока в венечных артериях сосуды Вьессена-Тебезия приобретают компенсаторное значение [17,18].
Другой особенностью коронарного кровообращения, связанной с анатомическим своеобразием сосудистой системы сердца, является развитая сеть капилляров. Доказано, что число капилляров на единицу объема миокарда в два раза превышает количество капилляров, приходящихся на такой же объем скелетной мышцы [19].
Таким обильным кровоснабжением частично объясняется способность миокарда извлекать кислород из крови более активно, чем другие органы.
В условиях покоя коронарный кровоток у человека, по данным разных авторов, колеблется в диапазоне от 60 до 150 мл на 100 г массы миокарда. Иными словами, для сердца весом около 300 г объем коронарного кровотока составляет в среднем 250 мл/мин. Известно, что минутный объем крови в покое составляет 4-6 л, следовательно, минутный объем коронарного кровотока составляет 5-6% от общего сердечного выброса. Во время максимальных физических нагрузок, когда сердечный выброс может возрастать до 25-30 л/мин, объем кровотока в венечных артериях имеет способность к более чем 10-кратному увеличению [18-22].
Это еще раз подчеркивает мобильность регуляции кровоснабжения
сердечного насоса в быстром обеспечении конкретной гемодинамичес- кой ситуации.
Исследованиями многих авторов показано, что основными физическими факторами, определяющими скорость и величину коронарного кровотока, являются (рис. 2.3): давление в аорте, функционирование восходящего отдела аорты как компрессионной камеры высокого давления с эластичными и упругими стенками, длительность диастолы, механическая активность миокарда, коронарное сосудистое сопротивление, вязкость крови [18,21,23].
В других работах акцентируется роль окислительно-восстановительных процессов в сердечной мышце, воздействия нейрогенных и гуморальных, в том числе метаболических, факторов, влияющих на тонус венечных сосудов и тем самым обеспечивающих быструю перестройку коронарного кровотока [19,24,25].
Как видно на рис. 2.3, основным гемодинамическим фактором, определяющим кровоснабжение миокарда, является пульсовое давление в аорте, между средним давлением в которой и величиной коронарного кровотока доказана прямая зависимость. Вместе с тем считается уста-
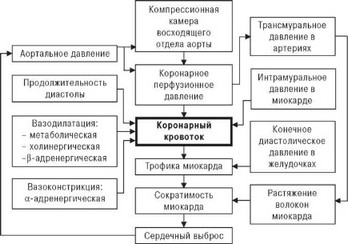
Рис. 2.3. Влияние физических факторов на коронарный кровоток ([27] с модификацией).
новленным, что объемный кровоток в любой системе зависит от перфу- зионного давления и сосудистого сопротивления [22,26].
В коронарной системе перфузионное давление упрощенно определяется градиентом между давлением в устьях венечных артерий (синусы Вальсальвы) и давлением в правом предсердии (коронарный синус) во время диастолы. Отсюда величина коронарного кровотока прямо пропорциональна перфузионному давлению и обратно пропорциональна коронарному сосудистому сопротивлению [17-19,22].
В литературе имеются указания о практическом приравнивании коронарного перфузионного давления к величине диастолического давления в аорте из-за низких значений венозного давления [27]. В свою очередь, давление в аорте (как систолическое, так и диастолическое) зависит от ударного объема левого желудочка, эластичности аорты и крупных артерий, вязкости крови и общего сосудистого сопротивления
[20,26].
Функция аорты как компрессионной камеры для обеспечения непрерывности потока крови известна со времен С.Хейлса, который в 1733 г. первым высказал мысль о пропульсивной роли аорты (цит. по [28]). Немецкий физиолог О.Франк (1899) развил идеи С.Хейлса в теорию упругого резервуара, и в настоящее время гемодинамическая роль аорты и крупных артерий стала аксиомой в физиологии сердечно-сосудистой системы.
Во время систолы левого желудочка аортальная компрессионная камера выполняет функцию резервуара крови, когда часть ударного объема (около 30 мл) заполняет растянутые сегменты восходящего отдела аорты. Благодаря эластичности и упругости стенок аорты, систолический прирост объема ее восходящей части является крайне важным ге- модинамическим условием для создания эффективного коронарного кровотока в диастолу. В связи с тем, что во время диастолы антеградный кровоток в восходящем отделе аорты прекращается, созданный в систолу резервный объем крови попадает в устье коронарных артерий, являясь единственным источником кровоснабжения сердечной мышцы в диастолическом периоде кардиоцикла [29,30].
Своеобразная особенность кровоснабжения миокарда заключается также в том, что вследствие ритмического сокращения сердечной мышцы величина коронарного кровотока изменяется даже за время одного сердечного цикла. Среди гипотез, объясняющих фазность коронарного кровотока, наиболее распространена теория, согласно которой объем венечного кровотока пропорционален разнице между перфузионным и интрамиокардиальным давлением. Ведущую роль в увеличении перфу- зионного и интрамиокардиального давления играет механическое сокращение, которое ограничивает коронарный кровоток вследствие резкого повышения внутрижелудочкового и интрамурального давления и
механической компрессии венечных артерий во время систолы [20,27].
По мнению К.Б.Тихонова [31], прилежащие друг к другу, но по-разному ориентированные мышечные волокна при сокращении сердца создают “эффект ножниц”. В результате этого кровоток в коронарных сосудах в систолу может резко ограничиваться либо полностью прекращаться. Кроме того, как считает автор, сокращение и утолщение мышечных волокон вызывает удлинение ветвей субэпикардиальных артерий, проходящих через толщу миокарда, что приводит к значительному повышению коронарного сопротивления.
Вместе с тем, несмотря на значительное увеличение интрамурального давления, кровоток в интрамиокардиальных артериях, падая в систолу на 40-85%, полностью не прекращается и составляет в среднем 25-30% диастолического кровотока [19].
Следовательно, в течение систолы сжатие венечных артерий не является тотальным и частично преодолевается коронарным перфузион- ным давлением.
Как бы там ни было, считается твердо установленным тот факт, что 85-90% объема коронарного кровотока приходится на диастолический период, причем максимум кровотока совпадает с фазой ранней диастолы. Это объясняется прежде всего тем, что в момент релаксации миокарда происходит быстрое снижение экстраваскулярной компрессии венечных артерий на фоне сохранения достаточно высокого давления в аорте. И, наконец, предполагается, что увеличение коронарного кровотока в первой половине диастолы связано с присасыванием крови в расслабляющиеся желудочки [25,32].
Соотношение систолической и диастолической компонент кровотока, будучи изменчивой величиной в разных гемодинамических ситуациях, в условиях покоя примерно равно 1 : 6. При этом отток венозной коронарной крови, наоборот, максимален в период систолы, что объясняется теми же компрессионными механизмами [33].
Фазовые изменения кровотока особенно выражены в миокарде левого желудочка, а точнее в его субэндокардиальных слоях, где во время повышения внутрижелудочкового давления возможен даже ретроградный кровоток, поскольку в этот момент интрамиокардиальное давление выше чем в аорте. Интрамуральное давление, нарастая от эпикарда к эндокарду, приобретает наиболее высокие значения в субэндокарди- альных слоях, где оно может быть выше внутрижелудочкового как во время систолы, так и во время диастолы [18,33].
Таким образом, несмотря на различия в деталях, большинство исследователей придерживается единой точки зрения о снижении, либо прекращении, коронарного кровотока в фазе повышения внутрижелу- дочкового давления и максимальном кровотоке в период диастолы.
В миокарде правого желудочка интрамуральное систолическое дав
ление не достигает высоких величин, в связи с чем кровоснабжение этого отдела сердца не имеет выраженных фазовых изменений. Достаточно высокое давление в аорте способствует относительно свободному прохождению крови по артериям правого желудочка, так как они не подвергаются существенному сужению интрамуральным давлением [18,25,30].
Отдельно следует осветить основные положения о нейрогумораль- ных механизмах регуляции коронарного кровообращения.
Как известно, уровень энергетического обмена сердца даже в условиях полного покоя достаточно высок. По данным А.В.Трубецкого [19], потребление кислорода в покое составляет 4-10 мл на 100 г массы миокарда в 1 минуту. При этом из притекающей крови экстрагируется 6075% кислорода (для сравнения, ткань головного мозга экстрагирует лишь 25-30% кислорода). Содержание кислорода в коронарной венозной крови составляет всего 5-6 об %, тогда как в крови из полых вен 14-15 об %. Поэтому всякое повышение потребности миокарда в кислороде обеспечивается за счет повышения объема коронарного кровотока, происходящего, главным образом, вследствие дилатации венечных артерий и увеличения числа функционирующих капилляров.
В связи с тем, что собственные запасы кислорода, связанного в миокарде с миоглобином относительно невелики, а способность сердечной мышцы вырабатывать энергию путем анаэробного гликолиза — кратковременна, существует тесная связь между уровнем миокардиальных метаболических запросов и величиной коронарного кровотока. При этом доказано, что артериолярный участок венечного русла обладает значительным резервом для расширения, и адекватная работа сердца в данных конкретных условиях прямо зависит от способности коронарных сосудов изменять свой тонус, а тем самым, и свою пропускную способность [34-36].
Регуляция тонуса коронарных артерий тесно связана как с метаболическими запросами миокарда, так и с химическим составом притекающей крови. Известно, что как при увеличении потребности сердца в кислороде, так и при недостаточном поступлении оксигенированной крови коронарные артерии расширяются. Первая реакция описана в литературе как рабочая гиперемия, вторая — как реактивная гиперемия
[19,27].
В экспериментальных исследованиях показано, что при снижении насыщения крови кислородом на 10% объем коронарного кровотока повышается почти на 300% [18].
Гипоксия автоматически вызывает дилатацию, так как дефицит кислорода прямо влияет на гладкие мышцы артерий, изменяя электрохимический потенциал мышечных клеток, что в свою очередь опосредует релаксацию прекапиллярного сфинктера [38]. Согласно другой точке
зрения, при гипоксии происходит высвобождение метаболитов, таких, как аденозин и лактат, которые диффундируют в межклеточное пространство и вызывает вазодилатацию. Следует заметить, что аденозио- новая гипотеза завоевала большую популярность в объяснении механизмов вазодилатационных реакций при усиленной работе сердца и недостаточном кислородном снабжении миокарда [19,37].
Кроме аденозина и лактата, в качестве эндогенных агентов метаболической природы, ответственных за расширение венечных артерий, называют углекислый газ, ионы калия, неорганический фосфат, простаг- ландины, кинины, гистамин, а также состояние ацидоза [19,38]. Такие гуморальные агенты биогенной природы, как ангиотензин, эндотелин, лейко-триены и высвобождающийся из тромбоцитов тромбоксан А2, обладают вазоконстрикторным действием [39-41].
Предполагается, что механизмы коронарной дилатации при рабочей и реактивной гиперемии различны, хотя и в том и другом случае сосуды расширяются. Существенное значение имеет тот факт, что при длительной реактивной гиперемии стенки сосудов утрачивают упругие свойства и становятся более податливыми к действию сил экстраваскуляр- ного сжатия во время систолы и при повышении конечного диастолического давления в левом желудочке, тогда как при рабочей гиперемии коронарные сосуды, расширяясь, не теряют своих упругих свойств [19,37].
Своеобразными ауторегуляторными реакциями коронарные артерии отвечают на изменения перфузионного давления, что в литературе описывается как феномен Остроумова-Бейлисса: при повышении перфу- зионного давления наблюдается рефлекторная вазоконстрикция, а снижение давления в сосудах вызывает их расширение [27,42].
Для понимания адаптационных процессов, происходящих в сердечной мышце, крайне важным представляется изучение механизмов нейрогенной регуляции коронарного кровообращения.
В результате экспериментальных исследований обнаружено, что влияние блуждающих и симпатических нервов на венечные сосуды трудно отделить от их влияния на систему кровообращения в целом. В опытах на остановленных, фибриллирующих или сокращающихся сердцах с использованием строго специфических фармакологических блокаторов выявлено, что вопреки классическим представлениям, раздражение блуждающего нерва вызывает снижение тонуса сосудов и увеличение коронарного кровотока [17,18].
При изучении симпатических нервных влияний была обнаружена еще более сложная картина в связи с наличием в сердце двух типов ад- ренорецепторов. Обнаружено, что при раздражении симпатических нервов первоначально происходит сужение коронарных сосудов, опосредованное возбуждением альфа-адренорецепторов. Продолжение сим
патического раздражения вызывает вторичное возбуждение бета-адре- норецепторов и расширение сосудов. Раздражение симпатических нервов, в конечном итоге, приводит к выраженному увеличению коронарного кровотока, которое длительно сохраняется и после прекращения возбуждения [37,43].
Нервный контроль коронарного кровообращения обеспечивает соответствие пропускной способности венечного русла текущим потребностям миокарда в кислороде и, по-видимому, корригирует эффекты более инерционного по скорости включения, но обладающего мощным резервом, местного метаболического механизма регуляции [24,42,44].
В условиях высокой экономичности кровоснабжения миокарда местные факторы регуляции, действующие по принципу компенсации, дополняются более пластичной нервной регуляцией, способной “обрывать” инерционные перерегулирования кровотока, опосредованные тканевыми метаболическими факторами. Вероятно, этим объясняется парадоксальная, на первый взгляд, способность симпатических нервных влияний усиливать работу сердца и ограничивать коронарный кровоток и противоположное действие блуждающих нервов [24,3 8,43].
В литературе описана ауторегуляторная реакция венечных сосудов, обеспечивающая так называемый механизм “гашения” гиперметаболизма, при быстром переходе от высокой активности сердца к низкой за счет уменьшения нутритивного кровотока [19]. Предполагается, что основное значение симпатической вазомоторной иннервации заключается в предохранении сердца от последствий чрезмерной метаболической ва- зодилатации за счет компенсированной вазоконстрикции [42,43].
Таким образом, природа создала весьма надежную “многоэтажную” систему регуляции кровоснабжения сердца. Многочисленные, нередко дублирующие друг друга механизмы обеспечивают точное соответствие величины коронарного кровотока кислородным потребностям сердечной мышцы как в условиях покоя, так и при физических, психоэмоциональных нагрузках и других состояниях.
В клинической кардиологии одной из центральных является проблема изучения патофизиологических механизмов компенсации гемоди- намического дефицита, обусловленного коронарным атеросклерозом.
Как известно, венечные артерии в покое обладают высоким тонусом, что обеспечивает им большой расширительный резерв, и увеличение работы сердца, повышающее кислородный запрос миокарда, сопровождается 5-7-кратным увеличением коронарного кровотока. В связи с этим при атеросклерозе венечных артерий одним из основных компенсаторных факторов является коронарный резерв, под которым понимается способность коронарной сосудистой сети увеличивать объемный кровоток адекватно кислородным запросам миокарда в конкретной физиологической ситуации [19,45,46].
Как уже было сказано, во время физической или психоэмоциональной нагрузки потребность миокарда в кислороде и энергетических субстратах повышается, что вызывает расширение коронарных артерий. У больных атеросклерозом коронарный кровоток в этих ситуациях также возрастает, но, соответственно, увеличивается и сопротивление стено- зированного участка сосуда. Складывается патогенетическая зависимость, в которой уменьшение сопротивления резистивных сосудов вызывает повышение сопротивления стеноза. Соответственно увеличивается градиент давления в пре- и постстенотических участках артерии. Подчиняясь этим закономерностям, дистальнее стеноза падает перфу- зионное давление и объемная скорость кровотока, развивается ишемия миокарда, находящегося в бассейне пораженного сосуда [19,47].
В потенцировании развивающейся ишемии следует отметить также определенную роль синдрома “межкоронарного обкрадывания”. Сущность этого феномена заключается в том, что дилатация коронарного русла, снижая сосудистое сопротивление, вызывает перераспределение кровотока в адрес непораженных артерий, вследствие чего в участках дистальнее стеноза усиливается падение перфузионного давления и объемного кровотока [47,48].
Необходимо добавить, что причиной внезапного резкого снижения кровотока может служить спазм магистрального коронарного сосуда в зоне стеноза. Предполагается, что наиболее вероятными причинами спазма являются агрегация тромбоцитов в области атеросклеротической бляшки, пассивные изменения стеноза, обусловленные снижением перфузионного давления вследствие расширения резистивных сосудов, гидродинамическое повышение сопротивления стенозированного участка, а также системные адренергические реакции [49]. В результате ангиоспазма атеро-склеротический стеноз может одномоментно достигать критического уровня и приводить к ишемии и некрозу миокарда в связи с исчерпанием резерва коронарной дилатации и отсутствием возможности быстрой гемодинамической перестройки венечного кровообращения.
В экспериментальных исследованиях при моделировании атеросклероза, ишемии и гипоксии было обнаружено ограничение расширения коронарных артерий, обусловленное повреждением метаболических механизмов регуляции, а также снижением рецепторной чувствительности к медиаторам [27,47]. Видимо, следует признать, что функциональная недостаточность метаболического механизма вазодилата- ции также может быть причиной ограничения коронарного резерва и развития ишемии мио-карда у больных атеросклерозом.
Считается доказанным, что недостаточность коронарного кровообращения приводит к снижению сократительной и насосной функции сердца. Согласно концепции В.Н.Фатенкова [25], хроническая ишемия,
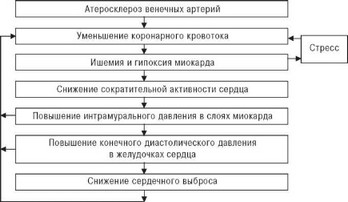
Рис. 2.4. Порочный круг, возникающий при атеросклерозе коронарных артерий.
возникающая вследствие редукции коронарного кровотока, обусловливает нарушение сократимости всех слоев миокарда, а это, в свою очередь, является причиной неадекватного снижения интрамурального давления в мышечных слоях и внутрижелудочкового давления в период диастолы. Нарушение процессов релаксации миокарда и снижение сердечного выброса приводят к еще более выраженному уменьшению коронарного кровотока (рис. 2.4).
Здесь надо подчеркнуть, что в реальных условиях взаимодействие механизмов и факторов, определяющих адекватное кровоснабжение либо развитие ишемии миокарда в результате истощения резервных возможностей коронарной сосудистой сети, оказывается гораздо сложнее, чем это представлено в общепринятых схемах. Степень стенозирования артерий, гемодинамический режим перфузии миокарда, гидродинамика в пораженных сосудах, перераспределение кровотока в миокарде, тонус магистральных и резистивных сосудов, потребность миокарда в кислороде, агрегация клеток крови и тромбоз, проявляющиеся в различной степени и включающиеся в нарушение баланса прямых и обратных связей в системе “потребность — доставка”, создают широкий диапазон клинических проявлений коронарного атеросклероза от стенокардии напряжения до внезапной смерти и инфаркта миокарда.
А так же в разделе «ФИЗИОЛОГИЯ И ПАТОФИЗИОЛОГИЯ КОРОНАРНОГО КРОВООБРАЩЕНИЯ »
- ГИПОТЕЗЫ И ТЕОРИИ АТЕРОСКЛЕРОЗА
- ЛИПИДЫ И ЛИПОПРОТЕИНЫ ПЛАЗМЫ КРОВИ
- Дислипопротеинемия как основной патогенетический фактор атеросклероза
- 1.2.2. Другие факторы риска атеросклероза и ИБС
- ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ СОСУДИСТОЙ СТЕНКИ, ПУТИ ПРОНИКНОВЕНИЯ И ТКАНЕВОЙ ОБМЕН ЛИПИДОВ
- Морфогенез атеросклеротической бляшки
- АТЕРОСКЛЕРОЗ, АРТЕРИАЛЬНЫЕ СОСУДЫ И ВОЗРАСТ
- АТЕРОСКЛЕРОЗ И АРТЕРИАЛЬНАЯ ГИПЕРТОНИЯ
- АТЕРОСКЛЕРОЗ И САХАРНЫЙ ДИАБЕТ
- АТЕРОСКЛЕРОЗ И ГОРМОНЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
- АТЕРОСКЛЕРОЗ И ПОЛОВЫЕ ГОРМОНЫ
- ПОБОЧНОЕ ВЛИЯНИЕ НЕКОТОРЫХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ НА ЛИПИДНЫЙ СОСТАВ КРОВИ
- ГЛАВА 2 ИШЕМИЧЕСКИЙ СИНДРОМ - ОСНОВНОЙ ПАТОФИЗИОЛОГИЧЕСКИЙ ФЕНОМЕН АТЕРОСКЛЕРОЗА
- Ишемическая болезнь сердца
- ФИЗИОЛОГИЯ И ПАТОФИЗИОЛОГИЯ МОЗГОВОГО КРОВООБРАЩЕНИЯ
- ФИЗИОЛОГИЯ И ПАТОФИЗИОЛОГИЯ ПЕРИФЕРИЧЕСКОГО КРОВООБРАЩЕНИЯ
- Ишемическая болезнь нижних конечностей
- СОЧЕТАННЫЕ ФОРМЫ АТЕРОСКЛЕРОЗА: ОСОБЕННОСТИ КЛИНИКИ, ДИАГНОСТИКИ И ЛЕЧЕНИЯ
- ГЛАВА 2. СПИСОК ЛИТЕРАТУРЫ