ФИЗИОЛОГИЯ И ПАТОФИЗИОЛОГИЯ МОЗГОВОГО КРОВООБРАЩЕНИЯ
Закономерности, определяющие циркуляторное обеспечение деятельности центральной нервной системы, занимают особое положение в физиологии органного кровообращения. Это обусловлено прежде всего функ-циональной значимостью сосудистой системы головного мозга для организма в целом. От качества и надежности ее деятельности зависит функциональное состояние органов центральной нервной системы, нуждающихся в непрерывном и интенсивном притоке питательных веществ, а также удалении продуктов обмена клеточных элементов нервной ткани. Другой причиной является сложность структурно-функциональной организации мозгового кровообращения, вытекающая, с одной стороны, из особенностей соотношения объемов и давлений жидких сред (кровь, спинномозговая жидкость), а с другой — из выраженной гетерогенности ткани мозга [84].
Масса головного мозга составляет лишь 2-3% от общей массы тела человека, но для поддержания нормального метаболизма мозга необходимы 15-20% сердечного выброса, 18-20% общего потребления кислорода организмом и 70% всей глюкозы. Каждую минуту к клеткам мозга устремляется 750-1000 мл крови, и за этот отрезок времени 100 г ткани мозга потребляют 3,0-3,5 мл кислорода и около 5 мг глюкозы [20].
Кровоснабжение мозга осуществляется по четырем магистральным артериям: двум сонным и двум позвоночным, причем в систему сонных артерий поступает в 3,5-4 раза больше крови, чем в позвоночные артерии.
Общая сонная артерия парная берет начало в грудной полости справа от плечеголовного ствола, а слева — непосредственно от дуги аорты, поэтому левая общая сонная артерия на несколько сантиметров длин
нее правой. Далее общая сонная артерия поднимается почти вертикально вверх и через верхнюю апертуру грудной клетки выходит в область шеи. Здесь она располагается на передней поверхности поперечных отростков шейных позвонков и покрывающих их мышц, сбоку от трахеи и пищевода, позади грудино-ключично-сосцевидной мышцы. Кнаружи от общей сонной артерии располагается внутренняя яремная вена, а сзади в желобке между ними — блуждающий нерв.
Общая сонная артерия ветвей не дает. На уровне верхнего края щитовидного хряща расположена бифуркация сонной артерии на наружную и внутреннюю сонные артерии.
У места деления имеется расширенная часть общей сонной артерии
- каротидный синус, к которому прилежит небольшой узелок — каротидный гломус.
Каротидный гломус, размером 3х5 мм, связан с наружной оболочкой сонной артерии, содержит большое количество сосудов и нервов и является хеморецептором, реагирующим на изменение концентрации кислорода, двуокиси углерода и ионов водорода в крови, выполняя одновременно эндокринную функцию.
От места бифуркации наружная сонная артерия, направляясь вверх, идет вперед и медиальнее внутренней сонной артерии, а затем кнаружи от нее. Наружная сонная артерия дает ряд ветвей, которые делятся на четыре группы: переднюю, заднюю, медиальную и группу концевых ветвей, снабжающих кровью щитовидную железу, язык, гортань, глотку, верхнюю челюсть, ткани лица, височную область.
Внутренняя сонная артерия является продолжением общей сонной артерии. В ней различают шейную, каменистую, пещеристую и мозговую часть. Направляясь вверх, она вначале залегает несколько латераль- нее и сзади от наружной сонной артерии.
Латерально от нее находится внутренняя яремная вена. На своем пути к основанию черепа внутренняя сонная артерия проходит по боковой стороне глотки (шейная часть) медиально от околоушной железы, отделенная от нее шилоподъязычной и шилоглоточной мышцами.
В шейной части внутренняя сонная артерия ветвей обычно не отдает. Здесь она несколько расширена за счет каротидного синуса.
Подойдя к основанию черепа, артерия входит в сонный канал, делает изгибы соответственно изгибам канала (каменистая часть) и по выходе из него вступает через рваное отверстие в полость черепа. Здесь артерия идет в сонной борозде клиновидной кости.
От мозговой части внутренней сонной артерии отходят крупные артерии.
- Глазная артерия — парный крупный сосуд, направляется через зрительный канал в глазницу, залегая кнаружи от зрительного нерва.
- Передняя мозговая артерия — довольно крупная, начинается у ме
ста разделения внутренней сонной артерии на концевые ветви, проходит вперед и в медиальную сторону, располагаясь над зрительным нервом. - Средняя мозговая артерия — наиболее крупная из ветвей внутренней сонной артерии, является ее продолжением.
- Задняя соединительная артерия берет начало от внутренней сонной артерии и, направляясь кзади и внутрь, подходит к задней мозговой артерии.
- Передняя ворсинчатая артерия начинается от задней поверхности внутренней сонной артерии и, направляясь латерально вдоль ножки большого мозга кзади и кнаружи, подходит к передненижним отделам височной доли мозга [16].
Магистральные артерии на основании черепа сливаются в обширный анастомоз — Виллизиев круг, откуда отходят артерии, снабжающие кровью ткань головного мозга, а вены образуют систему синусов, куда впадают венозные сосуды, отводящие кровь от мозга. В функциональном отношении Виллизиев круг является предуготованным анастомозом между каротидной и вертебро-базилярной артериальными системами головного мозга.
Передние, средние и задние мозговые артерии распадаются на сеть пиальных сосудов, которые распределяют кровь по поверхности мозга. От пиальных артерий почти под прямым углом отходят радиальные сосуды, проникающие на разную глубину в вещество мозга. Хотя эти артерии имеют многочисленные анастомозы, функционально каждая из них имеет собственный бассейн кровоснабжения [85].
В магистральных артериях мозга, в местах отхождения радиальных артерий и капилляров находятся сфинктеры, сокращение которых может значительно снизить кровоток в дистальных сосудах. Это имеет существенное значение для регулирования кровоснабжения мозга [86].
Сосуды головного мозга обильно снабжены афферентной и эфферентной иннервацией. Наиболее богатые рецепторные зоны, чувствительные к изменениям внутрисосудистого давления крови и ее химического состава, локализованы в магистральных артериях мозга (сино- каротидная зона), в бифуркациях мозговых сосудов и в артериях Вил- лизиева круга. Подобные рецепторные зоны, чувствительные к давлению, расположены в твердой мозговой оболочке, а зоны, чувствительные к рН и напряжению двуокиси углерода в крови (р СО2) — локализованы на поверхности желудочков мозга и в самой его тка2ни. Эти зоны являются начальным звеном афферентной иннервации [85].
Сосуды головного мозга чувствительны к самым различным химическим соединениям. Кроме веществ, выполняющих функцию медиаторов (серотонин, адреналин, гистамин, ацетилхолин, вазоактивные пептиды), сосудистое действие которых реализуется через специализи
рованные рецепторы, активным сосудодвигательным действием обладает и ряд эндогенных веществ. К ним относятся кинины, ангиотензин, простагландины, гамма-аминомасляная кислота. По-видимому, некоторые из них являются субстратами гуморальной регуляции мозговой гемодинамики.
Анализ биофизической структуры системы церебрального кровообращения позволил установить, что благодаря динамичной взаимосвязи объемов артериальной, венозной крови и ликвора в закрытой полости черепа создаются условия для эффективного использования энергии, вырабатываемой сердцем — прямой передачи ее части на отток венозной крови из черепа. Деятельность этого механизма заключается в следующем: с каждой систолой объем артериальной системы мозга возрастает на 5-7%, что через повышение ликворного давления сжимает вены мозга, выдавливая кровь из полости черепа. Влияние пульсовых колебаний артериального давления на отток крови из черепа соблюдается лишь при определенном соотношении между объемами жидких сред, заполняющих полость черепа [85]. В связи с этим чрезмерное возрастание объема либо артерий, либо вен в черепе может отрицательно сказаться на мозговом кровообращении. Кроме того, особенности биофизической структуры системы мозгового кровообращения определяют феномен механической стабилизации церебрального кровотока — независимость (в определенных пределах) уровня кровотока через головной мозг при изменениях системного АД [20,84,87].
В регуляции мозгового кровообращения участвуют несколько контуров, каждый из которых в принципе способен функционировать самостоятельно. Регуляторные контуры имеют собственные источники входных стимулов, структуры выработки управляющих воздействий, каналы передачи входных стимулов и управляющих влияний, исполнительное звено, а также каналы обратных связей.
Передача входных стимулов и управляющих воздействий осуществляется несколькими путями: а) по нервным волокнам; б) с током крови; в) по закону диффузии в межклеточной среде мозга.
Исполнительным звеном в механизме регуляции мозгового кровообращения являются мышцы сосудистой стенки, которые воспринимают несколько видов влияний [85]:
- раздражение специализированных рецепторов как медиаторами, выделяемыми нервными окончаниями, так и химическими соединениями, попадающими в кровь;
- механическое растяжение внутрисосудистым давлением крови;
- чувствительность к веществам, являющимся продуктами клеточного обмена.
Обратная связь осуществляется следующими путями:
- с помощью сигналов, воспринимаемых специальными рецепторами,
локализованными в ткани мозга и его оболочках; - путем вымывания химических соединений из межклеточной среды повышенным кровотоком;
- снятием напряжения сосудистой стенки из-за расслабления ее мышц.
Таким образом, в структурно-функциональной организации системы регулирования мозгового кровообращения выделены 4 регуляторных контура: нейрогенный, гуморальный, метаболический и миоген- ный.
Эти регуляторные контуры находятся в динамическом взаимодействии, на первый план может выходить тот или иной контур в зависимости от конкретной ситуации. Однако существует определенная их иерархичность и соподчиненность. Так, экспериментально было показано, что при некоторых состояниях (травма, операция, наркоз) угнетается нейрогенный механизм, ведущими становятся метаболический и миогенный контуры регуляции [84]. В иных ситуациях миогенный механизм может подавлять метаболический.
Регуляторные контуры, лежащие в основе управления мозговым кровообращением, можно подразделить на дистанционные и местные. В дистанционных (нейрогенном и гуморальном) контурах элементы регуляторной цепи рассредоточены и находятся вне полости черепа. В местных (мио-генном и метаболическом) контурах они строго локализованы, и каналы передачи входных стимулов и управляющих воздействий полностью отсутствуют [85]. Кроме того, регуляторные контуры подразделяются по принципу природы входных стимулов: одни из них воспринимают физические, а другие — химические раздражители.
Деятельность системы регуляции мозгового кровообращения выражается в трех независимых феноменах: 1) ауторегуляции мозгового кровотока; 2) функциональной (рабочей) гиперемии; 3) зависимости кровотока через головной мозг от содержания газов в крови.
Ауторегуляция мозгового кровообращения представляет собой феномен независимости уровня мозгового кровотока от изменений в определенных пределах как артериального, так и венозного давления. Он может быть охарактеризован нижним и верхним пределами давления крови, между которыми средняя интенсивность мозгового кровотока сохраняется близкой к неизменной. У здорового человека нижний предел ауторегуляции составляет 60 мм рт.ст., а верхний — до 180 мм рт.ст. [87]. Время установления стабильного уровня давления составляет 2030 с, причем в этом промежутке выделены 3 фазы, указывающие на участие в ауторегуляции мозгового кровотока нескольких регуляторных контуров [88].
Феноменом функциональной гиперемии ткани головного мозга заключается в повышении уровня кровоснабжения активаторных его зон и в перераспределении кровотока между более и менее активи
рованными участками мозга. В зависимости от уровня функциональной активности нервной ткани ее кровоснабжение может увеличиваться с 30 до 180 мм/мин/100 г ткани. Латентный период местных сосудистых реакций составляет от 0,5 до 2,0 с, а максимальное значение кровотока достигается за 5-7 с [85].
В основе феномена функциональной гиперемии мозга лежит, по-видимому, ионный механизм, поскольку активация нервной ткани сопровождается быстрым высвобождением ионов калия. Это вызывает возрастание локального мозгового кровотока на 25-30%. Затем через несколько секунд снижается рН внеклеточной среды мозга с 7,3 до 7,0, что также вызывает рост кровотока до 40% [89]. Не исключено и участие в формировании феномена функциональной гиперемии головного мозга также нейрогенного механизма [86].
Изменение мозгового кровотока при сдвигах газового состава крови представляет сосудистую реакцию, направленную на сохранение условий для массопереноса газов от капилляров к нервной клетке (кислород) и от нервной клетки к капилляру (углекислый газ) по градиенту их концентраций. Наиболее критичным в этом плане является содержание СО2 в артериальной крови, поскольку от него зависит интенсивность вымывания углекислоты из ткани мозга.
Понижение напряжения СО2 в артериальной крови приводит к уменьшению концентрации ионов водорода в ткани мозга, что повышает тонус прекапиллярных сосудов благодаря снижению угнетающего влияния среды на миогенную активность. Мозговой кровоток при этом может уменьшиться почти вдвое по сравнению с нормой [20].
Суммарный мозговой кровоток практически не зависит от колебаний напряжения кислорода в артериальной крови. Он начинает возрастать лишь при падении рО2 ниже 30 мм рт.ст., а уменьшаться при росте содержания кислорода в атмосферном воздухе более чем в 2-3 раза [85].
Состояние системы мозгового кровообращения может быть охарактеризовано несколькими показателями. Основным среди них является мозговой кровоток, который отражает конечный результат как деятельности механизма регуляции мозгового кровообращения, так и центральной гемодинамики. В естественных условиях суммарный мозговой кровоток поддерживается в пределах от 50 до 60 мл/мин/100 г ткани, но при патологических состояниях может снижаться вдвое, причем степень этого снижения далеко не всегда коррелирует с состоянием больного. Известно критическое значение суммарного мозгового кровотока — 18-20 мл/ мин/100 г ткани [84], ниже которого в мозге наступают необратимые изменения.
Другим важным показателем, характеризующим состояние интракраниальной гемодинамики, является внутричерепное давление. Этот показатель в норме может колебаться от 8 до 16 см водного столба и при
обретает диагностическое значение при повышении до 20 см вод.ст., что указывает на нарушение проходимости ликворных пространств мозга. Определенное значение имеют пульсовые колебания внутричерепного давления, амплитуда и форма которых позволяют судить о состоянии механизма передачи энергии артериального пульса на венозный отток из полости черепа.
К функциональным показателям системы церебральной гемодинамики следует отнести кровенаполнение головного мозга. Широкое прямое измерение этого показателя в клинических условиях с использованием радионуклидной техники пока затруднительно, но уже много лет для этой цели достаточно успешно применяется метод реоэнцефаног- рафии (РЭГ). Этому методу посвящено большое количество публикаций, в том числе и критического характера, однако следует подчеркнуть,
 что РЭГ, хоть и косвенно, все же позволяет судить об изменении состояния мозговых сосудов и пульсового кровенаполнения мозга [90,91].
что РЭГ, хоть и косвенно, все же позволяет судить об изменении состояния мозговых сосудов и пульсового кровенаполнения мозга [90,91].
Суммируя изложенное, важно заключить, что многоуровневые механизмы регуляции надежно обеспечивают кровоснабжение головного мозга в самых разнообразных жизненных ситуациях, включая выживаемость организма в экстремальных условиях.
2.2.1 Ишемическая болезнь мозга
Среди причин смерти сосудистые заболевания головного мозга занимают третье место после сердечно-сосудистых заболеваний и опухолей. По данным ВОЗ, летальность от мозгового инсульта в экономически развитых странах составляет 30-35% летальности от всех сердечно-сосудистых заболева
ний.
Атеросклеротическое поражение сосудов, питающих головной мозг встречается у мужчин в 4 раза чаще, чем у женщин. Возраст большинства больных превышает 50 лет, но нередко это заболевание выявляется у лиц в возрасте 30-49 лет [92].
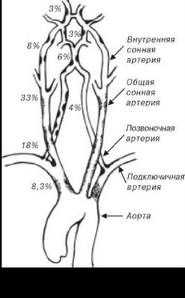
Принципиальной особенностью атеросклероза является то, что он поражает внечерепные отделы артерий головного мозга в 5 раз чаще, чем интракраниальные сосуды (рис. 2.6). Причем в большинстве случаев поражение артерий носит сегментарный, но не диффузный характер, и дистальные отделы сосуда остаются проходимыми.
Бифуркация общей сонной артерии вместе с начальным сегментом внутренней сонной артерии (ВСА) является местом наиболее частого и раннего развития атеросклероза. В лечебном (хирургическом) аспекте крайне важно то, что при стенозе внутренней сонной артерии атеросклеротическая бляшка обычно не доходит до основания черепа.
Обе сонные артерии поражаются одинаково часто. Устье общей сонной артерии стенозируется в 6-5% случаев. Проксимальные сегменты подключичных артерий поражаются в 6-12 % случаев, при этом левая подключичная артерия страдает в 3 раза чаще, чем правая.
В позвоночных артериях атеросклеротические бляшки обнаруживаются в 20% случаев. При этом у большинства больных они располагаются в области устья у места отхождения от подключичной артерии. Обычно обнаруживаются множественные поражения ветвей дуги аорты, но важно, что в подавляющем большинстве случаев эти поражения носят сегментарный характер [93].
Большая пластичность сосудов головного мозга, наличие анастомозов приводят к тому, что окклюзии сонной и позвоночной артерии могут протекать бессимптомно (вплоть до внезапного развития инсульта).
В компенсации мозгового кровообращения основное значение имеет состояние Виллизиева круга. Большую роль играют также темпы развития окклюзии, ее уровень, состояние коллатеральных путей кровотока и величина системного АД.
В патогенезе церебральной ишемии, наряду с нарушениями кровотока по магистральным артериям, большое значение имеют нарушения кровотока по интракраниальным ветвям вследствие их закупорки мик- роэмболами.
Нарушения мозгового кровообращения могут возникать и из-за специфических изменений регионарной гемодинамики. Так, синдром подключичного обкрадывания (“steal-syndrome”) возникает, если при проксимальной окклюзии подключичной артерии снижается АД в ее дистальном русле и кровь из позвоночной артерии, где АД нормальное, начинает оттекать в обратном направлении из мозга в подключичную артерию.
При окклюзии одной из артерий Виллизиева круга может наблюдаться синдром внутри- мозгового обкрадывания, когда применение сосудорасширяющих препаратов приводит к дилатации нормальных сосудов и увеличению притока крови в здоровых участках мозга, так как в зонах ишемии не отмечается нормальной реакции сосудов. В этой ситуации сосудосуживающие препараты могут вызывать улучшение кровоснабжения зоны ишемии за счет уменьшения перетока в неишемические отделы мозга.
 Такое явление получило название извращенного синдрома внутримозгового обкрадывания или “синдрома Робин Гуда”. Кроме того, в клинике наблюдаются варианты нарушения мозгового кровообращения в системе непораженной артерии за счет оттекания крови из нее в пораженный бассейн [93].
Такое явление получило название извращенного синдрома внутримозгового обкрадывания или “синдрома Робин Гуда”. Кроме того, в клинике наблюдаются варианты нарушения мозгового кровообращения в системе непораженной артерии за счет оттекания крови из нее в пораженный бассейн [93].
Начальные проявления недостаточности мозгового кровообращения характеризуются жалобами на головную боль, несистемные головокружения, ухудшение памяти, шум в голове, снижение умственной работоспособности. По мнению А.В.Покровского [93], если два или более из этих симптомов существуют более 3 мес, это является основанием для диагноза недостаточности мозгового кровообращения.
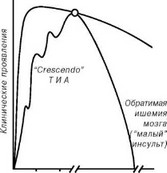
При преходящих нарушениях мозгового кровообращения, или тран- зитоных ишемических атаках (ТИА), наблюдаются быстро исчезающие очаговые или общемозговые симптомы ишемии головного мозга. Такие ТИА обычно представляют собой первое проявление сосудистой патологии мозга, являясь предвестником тяжелой мозговой катастрофы
- ишемического инсульта (рис. 2.7).
Симптомы преходящего нев-рологического дефицита различной тяжести при ТИА имеют разную продолжительность, но не превышают 24 часов. Описаны случаи, когда на протяжении одних суток у больных наблюдалось до 30 и более эпизодов ТИА, так называемые ТИА “crescendo”. Появление ТИА носит неблагоприятный прогностический характер, так как у 40% больных в ближайшие 5 лет развивается ишемический инсульт, причем наибольшая частота инсультов наблюдается в
первый год после первого эпизода ТИА [94].
Преходящие нарушения мозгового кровообращения в каротидном бассейне отмечаются в 3 раза реже, чем в вертебробазилярном. Это может быть объяснено большей площадью коры головного мозга и наличием в полушариях значительных по объему клинически “немых” зон. У таких “бессимптомных” больных с помощью компьютерной томографии часто выявляются кисты мозга, как следы перенесенных недиаг- ностированных инсультов [93]. Несмотря на такую скудость клинических симптомов, у 40% больных с каротидной окклюзией ретроспективно все же удается выявить ТИА в анамнезе [94].
Церебральная ишемия в большинстве случаев проявляется онеме- нением и преходящим парезом кисти или руки, гемипарезом, кратковременной слепотой на один глаз или афазией, дизартрией, гомолате- ральным синдромом Горнера, оптико-паретическими и другими синдромами. Важно заметить, что оптико-пирамидный синдром является па- тогномоничным для окклюзии ВСА.
Хроническая цереброваскулярная недостаточность (ХЦВН), или, по Е.В.Шмидту [87], дисциркуляторная энцефалопатия, в основе которой лежит медленно прогрессирующее нарушение кровоснабжения мозга, ведущее к постепенно нарастающим диффузным изменениям паренхимы мозга с расстройством мозговых функций, характеризуется головными болями, головокружениями, ухудшением памяти, снижением интеллекта, работоспособности, немотивированной дисфорией. При этом, однако, не отмечается четко очерченных ТИА и инсультов. В течение ХЦВН выделяют 3 стадии нарастающего неврологического дефицита, клиническая картина которого хорошо описана в литературе [87,92,150].
Преходящие эпизоды очаговой ишемии мозга в вертебробазилярном бассейне наблюдаются в 3 раза чаще, чем в каротидном. Однако ишемические инсульты в 8 раз чаще происходят именно в каротидном бассейне. Здесь крайне важно подчеркнуть, что у 75% больных ишемический инсульт в бассейне ВСА наступает внезапно и лишь у 1/3 больных инсульт развивается на фоне ранних жалоб на ТИА [93].
Особенностью ишемического инсульта является превалирование очаговых симптомов над общемозговыми. Отмечаются парезы и параличи контрлатеральных конечностей в сочетании с парезами лицевого и подъязычного нервов, нарушения чувствительности, гемианопсия, афазия. При ишемическом инсульте, как правило, не бывает глубокой комы. Кратко-временные выключения сознания в остром периоде инсульта считаются прогностически более благоприятными, чем постепенно нарастающие нарушения сознания. В случаях восстановления нарушенных мозговых функций в сроки до 3 нед говорят о малом инсульте [93].
Первичная диагностика (клиническая и физикальная) основывается на определении асимметрии пульсации периферических артерий,
асимметрии АД и аускультации сосудов.
При окклюзии общей сонной или безымянной артерий ни на сонной, ни на височной артерии на стороне поражения пульсация не определяется, однако при окклюзии ВСА пульсация височной артерии сохраняется и может быть даже усиленной.
Пульсация лучевой артерии может быть сохранена даже при полной закупорке подключичной артерии за счет развития синдрома подключичного обкрадывания и коллатерального кровообращения.
При поражении подключичной артерии отмечается снижение систолического АД до 80-90 мм рт.ст., пульсового давления — до 16-20 мм рт.ст.
В первичной диагностике поражения брахиоцефальных сосудов большое значение имеет аускультация. При стенозе сонных артерий систолический шум у угла нижней челюсти выслушивается у 75% больных [93]. При стенозе плечеголовного ствола систолический шум выявляется в правой подключичной ямке. Поражение подключичной артерии проявляется шумом позади проксимальной трети ключицы.
В инструментальной диагностике поражения сонных и позвоночных артерий основное значение в настоящее время имеют ультразвуковые методы исследования.
Ультразвуковая допплерография позволяет определить направление кровотока, измерить его скорость и выявить пути коллатерального кровообращения при проведении компрессионных проб.
При стенозировании ВСА менее 60% ее просвета линейная скорость кровотока по общей сонной артерии не меняется. По надблоковой артерии сохраняется антеградный кровоток, причем у 1/2 больных снижается скорость кровотока, на величину которого влияют состояние Виллизиева круга и контрлатеральной ВСА.
По мере прогрессирования стеноза ВСА до 90% у большинства больных регистрируется снижение кровотока по надблоковой артерии. Здесь важно отметить, что в 15-20% случаев полная окклюзия ВСА может протекать бессимптомно и оказаться случайной ультразвуковой находкой [151]. Диагностическая точность (чувствительность) ультразвуковой допплерографии при субтотальных стенозах ВСА достигает 90% [93].
Принцип метода ультразвукового В-сканирования заключается в том, что ультразвук отражается по-разному от акустически неоднородных тканей. Поскольку стенки артерий отражают ультразвук, они визуализируются на экране как яркие структуры, просвет сосуда выглядит темным.
Метод В-сканирования дает статическую картину состояния сосуда и не позволяет получить информацию о физиологических характеристиках кровотока.
Сравнительно недавно появился новый метод дуплексного сканирования, который сочетает изображение в В-режиме и импульсную доп
плеровскую методику. Преимуществом этого метода является возможность выявления гемодинамически не значимых стенозов сонных артерий, определения строения атеросклеротической бляшки, наличия кровоизлияния, изъязвления бляшки, пристеночного тромбоза.
Подробнее на методах ультразвукового исследования сосудов мы остановимся в следующей главе.
До настоящего времени не потеряла своего диагностического значения реоэнцефалография, с помощью которой при одностороннем поражении сонной артерии определяются признаки межполушарной асимметрии кровоснабжения мозга.
Для диагностики истинной степени ишемического поражения самой ткани головного мозга показана компьютерная томография, которая мо-
Таблица 2.4.
Клиническая дифференциальная диагностика мозгового инфаркта, кровоизлияния, опухоли и абсцесса мозга [94].
|
Инфаркт мозга |
Кровоизлияние (эпидуральная и субдуральная гематома) |
Опухоль мозга |
Абсцесс мозга |
|
Обычно предшествуют транзиторные ишемические атаки (ТИА) |
Обычно без ТИА |
Обычно без ТИА |
ТИА нет |
|
Чаще развивается в покое |
Чаще развивается при нагрузке,после травмы черепа |
Постепенно прогрессирует |
Постепенно прогрессирует |
|
Головная боль редко или умеренная |
Головная боль |
Головная боль |
Головная боль, менин- геальные симптомы |
|
Сочетается с другими признаками атеросклероза, болезнями сердца |
Системная гипертензия |
Если опухоль не метастатическая, то особенностей в сопутствующей патологии нет |
Общий воспалительный синдром: лихорадка, лейкоцитоз |
|
Очаговый неврологический дефицит, утрата функций с сохранением психического статуса |
Неврологический дефицит часто прогрессирует с углублением утраты сознания |
Признаки повышения внутричерепного давления. Люмбальная пункция принципиально противопоказана. |
|
|
Спиномозговая жидкость без изменения |
Спиномозговая жидкость часто с примесью крови |
Как правило, без изменений |
В ликворе признаки воспаления |
жет выявить последствия бессимптомного инсульта, атрофию коры головного мозга.
Для характеристики уровня метаболизма головного мозга оказываются полезными позитронная и магнитно-резонансная томография.
В последние годы широкое распространение получила цифровая вы- читательная ангиография, при которой предпочтение следует отдать селективной ангиографии с производством снимков в двух проекциях.
Атеросклероз брахиоцефальных сосудов приходится дифференцировать с поражением интракраниальных артерий головного мозга, при нарушении мозгового кровообращения вследствие изменений системной гемодинамики и при других заболеваниях. Основное внимание следует уделять выявлению очень быстро преходящих нарушений мозгового кровообращения (кратковременные периферические монопарезы, парестезии, затруднение речи, нарушения зрения и пр.). Наиболее важными являются данные аускультации, определение пульсации артерий, артериального давления, данные ультразвукового и ангиографического исследования.
Быстрое либо внезапное развитие неврологических симптомов может иметь место не только при атеросклерозе, но и при геморрагическом инсульте, опухоли, абсцессе мозга (табл. 2.4), которые также требуют проведения клинического дифференциально-диагностического поиска.
В лечении ХЦВН атеросклеротического генеза в настоящее время основное значение придают проведению постоянной дезагрегационной терапии аспирином, курантилом, тренталом. Одновременно проводят курсовое лечение (по 2-3 мес) другими препаратами сосудистого и метаболического действия, чередуя их (ангинин, продектин, стугерон, ком- пламин, аминалон, ноотропил).
Показания к оперативному лечению базируются на следующих положениях [93]:
- уменьшение кровоснабжения мозга, нарушающее его нормальное функ-ционирование, особенно в условиях нагрузки;
- наличие атеросклеротической бляшки, особенно с изъязвлением или пристеночным тромбозом, потенциально приводящее к микроэмболии сосудов головного мозга или тромбозу интракраниальных артерий.
Следует подчеркнуть, что при поражении ВСА операция показана не только для улучшения мозгового кровообращения при ее стенозе, но и для удаления источников микроэмболов, даже когда стеноз артерии умеренный и объем протекающей по ней крови остается нормальным.
Здесь же надо отметить, что ультразвуковое исследование сонных артерий является методом скринирующего отбора больных на хирургическое лечение, и, по мнению В.М.Шипулина [95], бессимптомные ате- ро-склеротические бляшки, стенозирующие просвет ВСА менее 50%,
но имеющие рыхлую или гетерогенную эхоструктуру, являются показанием для плановой каротидной эндартерэктомии с целью профилактики острых нарушений мозгового кровообращения.
Противопоказанием к операции является наличие острого инсульта, грубый неврологический дефицит после перенесенного инсульта, тромбоз дистального сосудистого русла, острый инфаркт миокарда. Возраст больных не является противопоказанием к операции, так же как и наличие других сопутствующих заболеваний: ИБС, ОААНК, артериальной гипертонии.
А так же в разделе «ФИЗИОЛОГИЯ И ПАТОФИЗИОЛОГИЯ МОЗГОВОГО КРОВООБРАЩЕНИЯ »
- ГИПОТЕЗЫ И ТЕОРИИ АТЕРОСКЛЕРОЗА
- ЛИПИДЫ И ЛИПОПРОТЕИНЫ ПЛАЗМЫ КРОВИ
- Дислипопротеинемия как основной патогенетический фактор атеросклероза
- 1.2.2. Другие факторы риска атеросклероза и ИБС
- ФУНКЦИОНАЛЬНАЯ МОРФОЛОГИЯ СОСУДИСТОЙ СТЕНКИ, ПУТИ ПРОНИКНОВЕНИЯ И ТКАНЕВОЙ ОБМЕН ЛИПИДОВ
- Морфогенез атеросклеротической бляшки
- АТЕРОСКЛЕРОЗ, АРТЕРИАЛЬНЫЕ СОСУДЫ И ВОЗРАСТ
- АТЕРОСКЛЕРОЗ И АРТЕРИАЛЬНАЯ ГИПЕРТОНИЯ
- АТЕРОСКЛЕРОЗ И САХАРНЫЙ ДИАБЕТ
- АТЕРОСКЛЕРОЗ И ГОРМОНЫ ЩИТОВИДНОЙ ЖЕЛЕЗЫ
- АТЕРОСКЛЕРОЗ И ПОЛОВЫЕ ГОРМОНЫ
- ПОБОЧНОЕ ВЛИЯНИЕ НЕКОТОРЫХ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ НА ЛИПИДНЫЙ СОСТАВ КРОВИ
- ГЛАВА 2 ИШЕМИЧЕСКИЙ СИНДРОМ - ОСНОВНОЙ ПАТОФИЗИОЛОГИЧЕСКИЙ ФЕНОМЕН АТЕРОСКЛЕРОЗА
- ФИЗИОЛОГИЯ И ПАТОФИЗИОЛОГИЯ КОРОНАРНОГО КРОВООБРАЩЕНИЯ
- Ишемическая болезнь сердца
- ФИЗИОЛОГИЯ И ПАТОФИЗИОЛОГИЯ ПЕРИФЕРИЧЕСКОГО КРОВООБРАЩЕНИЯ
- Ишемическая болезнь нижних конечностей
- СОЧЕТАННЫЕ ФОРМЫ АТЕРОСКЛЕРОЗА: ОСОБЕННОСТИ КЛИНИКИ, ДИАГНОСТИКИ И ЛЕЧЕНИЯ
- ГЛАВА 2. СПИСОК ЛИТЕРАТУРЫ