Если в учреждении не проводят микроскопические исследования на выявление кислотоустойчивых микобактерий, диагностический материал должен быть централизованно доставлен в лабораторию как можно быстрее (до момента отправления флаконы с материалом хранят в опечатываемом и запирающемся холодильнике). Каждая проба материала должна быть снабжена соответствующей этикеткой, а вся партия - сопроводительным бланком.
МИКРОСКОПИЧЕСКОЕ ИССЛЕДОВАНИЕ ДЛЯ ВЫЯВЛЕНИЯ КИСЛОТОУСТОЙЧИВЫХ МИКОБАКТЕРИИ
Для микроскопического исследования мазок приготавливают непосредственно из необработанного диагностического материала или осадка жидкого материала (метод прямой микроскопии), либо из материала, подготовленного путем гомогенизации, обеззараживания и центрифугирования {метод микроскопии мазка из осадка). Метод микроскопии мазка из осадка более информативен, поскольку обеспечивает обогащение материала за счет освобождения микробов из окружающей их слизи и их осаждения при центрифугировании.
При подозрении на туберкулез органов дыхания необходимо исследовать не менее трех проб мокроты, поскольку результативность микроскопической диагностики повышается при исследовании второго мазка на 10-14%, а при исследовании третьего мазка - еще на 5-8%.
Отрицательный результат микроскопического исследования не исключает диагноз туберкулеза, так как в мокроте большинства больных содержится меньше микобактерии, чем может выявить микроскопия.
Микроскопия мазка, окрашенного по методу Циля-Нельсена, является наиболее распространенным методом выявления кислотоустойчивых микобактерии. Приготовление мазка включает фиксацию, окраску фуксином (при нагревании и действии карболовой кислоты краситель проникает в микробную клетку, особенно в клеточную стенку), обесцвечивание (в 25% растворе H2S04 или 3% растворе солянокислого спирта обесцвечивается краситель, проникший в структуры, не обладающие достаточной кислотоустойчивостью), контрастирующую окраску (метиленовым синим для придания препарату контрастности).
Окрашенные по Цилю-Нельсену мазки исследуют с помощью светового микроскопа (бинокулярного или оснащенного бинокулярной насадкой). Кислотоустойчивые микобактерии туберкулеза (1-10 мкм в длину и 0,2-0,6 мкм в ширину) видны обычно в виде тонких изящных палочек (иногда изогнутых или извитых) малиново-красного цвета, содержащих различное количество гранул. Они располагаются по одиночке, парами или в виде групп и хорошо выделяются на голубом фоне препарата {см. рис. 2). Характерным считается расположение бактериальных клеток в виде римской цифры «V». Внутри микробных клеток можно обнаружить более интенсивно окрашенные участки, что делает их похожими на «бусы» (слабо окрашенные участки видны в виде «полос»).
При выявлении измененных форм возбудителя (скопления кислотоустойчивых зерен, округлые, L-трансформированные или ветвистые мицелиеподобные структуры) положительный ответ об обнаружении кислотоустойчивых микроорганизмов должен быть подтвержден дополнительными методами исследования, иначе результат должен быть расценен как отрицательный.
Различную степень кислотоустойчивой окраски можно наблюдать и у других микроорганизмов (Rhodococcus, Nocardia, Legionella, цисты Cryptosporidium и Isospora), которые могут иметь различные формы - от длинных палочек до кокковых форм с различной интенсивностью окрашивания. Быстрорастущие микобактерии могут отличаться по степени кислотоустойчивой окраски, при частичной ее потере они приобретают фиолетово-малиновый цвет.
Количество обнаруженных при микроскопии кислотоустойчивых микобактерий является важным показателем степени эпидемической опасности больного и тяжести заболевания. Поэтому результат исследования должен быть не только качественным, но и содержать количественную оценку. При использовании объектива 90х или 100х и окуляра 7х-10х (общее увеличение = бЗОх-ЮООх) используется следующая градация результатов световой микроскопии:
- единичные в препарате Точное число
- единичные микобактерии в поле зрения +
- умеренное количество микобактерии ++
- значительное количество микобактерии + + +
Рис.2
M.tuberculosis в мокроте, окраска по Цилю-Нельсену
(по Многотомному руководству по туберкулезу. Том 1.
Общие проблемы туберкулеза.
Под ред. В.Л. Эйниса, А.И. Струкова. - М.: Медгиз, 1959).
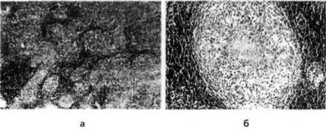
Морфологические изменения при туберкулезе
(биоптат шейного лимфатического узла):
а - нечетко очерченные, разновеликие, сливающиеся между собой эпителиоцлдоклеточные гранулемы (увеличение 160х); б - эпителиоиддо-гигантоклеточная гранулема с казеозным некрозом в центре (увеличение 200х)
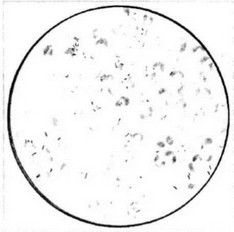
Люминесцентная микроскопия основана на том, что специальные красители (аурамин, родамин и др.) связываются с воскоподобными структурами M.tuberculosis и окрашенные клетки при ультрафиолетовом облучении определенного спектра начинают светиться оранжевым или ярко-красным светом на черном или темно-зеленом фоне. Образующийся за счет свечения ореол увеличивает видимые размеры клеток, поэтому люминесцентную микроскопию можно проводить при увеличении 250х-450х, что увеличивает поле зрения и существенно сокращает время, необходимое для просмотра мазка. Поиск микобактерий облегчает также значительная резкость и контрастность картины, что особенно ценно при исследовании олигобациллярного материала. По чувствительности люминесцентная микроскопия, особенно в сочетании с методом обогащения диагностического материала (микроскопия осадка), незначительно уступает методу посева, но применение ее целесообразно в лабораториях, выполняющих большое число исследований (50 и более ежедневно).
При количественной интерпретации результатов следует учитывать, что поле зрения люминесцентного микроскопа значительно больше по площади, чем у светового микроскопа.
Во всех сомнительных случаях мазок, окрашенный люминесцентными красителями, следует исследовать повторно, перекрасив его по Цилю- Нельсену.
