I. СКЕЛЕТНАЯ МЫШЕЧНАЯ ТКАНЬ
У человека более 600 скелетных мышц (около 40% массы тела). Скелетная мышечная ткань обеспечивает осознанные и осознаваемые произвольные движения тела и его частей. Основные гистологические элементы: скелетные мышечные волокна (функция сокращения), клетки-сателлиты (камбиальный резерв).
А. Развитие скелетных мышц. Источник развития гистологических элементов скелетной мышечной ткани — миотомы, откуда выселяются и мигрируют в места закладки конкретных мышц самые ранние клетки миогенного клеточного типа — клетки миотомов. Миогенный клеточный тип в эмбриогенезе последовательно складывается из следующих гистологических элементов: клетки миотома (миграция) -»• миобласты митотические (пролиферация) -gt; миобласты постмитотические (слияние) -gt; мышечные трубочки (синтез сократительных белков, формирование саркомеров) -» мышечные волокна (функция сокращения). В области закладки мышц уже присутствуют клетки мезенхимы — источник соединительнотканных структур мышцы, сюда прорастают кровеносные капилляры, а позднее (при образовании мышечных трубочек) — аксоны двигательных и чувствительных нейронов соматического отдела нервной системы.
- Клетки миотомов при их выселении из сомитов уже детерминированы в направлении образования миогенных элементов. Дефекты миграции клеток миотома, а также сбои при взаимодействии разных клеточных элементов в ходе миогенеза приводят к аномальному развитию скелетных мышц.
- Миобласты
а. Митотические миобласты (Gj-миобласты) последовательно проходят ряд завершающихся митозами клеточных циклов (пролиферативные митозы). На этой стадии часть
- -миобластов обособляется в виде клеток-сателлитов.
б. Постмитотические миобласты (Gg-миобласты) — клетки, необратимо вышедшие из клеточного цикла (результат квантального митоза) и уже начавшие синтез сократительных белков. Gg-миобласты сливаются и образуют симпласты — миотубы.
- Мышечная трубочка (миотуба) — цепочка слившихся миобластов, в которой ядра занимают центральное положение. В мышечных трубочках происходит терминальная миогенная дифференцировка: синтез контрактильных белков, сборка сократительных структур — миофибрилл (появляется поперечная исчерченность). Перемещение ядер симпласта на периферию завершает формирование поперечнополосатого мышечного волокна.
- Мышечное волокно — дефинитивная форма скелетномышечного миогенеза, выполняющая функцию мышечного сокращения (см. I Б). Разные типы мышечных волокон рассмотрены в I Д, их фенотипы — в I Е.
- Клетки-сателлиты — обособившиеся в ходе миогенеза 0,-миобласты, расположенные между базальной мембраной и плазмолеммой мышечных волокон. Ядра этих клеток составляют 10% суммарного количества ядер скелетного мышечного волокна. Клетки- сателлиты — камбиальный резерв мышечной ткани скелетного типа. Они сохраняют способность к миогенной дифференцировке (миобласты -» миотубы -gt; мышечные волокна) в течение всей жизни, что обеспечивает увеличение массы мышечных волокон. Клетки-сателлиты также участвуют в репаративной регенерации скелетной мышечной ткани (см. I Ж).
- Маркёры миогенного клеточного типа.
а. Миогенные факторы (в т.ч. миогенин и MyoD) — регуляторные факторы миогенеза, экспрессируются только в гистологических элементах скелетной мышцы на разных стадиях миогенеза. Миогенин и MyoD — факторы транскрипции специфичных для миогенного клеточного типа генов.
б. Десмин — мышечноспецифический белок класса промежуточных филаментов цитоскелета. Десмин найден в гистологических элементах всех мышечных тканей. В скелетномышечном миогенезе десмин начинает экспрессироваться в цитоплазме миобластов, а с началом миофибриллогенеза десминовые нити вплетаются в Z-диски или их аналоги в ГМК (плотные пятна). При различных миопатиях происходит накопление десмина в саркоплазме.
в. Контрактильные белки актомиозинового хемомеханического преобразователя — миозины, актины, тропонины, тропомиозины, а также вспомогательные белки тонких (актиновых), толстых (миозиновых) нитей миофибрилл и Z-дисков.
г. Креатинфосфокиназа (КФК)
д. Миоглобин
Б. Скелетное мышечное волокно
- Общая характеристика. Структурно-функциональная единица скелетной мышцы — симпласт — скелетное мышечное волокно (рис. 7-1, 7-16), имеет форму протяжённого цилиндра с заострёнными концами. Этот цилиндр достигает в длину 40 мм при диаметре до 0,1 мм. Термин оболочка волокна (сарколемма) относят к двум структурам: плазмолемма симпласта и его базальная мембрана. Между плазмолеммой и базальной мембраной расположены овальной формы ядра клеток-сателлитов. Палочковидной формы ядра мышечного волокна лежат в миоплазме (саркоплазма) под плазмолеммой. В саркоплазме симпласта расположены контрактильный аппарат — миофибриллы, депо Ca2+ — саркоплазматическая сеть, энергетические станции — митохондрии, включения (гранулы гликогена). От поверхности мышечного волокна к расширенным участкам саркоплазматического ретикулума направляются трубковидные впячивания сарколеммы — поперечные трубочки (Т-трубочки). Рыхлая волокнистая
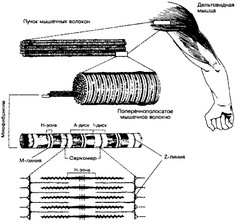
Рис. 7-1. Скелетная мышца состоит из поперечнополосатых мышечных волокон. Значительный объём волокон занимают миофибриллы. Расположение светлых и тёмных дисков в параллельных друг другу миофибриллах совпадает, что приводит к появлению поперечной исчерченности. Структурная единица миофибрилл — саркомер, сформированный из толстых и тонких нитей [из Bloom W FawsettDW, 1968]
соединительная ткань между отдельными мышечными волокнами (эндомизий) содержит кровеносные и лимфатические сосуды, нервные волокна. Группы мышечных волокон и окружающая их в виде чехла волокнистая соединительная ткань (перимизий) формируют пучки. Их совокупность образует мышцу, плотный соединительнотканный чехол которой именуют эпимизий.
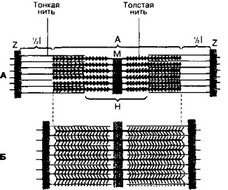
- Миофибриллы. Поперечная исчерченность скелетного мышечного волокна определяется регулярным чередованием в миофибриллах различно преломляющих поляризованный свет участков (дисков) — изотропных и анизотропных: светлые (Isotropic, 1-диски) и тёмные (Anisotropic, A-диски) диски. Разное светопреломление дисков определяется упорядоченным расположением по длине саркомера тонких и толстых нитей; толстые нити находятся только в тёмных дисках, светлые диски не содержат толстых нитей. Каждый светлый диск пересекает Z-линия. Участок миофибриллы между соседними Z- линиями определяют как саркомер.
- Саркомер (рис. 7-1, 7-8) — структурно-функциональная единица миофибриллы, расположенная между соседними Z-линиями. Саркомер образуют расположенные параллельно друг другу тонкие (актиновые) и толстые (миозиновые) нити. I-диск содержит только тонкие нити. В середине I-диска проходит Z-линия. Один конец тонкой нити прикреплён к Z-линии, а другой конец направлен к середине саркомера. Толстые нити занимают центральную часть саркомера — A-диск. Тонкие нити частично входят между толстыми. Содержащий только толстые нити участок саркомера — Н-зона. В середине Н-зоны проходит М-линия. I-диск входит в состав двух саркомеров. Следовательно, каждый саркомер содержит один A-диск (тёмный) и две половины I-диска (светлого), формула саркомера — Ч А + I + Ч А.
а. Толстая нить. Каждая миозиновая нить состоит из 300-400 молекул миозина и С-белка. Миозин — гексамер (две тяжёлые и четыре лёгкие цепи). Тяжёлые цепи — две спирально закрученные полипептидные нити, несущие на своих концах глобулярные головки. В области головок с тяжёлыми цепями ассоциированы лёгкие цепи. Каждую миозиновую нить связывает с Z-линией гигантский белок титин.
- Миозин (рис. 7-2). В молекуле миозина различают тяжёлый и лёгкий меромио- зин. Тяжёлый меромиозин содержит субфрагменты (S): S1 содержит глобулярные головки миозина, S2 — прилежащую к головкам часть фибриллярного хвоста молекулы миозина. S2 эластичен (эластический компонент S2), что допускает отхождение S1 на расстояние до 55 нм. Концевую часть хвостовой нити миозина длиной 100 нм образует лёгкий меромиозин. Миозин имеет два шарнирных участка, позволяющих молекуле изменять конформацию. Один шарнирный участок находится в области соединения тяжёлого и лёгкого меромиозинов, другой — в области шейки молекулы миозина (S1-S2 соединение). Половина молекул миозина обращена головками к одному концу нити, а вторая половина — к другому (рис. 7-3). Лёгкий меромиозин лежит в толще толстой нити, тогда как тяжёлый меромиозин (благодаря шарнирным участкам) выступает на её поверхность.
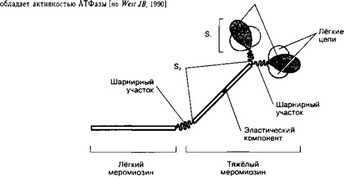
Рис. 7-2. Молекула миозина. Лёгкий меромиозин обеспечивает агрегацию молекул миозина, тяжёлый меромиозин имеет связывающие актин участки и
Г оловки миозина
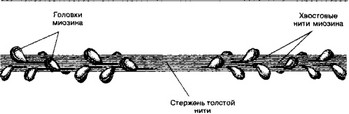
Рис. 7-3. Толстая нить. Молекулы миозина способны к самосборке и формируют веретенообразный агрегат диаметром 15 нм и длиной 1,5 мкм. Фибриллярные хвосты молекул образуют стержень толстой нити, головки миозина расположены спиралями и выступают над поверхностью толстой нити [из Ham AW, Cormack DH, 1979]
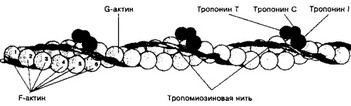
Рис. 7-4. Тонкая нить — две спирально скрученные нити F-актина. В канавках спиральной цепочки залегает двойная спираль тропомиозина, вдоль которой располагаются молекулы тропонина [из Jun- queira LC, CameiroJ, 1991]
- Титин — наибольших размеров полипептид (из известных) с Mr 3000 кД — наподобие пружины связывает концы толстых нитей с Z-линией. Другой гигантский белок — небулин (Mr 800 кД) — ассоциирует тонкие и толстые нити.
- С-белок стабилизирует структуру миозиновых нитей. Влияя на агрегацию молекул миозина, обеспечивает одинаковый диаметр и стандартную длину толстых нитей.
- Миомезин (М-белок), КФК — белки, ассоциированные с толстыми нитями в середине тёмного диска. КФК способствует быстрому восстановлению АТФ при сокращении. Миомезин выполняет организующую роль при сборке толстых нитей.
б. Тонкая нить состоит из актина, тропомиозина и тропонинов (рис. 7-4).
- Актин. Молекулы глобулярного актина (G-актин) полимеризуются и образуют фибриллярный актин (F-актин). В состав тонкой нити входят две спирально закрученные цепочки F-актина.
- Тропомиозин состоит из двух полипептидных цепей и имеет конфигурацию двойной спирали. Полярные молекулы тропомиозина длиной 40 нм укладываются конец в конец в желобке между двумя спирально закрученными цепочками F-актина.
- Тропонин (Tn) — комплекс, образованный тремя глобулярными CE: TnT1 TnI1 TnC. TnT имеет участки для связи с тропомиозином. TnC — Са2+-связывающий белок. TnI препятствует взаимодействию актина с миозином. Тропониновый комплекс прикреплён к молекулам тропомиозина с интервалами 40 нм.
- а-Актинин, десмин и виментин — белки, ассоциированные с тонкими нитями; они входят в состав Z-линии, в которую вплетён один конец тонкой нити; второй конец расположен между толстыми нитями и ассоциирован с ними при помощи небулина.
- Саркоплазматнческая сеть. Каждая миофибрилла окружена регулярно повторяющимися по её длине (точнее, по длине саркомера) элементами саркоплазматического ретикулума — анастомозирующими мембранными трубочками, заканчивающимися терминальными цистернами (рис. 7-5). На границе между дисками А и I две терминальные цистерны соседних повторов контактируют с Т-трубочками (триады). Саркоплазмати- ческий ретикулум — модифицированная гладкая эндоплазматическая сеть, выполняющая функцию депо кальция. Са2+-транспортирующие АТФазы саркоплазматического ретикулума откачивают ионы кальция из саркоплазмы. Са2*-связывающий белок кальсеквестрин находится внутри саркоплазматической сети. Кальциевые каналы, образованные рецепторами рианодина, высвобождают Ca2+ из депо в саркоплазму.
- Т-трубочки. Сарколемма мышечного волокна образует множество узких впячиваний — поперечных трубочек (Т-трубочки). Они проникают внутрь мышечного волокна и, залегая между двумя терминальными цистернами саркоплазматического ретикулума, вместе с последними формируют триады. В триадах происходит передача возбуждения в виде потенциала действия плазматической мембраны мышечного волокна на мембрану терминальных цистерн — сопряжение возбуждения и сокращения: дигидропиридино- вые рецепторы Т-трубочек регистрируют изменения мембранного потенциала (дУ) и активируют рианодиновые рецепторы саркоплазматической сети (Са2+-канал).
В. Иннервация. Двигательная и чувствительная соматическая иннервация скелетных мышц (мышечных волокон) осуществляется соответственно а- и у-мотонейронами передних рогов спинного мозга и двигательных ядер черепных нервов и псевдоуниполярными чувствительными нейронами спинномозговых узлов и чувствительных ядер черепных нервов. Вегетативная иннервация гистологических элементов скелетных мышц не обнаружена, но ГМК стенки кровеносных сосудов мышц имеют симпатическую адренергическую иннервацию.
- Двигательная иннервация. В скелетных мышцах соответственно характеру иннервации принято различать два типа мышечных волокон: экстрафузальные и интрафузаль- ные. Каждое экстрафузальное мышечное волокно имеет прямую двигательную иннервацию — нервно-мышечные синапсы, образованные терминальными ветвлениями аксонов а-мотонейронов и специализированными участками плазмолеммы мышечного волокна (концевая пластинка, постсинаптическая мембрана). Интрафузальные мышечные волокна (см. главу 8.2 III А 8 а) образуют нервно-мышечные синапсы с эфферентными волокнами у-мотонейронов. Мышечные волокна входят в состав нейро- моторных (двигательных) единиц и обеспечивают сократительную функцию мышц.
а. Нейромоторная единица включает один мотонейрон и группу иннервируемых им экстрафузальных мышечных волокон. Количество и размеры двигательных единиц в различных мышцах значительно варьируют. Поскольку при сокращении фазные мышечные волокна подчиняются закону всё или ничего, то сила, развиваемая мышцей, зависит от количества активируемых (т.е. участвующих в сокращении мышечных волокон) двигательных единиц. Каждая нейромоторная единица образована только быстросокращающимися или только медленносокращающимися мышечными волокнами (см. I Д I б).
б. Полинейронная иннервация. Формирование нейромоторных единиц происходит в постнатальном периоде, а до рождения мышечные волокна имеют полинейронную иннервацию, когда каждое мышечное волокно иннервируется несколькими мотонейронами. Аналогичная ситуация возникает при денервации (например, при повреждении
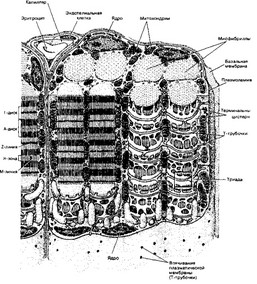
Рис. 7-5. Фрагмент скелетного мышечного волокна. Цистерны саркоплазматического ретику- лума окружают каждую миофибриллу. Т-трубочки подходят к миофибриллам на уровне границ между тёмными и светлыми дисками и вместе с терминальными цистернами саркоплазматического ретихулума образуют триады. Между миофибриллами залегают митохондрии (из Kopf-Maier Р, Merker H-J, 1989]
нерва) с последующей реиннервацией мышечных волокон. Понятно, что в этих ситуациях страдает эффективность сократительной функции мышцы.
- Чувствительная иннервация
а. Интрафузальные мышечные волокна вместе с чувствительными нервными окончаниями формируют мышечные веретёна — рецепторы скелетной мышцы (см. главу 8 2 III А 8 а).
б. Сухожильный орган Гольджи (глава 8.2 III А 8 б)
Г. Сокращение мышцы происходит при поступлении по аксонам двигательных нейронов к нервно-мышечным синапсам волны возбуждения в виде нервных импульсов (потенциалы действия нервных волокон). Это непрямое сокращение (опосредованное нервно-мышечной синаптической передачей возбуждения). Возможно и прямое сокращение мышцы. Под ним понимают сокращение групп мышечных волокон, происходящее при возбуждении любого звена последовательности событий после секреции нейромедиатора из термина- лей аксона в нервно-мышечном синапсе (см. главу 8.2 III Б I). Прямое сокращение мышцы (например, мышечные подёргивания, или фибрилляции) — всегда патология.
- Нервно-мышечный синапс и деполяризация постсинаптической мембраны. Возбуждение мотонейрона приводит к секреции ацетилхолина из терминалей аксона в синаптическую щель. Ацетилхолин связывается с его рецепторами (никотиновые холинорецепторы мышечного типа, н-холинорецепторы), вмонтированными в постси- наптическую мембрану мышечного волокна (плазмолемма). Результат взаимодействия — деполяризация мембраны мышечного волокна, т.к. при взаимодействии нейромедиатора с холинорецептором открывается ионный канал в составе рецептора. Взаимодействие рецептора и ацетилхолина кратковременно, т.к. присутствующая в синапсе аце- тилхолинэстераза гидролизует нейромедиатор. Нарушения в любом звене нервно-мышечной передачи приводят к искажениям мышечного сокращения.
а. Ботулинический и столбнячный нейротоксины, (3- и у-бунгаротоксины блокируют секрецию ацетилхолина.
б. Карбахолин усиливает секрецию ацетилхолина.
в. Миорелаксанты периферического действия (кураре и курареподобные препараты) широко применяются в анестезиологии. Тубокурарин препятствует деполяризующему действию ацетилхолина. Дитилин приводит к миопаралитическому эффекту, вызывая стойкую деполяризацию постсинаптической мембраны.
г. Денервация. При двигательной денервации происходит значительное увеличение чувствительности мышечных волокон к эффектам ацетилхолина вследствие увеличенного синтеза рецепторов ацетилхолина и их встраивания в плазмолемму по всей поверхности мышечного волокна.
д. Фосфорорганические соединения (ФОС), прозерин, физостигмин, галан- тамин инактивируют ацетилхолинэстеразу.
е. Миастения тяжёлая псевдопаралитическая (myasthenia gravis). При этом заболевании циркулирующие в крови AT к холинорецепторам угнетают их функцию (страдает нервно-мышечная передача, развивается мышечная слабость).
ж. а-Бунгаротоксин блокирует холинорецепторы.
- Плазмолемма и потенциал действия. Локальная деполяризация постсинаптической мембраны приводит к генерации потенциала действия, быстро распространяющегося по всей плазмолемме мышечного волокна (включая Т-трубочки).
а. Электромиография — важный диагностический метод — позволяет регистрировать характеристики потенциалов действия.
б. Ионные каналы, обеспечивающие развитие потенциала действия, рассмотрены в главе 2 I В I б (2).
в. Миотония. Уменьшение СГ-проводимости плазмолеммы ведёт к электрической нестабильности мембраны мышечных волокон и развитию миотонии (например, болезни Томсена).
- Триады и передача сигнала на саркоплазматическую сеть. Волна деполяризации по Т-трубочкам проникает до триад. В области триад мембрана Т-трубочек в составе потенциалзависимого кальциевого канала содержит рецепторы дигидропиридина. Деполяризация мембраны Т-трубочек вызывает в структуре рецепторов дигидропиридина конформационные изменения, передающиеся на рецепторы рианодина терминальных цистерн саркоплазматического ретикулума.
Злокачественная гипертермия при наркозе (особенно при использовании тиопентала и гало- тана) — редкое осложнение (смертность до 70%) при хирургическом вмешательстве. Температура тела быстро поднимается до 43 °С и выше, происходит генерализованный рабдомиолиз. В части случаев найдена мутация гена рианодинового рецептора скелетномышечного типа.
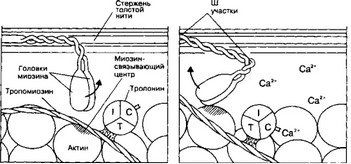
- Саркоплазматический ретикулум и выброс Ca2*. Активация рецепторов рианодина (Са2+-канал) приводит к открытию Са2+-каналов, Ca2+ из Са2+-депо (саркоплазматичес- кая сеть) поступает в саркоплазму; концентрация Ca2+ в саркоплазме достигает значений, достаточных для связывания этого двухвалентного катиона с тропонином С (TnC) тонких нитей.
- Связывание Ca2+ тонкими нитями. В покое взаимодействие тонких и толстых нитей невозможно, т.к. миозинсвязывающие участки молекул актина заблокированы тропоми- озином. При высокой концентрации Ca2+ эти ионы связываются с TnC и вызывают конформационные изменения тропомиозина, приводящие к разблокированию миозинсвязы- вающих участков (рис. 7-6).
- Взаимодействие тонких и толстых нитей. В результате разблокирования мио- зинсвязывающих участков молекул актина головки миозина присоединяются к тонкой нити и изменяют свою конформацию, создавая тянущее усилие — тонкие нити начинают скользить между толстыми.
Шарнирные
Рис. 7-6. Са2*-зависнмый механизм регуляции взаимодействия актина с миозином. В покое миозинсвязывающие участки тонкой нити заняты тропомиозином. При сокращении ионы Cazt связываются с ТпС, а тропомиозин открывает миозинсвязывающие участки. Головки миозина присоединяются к тонкой нити и вызывают её смещение относительно толстой нити [по von Ganong ЖР (1979) из Junqueira LC, Cameiro J, 1991)
Модель скользящих нитей была предложена Хью Хаксли. Скольжение тонких нитей относительно толстых обеспечивает чередование рабочих циклов. Каждый цикл имеет несколько стадий (рис. 7-7).
- Головка миозина, несущая продукты гидролиза АТФ (АДФ + Pi), прикрепляется к миозинсвязывающим участкам актиновой нити.
- Головка миозина изменяет конформацию; за счёт шарнирного участка в области шейки миозина происходит гребковое движение, продвигающее тонкую нить к центру саркомера.
- Головка миозина связывается с молекулой АТФ, что приводит к отделению миозина от актина. Последующий гидролиз АТФ восстанавливает конформацию молекулы миозина, и она оказывается готовой вступить в новый цикл.
- Укорочение саркомера и сокращение мышечного волокна. Головка миозина совершает около пяти циклов в секунду. Когда одни головки миозина толстой нити производят тянущее усилие, другие в это время свободны и готовы вступить в очередной цикл. Следующие друг за другом гребковые движения стягивают тонкие нити к центру саркомера. Скользящие тонкие нити тянут за собой Z-линии, вызывая сокращение саркомера (рис. 7-8). Поскольку в процесс сокращения практически одномоментно вовлечены все саркомеры мышечного волокна, происходит его укорочение.
- Расслабление. Са2*-АТФаза саркоплазматического ретикулума закачивает Ca2+ из саркоплазмы в цистерны ретикулума, где Ca2+ связывается с кальсеквестрином. При низкой саркоплазматической концентрации Ca2* тропомиозин закрывает миозинсвязыва- ющие участки и препятствует их взаимодействию с миозином. После смерти, когда содержание АТФ в мышечных волокнах снижается вследствие прекращения её синтеза, головки миозина оказываются устойчиво прикреплёнными к тонкой нити. Это состояние трупного окоченения (rigor mortis) продолжается, пока не наступит аутолиз, после чего мышцы можно растянуть.
- Энергетические потребности. Мышечное сокращение требует значительных энергетических затрат. Основной источник энергии — гидролиз макроэрга АТФ.
а. Митохондрии мышечного волокна имеют удлинённую форму и располагаются в миоп- лазме параллельно миофибриллам. В митохондриях происходят процессы цикла трикар- боновых кислот и окислительного фосфорилирования, что приводит к генерации АТФ.
б. Гликоген запасается в саркоплазме в виде включений. Анаэробный гликолиз сопряжён с синтезом АТФ.
в. Креатинфосфокиназа, связанная в области М-линии, катализирует перенос фосфата от фосфокреатина на АДФ с образованием креатина и АТФ.
г. Миоглобнн. Этот пигментный белок, как и Hb, обратимо связывает кислород. Запасы кислорода необходимы для синтеза АТФ при длительной непрерывной работе мышцы.
Д. Классификации типов мышечных волокон и скелетных мышц. Скелетные мышцы и образующие их мышечные волокна различаются по множеству параметров: скорости сокращения, утомляемости, диаметру, цвету и т.д. Например, цвет мышцы может быть обусловлен рядом причин: количеством митохондрий, содержанием миоглобина, плотностью кровеносных капилляров. Традиционно выделяют красные и белые, а также медленные и быстрые мышцы и волокна. Другими словами, существует множество классификаций мышц и мышечных волокон. Каждая мышца — гетерогенная популяция разных типов мышечных волокон. Тип мышцы определяют, исходя из преобладания в ней конкретного типа мышечных волокон.
- Критерии классификации. На практике важны следующие классифицирущие критерии типов мышечных волокон: характер сокращения (а), скорость сокращения
(б), тип окислительного обмена (в).
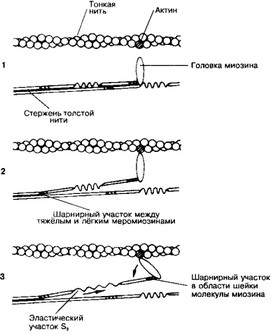
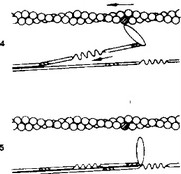 Рис. 7-7. Цикл скольжения тонких нитей относительно толстых. Тяжёлый меромиозин лежит на поверхности толстой нити (I). Благодаря шарнирному участку между тяжёлым и лёгким меромиози- ном, несущая АДФ и Р. головка миозина прикрепляется к актину (2), происходит поворот головки миозина с одновременным растягиванием эластического компонента S2 (3). Из головки освобождаются АДФ и Р., а последующая ретракция эластического компонелта S, вызывает тянущее усилие (4). Затем к головке миозина присоединяется новая молекула АТФ, что приводит к отделению головки миозина от молекулы актина. Гидролиз АТФ возвращает молекулу миозина в исходное положение (5) [из WestJB, 1990]
Рис. 7-7. Цикл скольжения тонких нитей относительно толстых. Тяжёлый меромиозин лежит на поверхности толстой нити (I). Благодаря шарнирному участку между тяжёлым и лёгким меромиози- ном, несущая АДФ и Р. головка миозина прикрепляется к актину (2), происходит поворот головки миозина с одновременным растягиванием эластического компонента S2 (3). Из головки освобождаются АДФ и Р., а последующая ретракция эластического компонелта S, вызывает тянущее усилие (4). Затем к головке миозина присоединяется новая молекула АТФ, что приводит к отделению головки миозина от молекулы актина. Гидролиз АТФ возвращает молекулу миозина в исходное положение (5) [из WestJB, 1990]
Рис. 7-8. Саркомер расслабленного (А) и сокращённого (Б) мышечного волокна. При сокращении тонкие нити движутся к центру саркомера, их свободные концы сходятся у М-линии. Вследствие этого уменьшается длина I-дисков и Н-зоны. Длина А-диска не изменяется [по Schultz Е, Lebbnd CP из Ham AW, Cormack DH, 19791
 а. Фазные и тонические. Экстрафузальные мышечные волокна подразделяют на фазные, осуществляющие энергичные сокращения, и тонические, специализирующиеся на поддержании статического напряжения, или тонуса. Произвольная мускулатура человека практически полностью состоит из фазных мышечных волокон, генерирующих потенциалы действия. В ответ на нервную стимуляцию они отвечают быстрым сокращением. Тонические мышечные волокна встречаются лишь в наружных ушных и наружных глазных мышцах. Тонические мышечные волокна имеют более низкий потенциал покоя (от -50 до -70 мВ). Степень деполяризации мембраны зависит от частоты стимуляции, поэтому лишь повторные нервные стимулы вызывают сокращение тонических волокон. Тонические мышечные волокна имеют полинейронную иннервацию.
а. Фазные и тонические. Экстрафузальные мышечные волокна подразделяют на фазные, осуществляющие энергичные сокращения, и тонические, специализирующиеся на поддержании статического напряжения, или тонуса. Произвольная мускулатура человека практически полностью состоит из фазных мышечных волокон, генерирующих потенциалы действия. В ответ на нервную стимуляцию они отвечают быстрым сокращением. Тонические мышечные волокна встречаются лишь в наружных ушных и наружных глазных мышцах. Тонические мышечные волокна имеют более низкий потенциал покоя (от -50 до -70 мВ). Степень деполяризации мембраны зависит от частоты стимуляции, поэтому лишь повторные нервные стимулы вызывают сокращение тонических волокон. Тонические мышечные волокна имеют полинейронную иннервацию.
б. Быстрые и медленные. Скорость сокращения мышечного волокна определяется типом миозина. Изоформа миозина, обеспечивающая высокую скорость сокращения, — быстрый миозин (в частности, характерна высокая активность АТФазы), изоформа миозина с меньшей скоростью сокращения — медленный миозин (в частности, характерна меньшая активность АТФазы). Следовательно, активность АТФазы миозина отражает скоростные характеристики скелетной мышцы. Мышечные волокна, имеющие высокую активность АТФазы, — быстросокращающиеся волокна (быстрые волокна), для медленносокращающихся волокон (медленные волокна) характерна низкая АТФазная активность.
в. Окислительные и гликолитические Мышечные волокна используют окислительный либо гликолитический путь образования АТФ. В ходе аэробного окисления из одной молекулы глюкозы образуются 38 молекул АТФ и конечные продукты метаболизма — вода и углекислый газ (этим типом обмена характеризуются красные волокна). При анаэробном типе метаболизма из одной молекулы глюкозы образуются 2 молекулы АТФ, а также молочная кислота (этим типом обмена характеризуются белые волокна).
- Окислительные, или красные, мышечные волокна небольшого диаметра, окружены массой капилляров, содержат много миоглобина. Их многочисленные митохондрии имеют высокой уровень активности окислительных ферментов (например, СДГ).
- Гликолитические, или белые, мышечные волокна имеют больший диаметр, в саркоплазме содержится значительное количество гликогена, митохондрии немногочисленны. Для них характерны низкая активность окислительных ферментов и высокая активность гликолитических ферментов. В белых мышечных волокнах молочная кислота выводится в межклеточное пространство, тогда как в красных мышечных волокнах молочная кислота служит субстратом для дальнейшего окисления, в результате которого образуется ещё 36 молекул АТФ. Плотность капиллярной сети вокруг мышечных волокон, количество митохондрий, а также активность окислительных и гликолитических ферментов коррелируют со степенью утомления волокна. Белые гликолитические волокна имеют высокую скорость сокращения и относятся к быстроутомляемым. Среди красных волокон по скорости сокращения и утомляемости выделено два подтипа: быстрые неутомляемые и медленные неутомляемые волокна.
- Диагностика типов мышечных волокон проводится при гистохимическом выявлении активности АТФазы миозина и СДГ (рис. 7-9).
а. АТФаза миозина. Различают два типа мышечных волокон.
- Быстрые (высокая активность АТФазы).
- Медленные (низкая активность АТФазы).
б. Сукцинатдегидрогеназа. Различают три типа мышечных волокон.
- Белые (гликолитические волокна, имеющие низкую активность фермента).
- Красные (окислительные волокна с высокой активностью СДГ).
- Промежуточные (окислительно-гликолитические волокна, имеющие умеренную активность СДГ).
- Сводная классификация мышечных волокон (табл. 7-1, рис. 7-9). На практике результаты типирования мышечных волокон комбинируют. Различают три типа мышечных волокон: быстросокращающиеся красные, быстросокращающиеся белые и медлен- носокращающиеся промежуточные. В зависимости от преобладания в мышцах конкретного типа мышечных волокон скелетные мышцы относят к «красным» и «белым» либо «быстрым» и «медленным». Таким образом, каждая мышца уникальна по спектру входящих в её состав типов мышечных волокон. Этот спектр генетически детерминирован (отсюда практика типирования мышечных волокон при отборе спортсменов-бегунов — спринтеров и стайеров).
Е. Контроль фенотипа мышечных волокон. Множество факторов (интактная иннервация, уровень физической активности, гормоны) поддерживает унаследованный спектр мышечных волокон, уникальный для каждой мышцы.
- Трофическое влияние нерва. После повреждения нерва скелетная мышца подвергается гипотрофии (уменьшение объёма мышечных волокон, разрастание соединительной ткани, увеличение чувствительности к ацетилхолину). Регенерация нерва восстанавливает нормальное состояние мышц. Известно также, что все мышечные волокна одной и той же нейромоторной единицы принадлежат к одному типу (см. I Д). Эти и многие другие наблюдения и эксперименты заставили заключить, что мотонейроны оказывают на иннервируемые ими мышечные волокна нейротрофический эффект. Факторы реализации нейротрофического эффекта не выделены; возможно, речь идёт о специальных гормоноподобных веществах.
- Сократительная активность. Аналогичное денервации и также обратимое действие оказывает иммобилизация мышц.
- Эффекты гормонов. Ряд гормонов (в т.ч. анаболические стероиды) вызывает гипертрофию мышц.
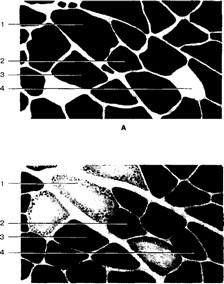

Таблица 7-1. Типы мышечных волокон и их свойства
|
Типы мышечных волокон |
Миозин |
Митохондрии |
Содержание многлобина |
Утомляемость |
Содержание гликогена |
|
быстрые красные |
быстрый |
много |
высокое |
медленноутом- ляемые |
высокое |
|
быстрые белые |
быстрый |
немного |
низкое |
быстроутом- ляемые |
высокое |
|
медленные промежуточные |
медленный |
много |
высокое |
медленноутом- ляемые |
низкое |
Ж. Регенерация и трансплантация мышц
- Физиологическая регенерация. В скелетной мышце постоянно происходит физиологическая регенерация — обновление мышечных волокон. При обновлении мышечных волокон клетки-сателлиты вступают в циклы пролиферации с последующей дифферен- цировкой в миобласты и их включением в состав предсуществуюших мышечных волокон. Дистрофии и мышечные дистрофии. Существует ряд наследственных заболеваний,
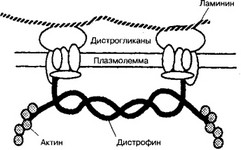
при которых нарушено обновление скелетной мышечной ткани (мышечные дистрофии Дюшенна, Беккера и другие). Это Х-сцепленный дефект (чаще делеции) гена дистрофина. Заболевание встречается у мальчиков с популяционной частотой 1:7000. Нормально дистрофии локализован в сарколемме (рис. 7-10). При дистрофиях резко уменьшен или отсутствует синтез этого и ряда других белков дистрофинового комплекса, развиваются дегенеративные изменения мышечных волокон, они замещаются жировыми клетками и волокнистой соединительной тканью.
- Репаративная регенерация. Восстановление мышечных волокон возможно благодаря наличию клеток-сателлитов — камбиальных элементов скелетной мышечной ткани. При гибели симпласта клетки-сателлиты активируются, происходят пролиферация мио- бластов и выстраивание их в цепи. Миобласты сливаются, образуя мышечные трубочки с характерным для них центральным расположением ядер. Синтез сократительных белков начинается в миобластах, а в мышечных трубочках происходят сборка миофибрилл и образование саркомеров. Миграция ядер на периферию завершает образование мышечных волокон. Таким образом, в ходе репаративной регенерации происходит повторение событий эмбрионального миогенеза.
- Трансплантация
 а. Пересадка мышц. При пересадке мышц используют лоскут из широчайшей мышцы спины. При остеомиелите, ишемической контрактуре и травмах мышечный лоскут,
а. Пересадка мышц. При пересадке мышц используют лоскут из широчайшей мышцы спины. При остеомиелите, ишемической контрактуре и травмах мышечный лоскут,
Рис. 7-10. Мембранный цитоскелет поперечнополосатого мышечного волокна. Дистрофии — цитоплазматический белок, ассоциированный с плазмо- леммой. Белок оказывает стабилизирующее действие на дистрогликаны, входящие в состав дистрофинового комплекса. Дистрогликаны связывают ламинин и обеспечивают адгезию мышечного волокна к межклеточному матриксу [из Gumbiner BMt 19931
извлечённый из ложа вместе с собственными сосудами и нервом, трансплантируют в место дефекта мышечной ткани,
б. Перенос камбиальных клеток. При наследственных мышечных дистрофиях применяют введение в дефектные по гену дистрофина мышцы нормальные по этому признаку О0-миобласты. При таком подходе рассчитывают на постепенное обновление дефектных мышечных волокон нормальными.
Источник: Под ред. Э.Г. Улумбекова, Ю.А. Челышева, «Гистология (введение в патологию)» 1997