СЕРДЕЧНАЯ МЫШЕЧНАЯ ТКАНЬ
Поперечнополосатая мышечная ткань сердечного типа входит в состав мышечной стенки сердца (миокард). Основной гистологический элемент — кардиомиоцит. Кардиомиоциты присутствуют также в проксимальной части аорты и верхней полой вены.
А. Кардиомиогенез. Миобласты происходят из клеток спланхнической мезодермы, окружающей эндокардиальную трубку (глава 10 Б I). После ряда митотических делений G,-mho6- ласты начинают синтез сократительных и вспомогательных белков и через стадию G0- миобластов дифференцируются в кардиомиоциты, приобретая вытянутую форму; в саркоплазме начинается сборка миофибрилл. В отличие от поперечнополосатой мышечной ткани скелетного типа, в кардиомиогенезе не происходит обособления камбиального резерва, а все кардиомиоциты необратимо находятся в фазе G0 клеточного цикла. Специфический фактор транскрипции (ген CATFl/SMBP2, 600502, Ilql3.2-ql3.4) экспрессируется только в развивающемся и сформировавшемся миокарде.
Б. Кардиомиоциты расположены между элементами рыхлой волокнистой соединительной ткани, содержащей многочисленные кровеносные капилляры бассейна венечных сосудов и терминальные ветвления двигательных аксонов нервных клеток вегетативного отдела нервной системы. Каждый миоцит имеет сарколемму (базальная мембрана + плазмолемма). Различают рабочие, атипичные и секреторные кардиомиоциты.
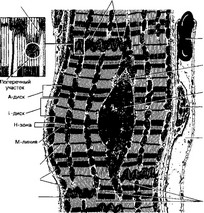
- Рабочие кардиомиоциты (рис. 7-11) — морфофункциональные единицы сердечной мышечной ткани — имеют цилиндрическую ветвящуюся форму диаметром около 15 мкм. Клетки содержат миофибриллы и ассоциированные с ними цистерны и трубочки саркоплазматического ретикулума (депо Ca2+), центрально расположенные одно или два ядра. Рабочие кардиомиоциты при помощи межклеточных контактов (вставочные диски) объединены в так называемые сердечные мышечные волокна — функциональный синцитий (совокупность кардиомиоцитов в пределах каждой камеры сердца).
а. Сократительный аппарат. Организация миофибрилл и саркомеров в кардиомио- цитах такая же, как и в скелетном мышечном волокне (см. I Б I, 2). Одинаков и механизм взаимодействия тонких и толстых нитей при сокращении (см. I Г 5, 6, 7).
б. Саркоплазматическая сеть. Выброс Ca2+ из саркоплазматического ретикулума регулируется через рецепторы рианодина (см. также главу 2 III А 3 б (3) (а)). Изменения мембранного потенциала открывают потенциалзависимые Са2+-каналы, в кар- диомиоцитах незначительно повышается концентрация Ca2+. Этот Ca2+ активирует рецепторы рианодина, и Ca2* выходит в цитозоль (кальций-индуцированная мобилизация Ca2+).
в. Т-трубочки в кардиомиоцитах, в отличие от скелетных мышечных волокон, проходят на уровне Z-линий. В связи с этим Т-трубочка контактирует только с одной терминальной цистерной. В результате вместо триад скелетного мышечного волокна формируются диады.
г. Митохондрии расположены параллельными рядами между миофибриллами. Их более плотные скопления наблюдают на уровне I-дисков и ядер.
Продольный
участок
Вставочный диск
¦ Эритроцит
Комплекс Г ольджи
Ядро
Эндотелиальная
клетка
. Просвет капилляра
Z-линия' Митохондрии-1
Базальная
мембрана
Миофибриллы
Рис. 7-11. Рабочий кардиомиоцит — удлинённой формы клетка. Ядро расположено центрально, вблизи ядра находятся комплекс Гольджи и гранулы гликогена. Между миофибриллами лежат многочисленные митохондрии. Вставочные диски (на врезке) служат для скрепления кардиомиоцитов и синхронизации их сокращения [из Hees H, Sinowatz F (1992) и Kopf-MaierP, Merker H-J {1989))
д. Вставочные диски. На концах контактирующих кардиомиоцитов имеются интердигитации (пальцевидные выпячивания и углубления). Вырост одной клетки плотно входит в углубление другой. На конце такого выступа (поперечный участок вставочного диска) сконцентрированы контакты двух типов: десмосомы и промежуточные. На боковой поверхности выступа (продольный участок вставочного диска) имеется множество щелевых контактов (nexus, нексус).
- Десмосомы обеспечивают механическое сцепление, препятствующее расхождению кардиомиоцитов.
- Промежуточные контакты необходимы для прикрепления тонких актиновых нитей ближайшего саркомера к сарколемме кардиомиоцита.
- Щелевые контакты — межклеточные ионные каналы, позволяющие возбуждению перескакивать от кардиомиоцита к кардиомиоциту. Это обстоятельство — наряду с проводящей системой сердца — позволяет синхронизировать одновременное сокращение множества кардиомиоцитов в составе функционального синцития.
е. Предсердные и желудочковые миоциты — разные популяции рабочих кардиомиоцитов. В предсердных кардиомиоцитах слабее развита система Т-трубочек, но в зоне вставочных дисков значительно больше щелевых контактов. Желудочковые кардиомиоциты крупнее, они имеют хорошо развитую систему Т-трубочек. В состав сократительного аппарата миоцитов предсердий и желудочков входят разные изоформы миозина, актина и других контрактильных белков.
- Атипичные кардиомиоциты. Этот устаревший термин относится к миоцитам, формирующим проводящую систему сердца (глава 10 Б 2 б (2)). Среди них различают водители ритма и проводящие миоциты.
а. Водители ритма (пейсмейкерные клетки, пейсмейкеры; рис. 7-12) — совокупность специализированных кардиомиоцитов в виде тонких волокон, окружённых рыхлой соединительной тканью. По сравнению с рабочими кардиомиоцитами они имеют меньшие размеры. В саркоплазме содержится сравнительно мало гликогена и небольшое количество миофибрилл, лежащих в основном по периферии клеток. Эти клетки имеют богатую васкуляризацию и двигательную вегетативную иннервацию. Так, в синусно- предсердном узле доля соединительнотканных элементов (включая кровеносные капилляры) в 1,5-3 раза, а нервных элементов (нейроны и двигательные нервные окончания) в 2,5-5 раз выше, чем в рабочем миокарде правого предсердия. Главное свойство водителей ритма — спонтанная деполяризация плазматической мембраны. При достижении критического значения возникает потенциал действия, распространяющийся по волокнам проводящей системы сердца и достигающий рабочих кардиомиоцитов. Главный водитель ритма — клетки синусно-предсердного узла — генерирует ритм 60-90 импульсов в минуту. Нормально активность других водителей ритма подавлена.
- Спонтанная генерация импульсов потенциально присуща не только водителям ритма, но и всем атипичным, а также рабочим кардиомиоцитам. Так, in vitro все кардиомиоциты способны к спонтанному сокращению.
- В проводящей системе сердца существует иерархия водителей ритма: чем ближе к рабочим миоцитам, тем реже спонтанный ритм.
б. Проводящие кардиомиоциты — специализированные клетки, выполняющие функцию проведения возбуждения от водителей ритма. Эти клетки образуют длинные волокна.
- Пучок Гйса. Кардиомиоциты этого пучка проводят возбуждение от водителей ритма к волокнам Пуркинъё, содержат относительно длинные миофибриллы, имеющие спиральный ход; мелкие митохондрии и небольшое количество гликогена. Проводящие кардиомиоциты пучка Гйса входят также в состав синусно-предсердного и предсердно-желудочкового узлов.
- Волокна Пуркинъё. Проводящие кардиомиоциты волокон Пуркинъё — самые крупные клетки миокарда. В них содержатся редкая неупорядоченная сеть миофибрилл, многочисленные мелкие митохондрии, большое количество гликогена. Кардиомиоциты волокон Пуркинъё не имеют Т-трубочек и не образуют вставочных дисков. Они связаны при помощи десмосом и щелевых контактов. Последние занимают значительную площадь контактирующих клеток, что обеспечивает высокую скорость проведения импульса по волокнам Пуркинъё.
- Секреторные кардиомиоциты. В части кардиомиоцитов предсердий (особенно правого) у полюсов ядер располагаются хорошо выраженный комплекс Гольджи и секреторные гранулы, содержащие атриопептин — гормон, регулирующий АД (глава 10 Б 2 б (3)).
В. Иннервация. На деятельность сердца — сложной авторегуляторной и регулируемой системы — оказывает влияние множество факторов, в т.ч. двигательная вегетативная
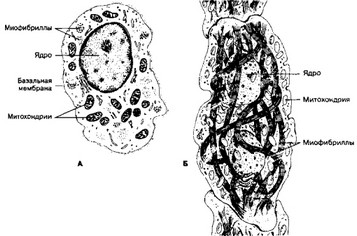
Рис. 7-12. Атипичные кардиомиоциты. А — водитель ритма синусно-предсердного узла;
Б — проводящий кардиомиоцит пучка Гйса [из Hees Н, Sinowatz F, 1992]
иннервация — парасимпатическая и симпатическая. Парасимпатическая иннервация осуществляется терминальными варикозными окончаниями аксонов блуждающего нерва, а симпатическая — окончаниями аксонов адренергических нейронов шейного верхнего, шейного среднего и звёздчатого (шейно-грудного) ганглиев. В контексте представления о сердце как о сложной авторегуляторной системе чувствительная иннервация сердца (как вегетативная, так и соматическая) должна рассматриваться как часть системы регуляции
кровотока.
- Двигательная вегетативная иннервация. Эффекты парасимпатической и симпатической иннервации реализуют соответственно мускариновые холинергические и
адренергические рецепторы плазмолеммы разных клеток сердца (кардиомиоциты рабочие и особенно атипические, внутрисердечные нейроны собственного нервного аппарата). Существует множество фармакологических препаратов, оказывающих непосредственное действие на названные рецепторы. Так, норадреналин, адреналин и другие адренергические препараты в зависимости от эффекта на а- и p-адренорецепторы подразделяют на активирующие (адреномиметики) и блокирующие (адреноблока- торы) агенты. м-Холинорецепторы также имеют аналогичные классы препаратов (холиномиметики и холиноблокаторы).
а. Активация симпатических нервов увеличивает частоту спонтанной деполяризации мембран водителей ритма, облегчает проведение импульса в волокнах Пуркинье и увеличивает частоту и силу сокращения типичных кардиомиоцитов.
б. Парасимпатические влияния, наоборот, уменьшают частоту генерации импульсов пейсмейкерами, снижают скорость проведения импульса в волокнах Пуркинье и уменьшают частоту сокращения рабочих кардиомиоцитов.
- Чувствительная иннервация
а. Спинальная. Периферические отростки чувствительных нейронов спинномозговых узлов образуют свободные и инкапсулированные нервные окончания.
б. Специализированные сенсорные структуры сердечно-сосудистой системы рассмотрены в главе 10.
- Внутрисердечные вегетативные нейроны (двигательные и чувствительные) могут формировать местные нейрорегуляторные механизмы.
- МИФ-клетки. Малая интенсивно флюоресцирующая клетка — разновидность нейронов, найдена практически во всех вегетативных ганглиях. Это небольшая (диаметр 10-20 мкм) и безотростчатая (или с небольшим числом отростков) клетка, в цитоплазме содержит множество крупных гранулярных пузырьков диаметром 50-200 нм с катехоламинами. Гранулярная эндоплазматическая сеть развита слабо и не образует скоплений, подобных тельцам Ниссля.
Г. Регенерация. При ишемической болезни сердца (ИБС), атеросклерозе коронарных сосудов, сердечной недостаточности разной этиологии (в т.ч. при артериальной гипертензии, инфаркте миокарда) наблюдаются патологические изменения кардиомиоцитов, включая их гибель.
- Репаративная регенерация кардиомиоцитов невозможна, т.к. они находятся в фазе G0 клеточного цикла, а аналогичные скелетномышечным клеткам-сателлитам G1- миобласты в миокарде отсутствуют. По этой причине на месте погибших кардиомиоцитов образуется соединительнотканный рубец со всеми вытекающими отсюда неблагоприятными последствиями (сердечная недостаточность) для проводящей и сократительной функций миокарда, а также для состояния кровотока.
- Сердечная недостаточность — нарушение способности сердца обеспечивать кровоснабжение органов в соответствии с их метаболическими потребностями.
а. Причины сердечной недостаточности — снижение сократительной способности, увеличение посленагрузки, изменения преднагрузки.
Снижение сократительной способности
(а) Инфаркт миокарда — некроз участка сердечной мышцы с потерей его способности к сокращению. Замещение поражённой части стенки желудочков соединительной тканью приводит к снижению функциональных свойств миокарда. При поражении значительной части миокарда развивается сердечная недостаточность.
(б) Врождённые и приобретённые пороки сердца приводят к перегрузке полостей сердца давлением или объёмом с развитием сердечной недостаточности.
(в) Артериальная гипертензия. Многие больные гипертонической болезнью или симптоматическими гипертензиями страдают недостаточностью кровообращения. Снижение сократительной способности миокарда характерно для стойкой тяжёлой гипертензии, быстро приводящей к развитию сердечной недостаточности.
(г) Кардиомиопатии токсические (алкоголь, кобальт, катехоламины, доксору- бицин), инфекционные, при т.н. коллагеновых болезнях, рестриктивные (ами- лоидоз и саркоидоз, идиопатические).
б. Компенсаторные механизмы при сердечной недостаточности. Феномены, вытекающие из закона Франка-Старлинга, в т.ч. гипертрофия миокарда, дилатация левого желудочка, периферическая вазоконстрикция вследствие выброса катехоламинов, активация системы ренин-ангиотензин-[альдостерон] и вазопрессина, перепрограммирование синтеза миозинов в кардиомиоцитах, увеличение секреции атриопептина, — компенсаторные механизмы, поддерживающие положительный инотропный эффект. Однако рано или поздно миокард теряет способность обеспечивать нормальный сердечный выброс.
- Гипертрофия кардиомиоцитов в виде увеличения массы клеток (в т.ч. их полиплоидизация) — компенсаторный механизм, приспосабливающий сердце к функционированию в патологических ситуациях.
- Перепрограммирование синтеза миозинов в кардиомиоцитах происходит при увеличении ОПСС для поддержания сердечного выброса, а также под влиянием повышенного содержания в крови T3 и T4 при тиреотоксикозах. Имеется несколько генов для лёгких и тяжёлых цепей сердечного миозина, различающихся по активности АТФазы, а значит, по длительности рабочего цикла (см. IГ 6) и развиваемому напряжению. Перепрограммирование миозинов (как и других сократительных белков) обеспечивает сердечный выброс на приемлемом уровне до тех пор, пока не будут исчерпаны возможности этого приспособительного механизма. При исчерпании этих возможностей развивается сердечная недостаточность — левосторонняя (гипертрофия левого желудочка с последующей его дилатацией и дистрофическими изменениями), правосторонняя (застой в малом круге кровообращения).
- Ренин-ангиотензин-[альдостерон], вазопрессин — мощная система вазо- констрикции.
- Периферическая вазоконстрикция вследствие выброса катехоламинов.
- Атриопептин — гормон, реализующий вазодилатацию.
Источник: Под ред. Э.Г. Улумбекова, Ю.А. Челышева, «Гистология (введение в патологию)» 1997