Доминирующим иммуноглобулином секретов желез организма (слюны, пищеварительного сока, выделений слизистой носа и молочной железы) является IgA. В сыворотке крови его содержание незначительно и составляет всего 10-15% от общего количества всех иммуноглобулинов. Мономерная форма IgA построена по классическому типу. Тяжелая цепь включает V-область, три
домена С-области и шарнирный участок. У человека известно два подкласса этого иммуноглобулина: IgAl и IgA2. Соответствующее обозначение тяжелых цепей: а1 и а2. Без учета шарнирного участка степень гомологии между а1 и а2 очень высока и составляет около 95%. Кроме того, подкласс IgA2 имеет два аллельных варианта — аллотипы А2т(1) и А2т(2).
За исключением шарнирного участка различия между подклассами IgAl и IgA2 касаются 14 положений аминокислотных остатков в С-областях тяжелых цепей. При этом различия между аллотипами А2т(1) и А2т(2) в этих положениях отсутствуют, но они представлены в других участках тяжелых цепей, вблизи шарнирного участка. Именно эти положения определяют серологически выявляемые различия между аллотипами.
Шарнирные области al- и а2-цепей значительно отличаются друг от друга, а 1-Цепь имеет в этом месте на 13 аминокислотных остатков больше, чем а2-цепь. При этом последовательности 224- 239 al-цепи возникли в результате тандемной .публикации в той части генома, которая контролирует всего восемь аминокислотных остатков (рис. 2.15). Дубликация столь незначительного отрезка ДНК — явление крайне редкое. Однако особенность этого участка шарнира в другом. В слюне и содержимом толстого кишечника человека представлены протеолитические ферменты, способные расщеплять IgAl именно в дублированной части цепи. Подобной же активностью обладают протеолитические ферменты некоторых бактерий, таких как Streptococcus sanguis, Neisseria gonorrhea, N.meningitidis. В то же время делеция 13 аминокислот у IgA2 в данном месте шарнира обеспечивает устойчивость этого подкласса IgA по отношению к бактериальному протеолизу (рис. 2.15). Вероятно, IgA2 эволюционно возник в результате способности избегать бактериального ферментативного разрушения. Благоприобре- тенность подобного признака кажется очевидной. На рис. 2.16 указаны домены, с которыми связаны изо- и аллотипические характеристики.
Структурными особенностями IgA являются наличие в молекуле J-цепи и секреторного компонента (рис. 2.17). J-Цепъ, как и у
IgM, служит для полимеризации молекулы. Молекулярная масса цепи незначительна и составляет около 15 кД. Данный полипептид не имеет гомологии с иммуноглобулинами, а кодирующий его ген локализован в хромосоме, не содержащей генов иммуноглобулинов. На заключительном этапе синтеза J-цепь взаимодействует с СООН-концевым участком тяжелой цепи через дисулъфид- ные связи. В результате образуются полимерные формы IgA, представляющие собой в основном димеры, хотя в незначительном количестве имеются и мультимерные молекулы, включающие три и более мономера.
68
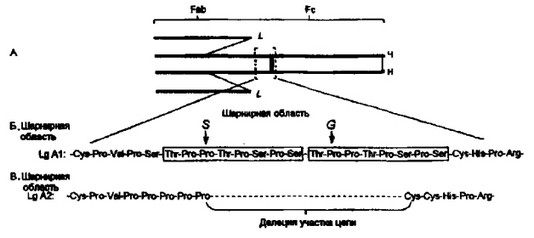
Рис. 2.1S. Шарнирные области IgAl и IgA2 человека.
А — схема IgA человека с указанием шарнирного участка. Б — последовательность аминокислотных остатков шарнирного участка IgAl. Дуплицированные участки заключены в прямоугольник. Стрелками показаны связи Pro-Thy, которые расщепляются ферментами бактерий Streptococcus sangius (S) и Neisseria gonorrhea (G). В — последовательность аминокислотных остатков шарнирной области IgA2. Показана деления части последовательностей аминокислотных остатков» соответствующих участку IgAl, который подвержен протеолитическому расщеплению ферментами бактерий. Отсутствие этой части шарнира у IgA2 объясняет резистентность данного подкласса иммуноглобулина к действию бактериальных ферментов
Для IgA, представленного в секретах, характерно наличие секреторного компонента. Он состоит из нескольких родственных в антигенном отношении полипептидов и экспрессируется на поверхности эпителиальных клеток. При специфическом взаимодействии димера (IgA)2-J с секреторным компонентом на клеточной поверхности образуется комплекс, который после эндоцитоза перемещается в цитоплазме к апикальной части клетки. Здесь комплекс подвергается действию протеолитических ферментов, что позволяет ему высвобождаться в секреты субэпителиального пространства (рис. 2.18).
Функционально IgA выступает в качестве первой линии защиты на слизистых поверхностях, препятствуя проникновению вирусов в организм. Хотя IgA не связывает комплемент и в силу этого не обладает бактерицидной активностью, он играет важную роль в нейтрализации бактериальных токсинов. Кроме того, у млекопитающих, включая человека, секреторный IgA хорошо представлен в молозиве и обеспечивает таким образом специфический иммунитет новорожденных.
