Среди всех классов иммуноглобулинов в количественном отношении доминирует IgG. В сыворотке млекопитающих он состав- 65
А
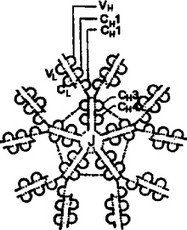

Рис. 2.14. Структуре IgM.
А. Иммуноглобулин М состоит из пяти мономеров, каждый из которых включает четыре полипептидные цепи (две Н-цепи и две L-цепи). Мономеры объединены в единую пентамерную молекулу дисульфидными -S-S- связями и J-цепью. Пунктир означает дисульфидные связи. Б, В. Модель IgM, построенная на основании данных рентгенострукгурного анализа. Видна гибкость Fab-фрагментов, позволяющая им “находить” соответствующие пространственно удаленные антигенные детерминанты
ляет около 75% от общего количества этих белков. Отдельная молекула включает две тяжелые у-цепи и две легкие: %- или Х-типов. Молекулярная масса IgG равна приблизительно 150 кД. У человека и мыши описаны по четыре подкласса IgG, которые впервые были обнаружены серологическими методами. Тяжелые цепи этих
подклассов обозначаются как yl, у2, уЗ и у4. Порядковый номер указывает на количественное содержание каждого подкласса в сыворотке: в наибольшем количестве представлен IgGyl, в наименьшем — IgGy4. Степень гомологии между разными подклассами человека высока и составляет 90-95%. Различия связаны в основном с шарнирной областью, хотя в С-доменах также встречаются отдельные аминокислотные замены.
Шарнирная область характеризуется значительным числом остатков пролина и цистеина, что определяет ее гибкость. Количество дисульфидных связей этой части молекулы варьирует от одного подкласса к другому. Так, в yl- и у4-цепях таких связей две, в у2-цепях — четыре, а в уЗ-цепях — одиннадцать. Именно эти -S-S- связи обеспечивают взаимодействие двух тяжелых цепей. В yl-цепи шарнирная область начинается с 216-го остатка и заканчивается 231-м. В то же время шарнирная область уЗ-цегш на 47 остатков больше по сравнению с yl. Изучение аминокислотной последовательности позволяет предположить, что это увеличение остатков связано с тандемной дупликацией участка 216-231 у 1-цепи. Существенной особенностью шарнирной области является возникающая в результате взаимодействия двух тяжелых цепей жесткая, циклическая октапептидная структура:
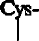
-Cys-Pro-Pro-
-Cys-Pro-Pro-Cys-
Она служит осью вращения всей гибкой шарнирной области, а следовательно и Fab-фрагментов, что необходимо, вероятно, для взаимодействия с антигеном.
Гомология между у-цепями мыши, относящимися, как и у человека, к четырем подклассам, меньше и составляет 60-70%.
Биологическая роль IgG разнообразна. Это — и антибактериальная защита через механизм комплементзависимого лизиса микробной клетки, и проникновение через плаценту с той же защитной для развивающегося зародыша функцией, и “армирование” макрофагов (цитофильностъ к макрофагам), в результате чего они становятся цитотоксическими для трансплантатов и опухолей, и участие в повышенной реактивности аллергического типа.
