- Биоустойчивость организма определяется его потребностью в кислороде и зависит от возможностей систем жизнеобеспечения удовлетворить эту потребность. Такое ресурсообес- печение исключает возможности нарушения самой биоустойчивости при условии, что величина потребности в Ог превосходит
Таблица 3.1
Изменения потребности в 02 и его потребления (мл * мин-1 • м~2) в фазовом пространстве биоустойчивости при сепсисе
|
Фазы |
Потребность |
Потребление |
|
1. Рефрактерной несостоятельности |
97 |
50 |
|
2. Резистентной недостаточности |
80 |
56 |
|
3. Торпидной недостаточности |
108 |
80 |
|
4. Обратимой недостаточности |
124 |
98 |
|
5. Гипобиотической неустойчивости |
137 |
118 |
|
6. Катаболической неустойчивости |
173 |
197 |
|
7. Энергодинамической нестабильности |
188 |
178 |
|
8. Остаточного энергодефицита |
183 |
177 |
3 базальный уровень выработки свободной энергии, обеспечивающий БЦО. Установленные нами изменения этих параметров при сепсисе представлены в таблице 3.1.
Как показано на рисунке 3.1, соотношение потребности и потребления Ог всегда превышало уровень энергосопряженности. Оно становилось ниже, в среднем на 12%, только при катаболизме.
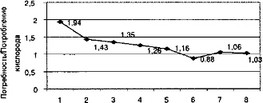
Фазы
Рис. 3.1. Соотношение потребности и потребления 02 в фазовом пространстве биоустойчивости
Соотношение потребность/потребление О2 позволяет при сепсисе с большой точностью судить об эффективности энергопроизводства в организме пациентов и характере его ресурсо- обеспечения, что в итоге и определяет состояние биоустойчи- восги. Её нарушения особенно выражены при абдоминальном сепсисе (АС). Последний и представляет собой прогрессирующее вплоть до несостоятельности нарушение биоустойчивости, развивающееся при полимикробных гнойно-некротических заболеваниях органов брюшной полости, забрюшинного пространства, висцеральной и париетальной брюшины в результате дискоординации механизмов системного воспалительного и компенсаторного противовоспалительного ответов.
- Биоустойчивость, используемая для классифика- 3 ции и оценки тяжести АС, позволяет в клинике обобщенно определять динамику септического процесса.
Большинство исследователей выделяют три типа инфекций, характер течения которых отличается определенной универсальностью и закономерностью биологических механизмов воспалительной реакции и нарушений биоустойчивости организма в ответ на развитие гнойно-некротического процесса. Первый из них — распространенный гнойный перитонит, возникающий вследствие запушенных процессов: деструкция органа и/или его перфорация, а также острая непроходимость кишечника. Второй
- послеоперационный распространенный перитонит вследствие: а) формирования и прорыва гнойника в свободную брюшную полость; б) несостоятельности зоны ранее наложенных швов и анастомозов. Третий тип — гнойно-некротический панкреатит вследствие инфицирования некрозов поджелудочной железы и/или развития забрюшинной септической флегмоны.
При этом АС характеризуется: 1) наличием не менее двух клинико-лабораторных признаков SIRS в соответствии с рекомендациями ACCP/SCCM Consensus (1992); 2) наличием очага инфекта; 3) развитием энтеральной недостаточности (ЭН).
Выделяют три стадии энтеральной недостаточности (ЭН) у оперированных больных: 1-я — компенсации, или обычного послеоперационного пареза; 2-я — декомпенсации, или истинной функциональной непроходимости кишечника; 3-я — терминальная, или паралича пищеварительного тракта.
Факторами риска нарушений биоустойчивости и развития абдоминального сепсиса (АС) при гнойно-некротических процессах в брюшной полости считаются: 1) онкологические заболевания, диспротеинемия, цирроз печени с портальной гипертензией, сахарный диабет, инфекция ВИЧ, тяжелые хронические заболевания; 2) различные инвазивные процедуры: катетериза-
3 ция сосудов и мочевого пузыря; 3) применение иммуносупрессоров, особенно при неинфицированном панкреонекрозе. К предрасполагающим факторам относят гнойно-септические осложнения, возникающие после оперативного родовспоможения и язвенные поражения ЖКТ (В. В. Бойко, 2002).
Динамику нарушений биоустойчивосги при АС отражает классификация перитонита, основанная на стадийности и фаз- ности его клинического течения, распространенности воспалительного процесса в брюшной полости и этиологии. В предложенной М.И. Кузиным и соавторами в 1978 г классификации определены объем поражения брюшины, а также наличие или отсутствие отграничения пораженной части от остальных отделов брюшной полости (рис. 3.2).
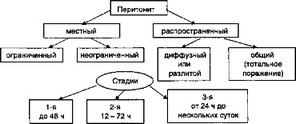
Рис. 3.2. Критерии нарушения биоустойчивости в классификации перитонита по М. И. Кузину
Автор подчеркивал несомненное значение распространенности процесса для определения тактики лечения и прогноза. Однако даже при широкой лапаротомии точно ответить на вопрос, является ли перитонит общим или разлитым, не всегда возможно. Количество экссудата в брюшной полости не может служить определяющим фактором. Состояние всех отделов брюшины удается установить только на секции.
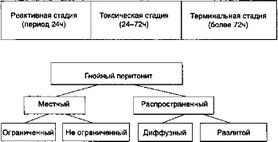
Рис. 3.3. Факторы нарушения биоустойчивости в классификации перитонита по Б.Д. Савчуку
Б.Д. Савчук (1979) предложил классификацию и оценку биоустойчивости, основанную на первоначальном принципе распространенности воспалительного процесса (рис. 3.3).
В ней исключено различие между разлитым и общим перитонитом, так как установить его на операционном столе практически невозможно. Для характеристики тяжести нарушений би- оустойчивосги сохранены принципы стадийности. При этом за основу взята классификация, предложенная Б.А. Петровым и А.А. Беляевым на I съезде хирургов России в 1958 г., изменены лишь сроки, характеризующие стадию угнетения механизмов биоустойчивости: вместо 12—72 ч принят интервал 24—72 ч, что, по-видимому, более соответствует современному типу течения АС. При обозначении стадии (фазы) развития заболевания автор придерживается терминологии К. С. Симоняна. В частности, терминальная (свыше 72 ч) — стадия глубокой интоксикации на грани обратимости, в представлении зарубежных хирургов она равнозначна понятию «септический шок». Этиологический фактор («бактериологический возбудитель»), по мнению Б.Д. Савчука, не имеет первостепенного значения, хотя и играет известную роль в выборе лечебных мероприятий.
3 В.А. Попов (1985) считает наиболее важной причиной разви
тия бионеустойчивости при перитоните степень распространенности воспалительного процесса (рис.3.4).
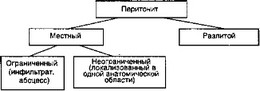
Рис. 3.4. Причины развития бионеустойчивости в классификации перитонита по В.А. Попову
Практически важным и патогенетически обоснованным автор полагает деление перитонита по характеру экссудата брюшной полости (серозный, серозно-фибринозный, фибринозно- гнойный). С его точки зрения, выбор тактики хирургического лечения и послеоперационного ведения больного в значительной степени зависит от этиологии перитонита. В.А. Попов считает необходимым выделять в течении перитонита реактивнотоксическую фазу, но с учетом компенсации или декомпенсации общего состояния больного.
В монографии «Перитонит» В.К. Гостищева и соавторов (1992) клиническая классификация перитонита (рис. 3.5) основывается на следующих факторах бионеустойчивости: 1) источник перитонита; 2) характер экссудата; 3) распространенность перитонита; 4) стадия заболевания, связанная со сроком от начала заболевания. Особое значение придается характеру экссудата, так как, с точки зрения авторов, гнойный перитонит протекает менее тяжело, чем каловый или смешанный. При каловом или смешанном перитоните даже рано начатое лечение не гарантирует от многочисленных осложнений и летального исхода.
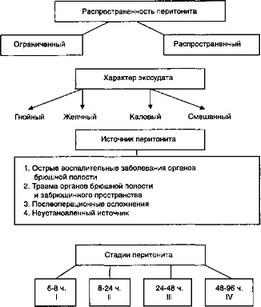
Рис. 3.5. Этиопатогенетические составляющие бионеустойчивости в классификации перитонита по В. К. Гостищеву и соавт.
Улучшение результатов лечения больных распространенным перитонитом связано с объективизацией оценки происходящих в организме патологических изменений биоустойчивосги — уровня и ведущего источника эндогенной интоксикации, активности микробно-воспалительного процесса, нарушений гомеостаза и тканевого метаболизма, функций органов и систем. Поэтому В. М. Буянов с соавторами (1998) для унификации ле- чебно-диагностических приемов создали современную классификацию, определяющую универсальность диагностических и
лечебных мероприятий, что должно обеспечить проведение этиологически направленной и патогенетически обоснованной терапии заболевания. Классификация определяет необходимость диагностических и лечебных мероприятий, своевременность и обоснованность показаний к тем или иным методам коррекции бионеустойчивости, сопровождающей распространенный перитонит (см. табл. 3.2).
Таблица 3.2
Этиопатогенетические элементы бионеустойчивости в классификации перитонита по В.М. Буянову
В. М. Буянов разработал собственную классификацию хирур- 3
гических перитонитов с учетом особенностей этиологии и стадийности бионеустойчивости, распространенности воспалительного процесса, вида возбудителя и степени бактериальной контаминации перитонеального экссудата, выраженности эндогенной интоксикации, функциональной недостаточности кишечника и полиорганной недостаточности. На наш взгляд, данная рабочая классификация наиболее удобна для прикладного использования в клинической практике с позиций строгого обоснования тактики лечебно-диагностических мероприятий, необходимых для восстановления БЦО.
В настоящее время не вызывает сомнения, что объективная интегральная и количественная оценка тяжести состояния больных в критическом состоянии, в том числе и при АС, не может быть выполнена без использования объективных систем — шкал оценки функциональных нарушений (АРАСНЕ-И, SAPS) и оценки степени органных нарушений (MODS, SOFA), присущих бионеустойчивости. Между этими системами, несмотря на почти одинаковый методологический подход, существует принципиальная, образно говоря, идеологическая разница. В частности, основная цель объективных систем оценки тяжести — прогноз и оценка риска летального исхода. При этом и APACHE II, и SAPS высокоспецифичны (90%) в отношении прогноза благоприятного исхода, но менее чувствительны (50—70%) относительно прогноза летального исхода. Более того, эти системы приемлемы для прогноза исхода и сравнительного анализа групп больных, а не для оценки статуса отдельных пациентов. Именно поэтому они не рекомендованы для прогностической оценки У конкретного больного и не могут быть основой рутинного применения для принятия решения в клинической практике.
Цель использования систем оценки органного повреждения (MODS, SOFA) — другая — описание дисфункции органов,
3 причем с индивидуализацией для конкретного больного. Эти системы, и в частности SOFA, позволяют оценить эффективность проводимого лечения, а не только служить в качестве способа распределения больных по степени бионеустойчивости.
Различия между шкалами оценки состояния больных и шкалами оценки полиорганной дисфункции при АС представлены в табл. 3.3.
Таблице 3.3
полиорганной дисфункции
Отличие шкал оценки состояния больных от шкал определения
|
Шкалы оценки состояния больных (АРАСНЕ-И, SAPS) |
Шкалы оценки полиорганной дисфункции (MODS, SOFA) |
|
Оценка риска летального исхода |
Оценка осложнения |
|
Цель—прогноз |
Цель — описание синдрома |
|
Достаточно сложны для практического использования |
Просты для практического использования |
|
Прогностически значимы для группы больных, не позволяют оценить прогноз у отдельного больного |
Приемлемы для динамического наблюдения за больным |
|
Не дают возможности определить степень дисфункции/недостаточности отдельных систем и органов |
Позволяют оценить степень дисфункции/недостаточности отдельных систем и органов |
Е.Б. Гельфанд и соавторы (2000) пришли к выводу, что использование объективных систем оценки бионеустойчивости
- шкал определения состояния больных — позволяет дать клиническую стратификацию абдоминального сепсиса, оценить прогноз и оптимизировать лечебную тактику. По сравнению с SAPS шкала APACHE II отличается более высокой информативностью. Шкала оценки полиорганной дисфункции SOFA клинически значима и более проста для использования, чем шкала MODS.
У многих больных развитие бионеустойчивости при АС зависит не только от характера поражения брюшины (что, безусловно, является главным), но и от многих других факторов: сопут-
ствующих заболеваний, состояния иммунитета, возраста и др. 3 М. Linder и группа немецких хирургов г. Мангейма разработали специально дня прогнозирования исхода гнойного перитонита индекс, который первоначально включал 15 параметров. Он был опубликован в 1987 г. и получил название Мангеймского перитонеального индекса (МИП). Проведенные позже научные исследования позволили авторам представить переработанный индекс, состоящий из 8 факторов риска несостоятельности биоустойчивости (табл.3.4).
Таблица 3.4
Мангеймский индекс перитонита (МИП)
| Фактор риска | Оценка тяжести, баллы |
| 1. Возраст старше 50 лет | 5 |
| 2. Женский пол | 5 |
| 3. Наличие органной недостаточности | 7 |
| 4. Наличие злокачественной опухоли | 4 |
| 5. Продолжительность перитонита более 24 ч | 4 |
| 6. Толстая кишка как источник перитонита | 4 |
| 7. Перитонит диффузный | 6 |
| 8. Экссудат (только один ответ): прозрачный | 0 |
| мутно-гнойный | 6 |
| калово- гнилостный | 12 |
МИП предусматривает три степени тяжести перитонита. При индексе менее 20 баллов (первая степень тяжести) летальность составляет 0%, от 20 до 30 баллов (вторая степень тяжести) — 29%, более 30 балов (третья степень тяжести) — 100%.
Сравнение разных прогностических шкал применительно к пациентам с перитонитом, проведенное в крупных хирургических клиниках Германии, Австрии и других европейских стран, в том числе в России, показало, что разработанная М. Linder и соавт. шкала хорошо обоснована, обладает высокой чувствительностью и точностью в оценке тяжести течения
3 и прогноза заболевания. С ее применением возможен и обоснован ретроспективный анализ, поскольку для этого требуется только стандартная информация. По прошествии значительного времени МИП получил международное признание как надежная шкала при перитоните. Однако при этом высказываются пожелания дальнейшего повышения его прогностического эффекта. Российские хирурги на объединенном пленуме проблемных комиссий «Неотложная хирургия» и «Гнойная хирургия» единодушно рекомендовали использование этого индекса в практической работе, что обусловлено включением в МИП важнейших составляющих бионеустойчивости при АС.
Для крайних степеней бионеустойчивости характерны признаки органной дисфункции/недостаточности, которые систематизированы в ХНИИОНХ АМН Украины (табл. 3.5).
Таблица 3.5
Признаки органной дисфункции при бионеустойчивости.
о Респираторный дисгресс-сиццром взрослых: РаОг lt; 70 мм рт. ст., Famp;O2/F1O2 lt; 175; о дисфункция сердечно-сосудистой системы: систолическое ДДlt; 90 мм рт. ст., необходимость инотропной поддержки;
дисфункция печени: общий билирубин крови gt; 30 мкмоль/л, повышение уровня трансаминаз и щелочной фосфатазы в 2 раза и более по сравнению с верхней границей нормы;
одисфункция почек: диурез lt; 30 мл/ч, креатинин крови gt; 170 мкмоль/л; о дисфункция системы гемостаза: протромбиновый индекс lt; 70%, тромбоциты крови lt;150х 109/л, фибриноген lt; 2 г/л; одисфункция ЦНС: lt; 15 баллов по шкале комы Глазго
