- Ацидотическая альтерация (АА) и биоэнергетическая недостаточность (БЭН) являются следствием гипо- и патоэнергобиотических изменений ЭС. Их повреждающие компоненты представлены на рис. 2.9.
При АА и БЭН происходит ингибирование Na+-, К+-зависи- мой АТФазы, что ведет к повреждению калий-натриевого насоса и как следствие — к отеку клетки. Внутриклеточный ацидоз, повышение рОг, наличие большого количества жирных кислот являются причиной активации свободно-радикального пере- кисного окисления липидов (СПОЛ). На ранних стадиях оно играет защитную роль: повышает проницаемость сарколеммы, способствует выбросу из поврежденной МКТ лактата и других восстановительных эквивалентов. При дальнейшей интенсификации СПОЛ деструктивные изменения мембранных структур приводят к необратимым сдвигам. Этот процесс рассматривает-
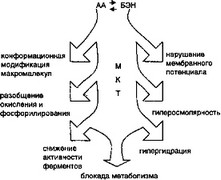
Рис. 2.9. Повреждающие компоненты биоэнергетической недостаточности и ацидотической альтерации
ся как один из универсальных механизмов дезорганизации и гибели клетки.
Внутриклеточное значение pH регулируют антипорты в плазматической мембране. Почти все клетки имеют в составе наружной мембраны (Na+ + Н+) — переносчик-обменник. Катионный обменник играет ключевую роль в гомеостатировании внутриклеточного значения pH (pHi) на уровне 7,1—7,2. Этот переносчик обеспечивает сопряжение выброса ионов Н+ с притоком ионов Na+ и, таким образом, удаляет избыток ионов Н+, образующихся в результате клеточных реакций окисления. В поддержании уровня pHi играет важную роль и анионный (С1' + НСОз) — переносчик. Подобно катионному (Na+ + Н+)- обменнику, работа (Q- + НСОз ) — обменника регулируется значением pH, но противоположным образом. Его активность возрастает при повышении pHi (т.е. когда цитозоль становится слишком щелочным), увеличивая скорость выведения НСОз' из клетки в обмен на С1- и, таким образом, понижая pHi. Сущест-
вуют данные, свидетельствующие о том, что (Na+ + Н+)-обмен- 2 ник может участвовать не только в поддержании pHi, но и в преобразовании внеклеточных сигналов во внутриклеточные.
Взаимодействие анионного и катионного обменников играет важную роль в поддержании внутриклеточного pH. Нарушение его можно классифицировать в зависимости от анионного интервала. АИ — косвенная мера анионов в сыворотке крови, которые не удается определить при рутинном лабораторном анализе. Он соответствует разнице между концентрацией натрия и суммой концентраций хлорида и бикарбоната в сыворотке:
ЛИ = [Na+J -[О]- [HCCh ]
- Недостаточность площади диффузионной поверхности транскапиллярного обмена (ПДГТТО) нарушает перенос вещества через ПДПТО, который обеспечивается одним из трех механизмов: простой диффузией, облегченной диффузией и активным транспортом.
ПТО отделяет МКТ от внутренней среды организма, которая представляет собой совокупность жидкостей (кровь, лимфа, тканевая жидкость), омывающих клетки, околоклеточные структуры и принимающих участие в осуществлении обмена веществ организма. Постоянство внутренней среды и устойчивость основных физиологических функций получило обозначение «гомеостаз», т.е. состояние, при котором все процессы, ответственные за энергетические превращения в организме, находятся в динамическом равновесии. Устойчивое равновесие основных потоков через ПДПТО можно охарактеризовать отношением разделяемых ею емкостей внутренней среды организма. Это общий объем внеклеточной (интерстициальной) жидкости (Vnc), объем циркулирующей крови и, соответственно, плазмы (Упл), а также объемы артериального (Va) и венозного
2 (Vb) русла. Отношение между объемами внесосудистой внеклеточной жидкости и плазмой крови, объемами венозной и артериальной крови составляет 4:1 — 6:1. В этот диапазон укладывается и величина колебаний отношения объемов общей тканевой жидкости (исключая клеточную) и внутрисосудистой (4:1 — 5:1). Сходно отношение площади капиллярной реабсорбции (Sp) и фильтрации (8ф): Бр/Бф = 5,5. В таком же соотношении находятся артериальное (Ra) и венозное (Rb) сопротивления потоку крови (рис. 2.10).
Таким образом, ПДПТО образует рад отношений, сходных по абсолютной величине:
Утк Sp Ve Ra 5 VtvT* 1fc-* RtT* T
При постоянстве распределения ОЦК между артериальным и венозным отделами сосудистого русла ПТО можно определять расчетным методом, используя только гематокритное число смешанной венозной крови. Эго показали проведенные нами определения внеклеточной жидкости и ОЦК. Они подтвердили сохранение постоянства соотношения объемов интерстициального пространства и плазмы.
Вычисление показателя транскапиллярного обмена проводят по формуле:
ПТО= * -1, где:
Г — гематокрит, л/л;
К — коэффициент, равный для мужчин — 3,12, для женщин — 2,88.
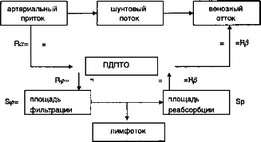
Рис. 2.10. Система потоков через ПДПТО
Таким образом, показатель транскапиллярного обмена характеризует состояние ПДПТО в организме в обобщенном виде, а определение его может существенно расширить возможности клинической оценки биологической устойчивости организма.
ПДПТО определяет ЭС, лимитируя доставку в клетки конечного акцептора в дыхательной цепи — кислорода. Его переносчиком служит гемоглобин (НЬ) — сложный белок из класса хромопротеидов, обладающий способностью присоединять кислород: 1 атом железа связывает 1 молекулу О2. В молекуле НЬ 4 атома железа, следовательно, моль НЬ может связать 4 моля кислорода, т.е. 89600 мл или 1,34 мл О2 на 1 г. Связывание кислорода происходит в легких, где его парциальное давление велико (около 100 мм рт. ст.). В тканях давление должно падать не ниже 38 мм рт.ст. НЬОг диссоциирует на НЬ и О2, доставляя таким образом кислород МКТ. В обратном направлении гемоглобин транспортирует углекислоту. Связывание О2 происходит с помощью аминогрупп белковой части гемоглобина. Скорость движения эритроцитов в капиллярах составляет 0,5—1 мм/сек. Через альвеолярный капилляр эритроцит проходит за 0,12 сек. Эго время и определяет продолжительность контакта эритроци-
2 та с альвеолярным воздухом. В зависимости от ЭДП через капилляр проходит от 300 до 1500 эритроцитов в минуту.
- Уровень среднего капиллярного давления (СКД) и системного АД в организме задает скорость деоксигенации эритроцитов, исключающая БЭН и АА. По сути, средняя линейная скорость капиллярного кровотока является функцией СКД. Для целостного организма усредненный СКД представляет собой градиент между САД и ЦВД, который можно рассчитать по формуле:
СКД = САД/6 + 5/6 ЦВД, мм рт.ст.
СКД обеспечивает гомеосгатирование фильтрационного потока через ПДПТО, если его уровень составляет 10—25 мм рт.ст., что соответствует колебаниям АД в пределах 110/65 — 125/75, а ЦВД — 5—6 мм рт.ст. Реабсорбционный поток через ПДПТО гомеостатирует коллоидно-онкотическое давление белка плазмы крови, если его концентрация составляет 55—70 г/л. Однако общая длина капиллярного русла превышает 100 000 км. Естественно, что для заполнения такой емкости не может хватить даже всего объема циркулирующей крови. Особый механизм регулирует равномерную нагрузку на капилляры, поочередно включая их через какое-то время (от нескольких секунд до нескольких минут). Эго так называемая вазомоция — периодическое прекращение и возобновление тока крови в тканях. Попеременно работают 20—25% капилляров. Следовательно, общая емкость капиллярного русла и его максимальная пропускная способность являются, по сути, постоянными факторами риска развития БЭН. Временное максимальное увеличение объемного капиллярного кровотока в отдельном органе, не обеспечиваемое повышением сердечного выброса, возможно лишь за счет перераспределения крови с уменьшением кровоснабжения других
органов или тканей. Из всего этого следует, что основная задача 2 гомеостатических механизмов микроциркуляции состоит не в увеличении объемного капиллярного кровотока при повышении метаболических нужд тканей, а, по-видимому, в том, чтобы препятствовать развитию недостаточности ПДПТО.
- Сосудисто-тканевой транспорт кислорода
(ИСТГСЬ) высокой интенсивности устраняет недостаточность ПДПТО и связанную с ней БЭН. Его величину можно рассчитать по формуле:
ИСГТ02 = avOl/r (мл/л), где:
av02 — артериовенозная разница по кислороду, мл/л;
Г — гематокрит, л/л.
Должное значение ИСТТО2 для мужчин составляет в среднем 116 мл/л, а для женщин — 128 мл/л.
Доставка Ог в тканевой капилляр определяется в основном двумя факторами:
- содержанием Ог в артериальной крови;
- объемной скоростью тканевого кровотока.
Первая величина является функцией раОг, кислородной емкости гемоглобина и его концентрации. Вторая — задается сердечным выбросом и площадью поперечного сечения перфузи- руемого сосудистого русла, т.е. капилляризацией тканей.
- Напряженный объем крови (НОК) служит точкой опоры центрального кровообращения и микроциркуляции, обеспечивая адекватный для ЭДП возврат венозной крови к сердцу и заполнение микроциркуляторного русла, соответствующее ЭС (рис. 2.11). Сильные стрессоры способны нарушать соответствие ЭС интенсивности кровотока в целостном организме, в отдельных органах и тканях, а также изменять соответствие скорости деоксигенации эритроцитов уровню АД.
2 При этом снижение интенсивности кровотока может лимитиро
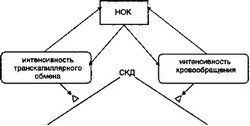
 вать ЭС, что, в свою очередь, компенсируется, частично или полностью, уменьшением АД или увеличением времени деокси- генации эритроцитов в микроциркуляторном русле. Этот адаптационный механизм регуляции ЭДП ограничен минимальным значением АД, еще способным обеспечить фильтрацию воды плазмы из сосудистого русла в ткани. Напротив, при избыточ-
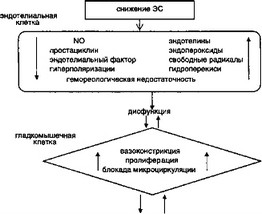
вать ЭС, что, в свою очередь, компенсируется, частично или полностью, уменьшением АД или увеличением времени деокси- генации эритроцитов в микроциркуляторном русле. Этот адаптационный механизм регуляции ЭДП ограничен минимальным значением АД, еще способным обеспечить фильтрацию воды плазмы из сосудистого русла в ткани. Напротив, при избыточ-- Эндотелий является специальным органом, расп- 2 ределяющим ЭДП в соответствии с потребностями МКТ. Эндотелиальные клетки (ЭК) для этого секретируют активные факторы, как в кровяное русло, так и в гладкомышечный слой сосудистой стенки. В настоящее время выделен и изучен ряд эндоте- лийзависимых факторов релаксации и констрикции. К факторам вазодилатации относят оксид азота (N0), простациклин и эндотелиальный фактор гиперполяризации (ЭФГ). Они образуют сложную взаимосвязанную систему регуляции структуры, тонуса и гемостатических свойств сосудистой стенки, обеспечивающую адекватные ответы сосудов при различных уровнях ЭС.
К наиболее изученным факторам вазоконстрикции относят продукты метаболизма арахидоновой кислоты (эндопероксиды), в первую очередь, простагландин Нг и тромбоксан Аг; свободные радикалы и гидроперекиси, выделяемые ЭК при различных воздействиях; конечный продукт действия ангиотензи- нпревращающего фермента (АПФ) — ангиотензин II; эндотелиальные пептиды — эндотелины, из которых наиболее изучен эндотелии-1, рецепторно активирующий стойкую вазоконстрик- цию и пролиферацию гладкомышечных клеток. Увеличение синтеза и секреции вазоконстрикторных факторов под действием гипоксии, при интенсификации кровотока, растяжении сосудистой стенки, под влиянием различных нейромедиаторов в значительной степени снижает вазодилататорные эффекты N0 и простациклина. Нарушение баланса между активностью вазодилататорных и вазоконстрикторных эндотелийзависимых факторов определяют как эндотелиальную дисфункцию. Основными ее проявлениями являются: снижение секреции N0, простациклина и/или ЭФГ; увеличение уровня эндоперекисей и продукции активных форм кислорода; увеличение синтеза эн- Дотелина-1; снижение чувствительности гладкомышечных клеток к вазодилататорам. Самым интересным и важным, на наш
2 взгляд, является представление о том, что эндотелиальная дисфункция есть предиктор и неизменный атрибут патогенеза болезней сердечно-сосудистой системы. Нарушения коронарного кровообращения, ишемическая болезнь сердца, сердечная недостаточность, артериальная гипертензия, метаболический синдром X, геетозы и эклампсия — вот наиболее известные патологические состояния, определенно связанные с эндотелиальной дисфункцией. Дисфункция ЭК может предшествовать ангиографическим и ультразвуковым признакам атеросклероза.
Таким образом, нарушения эндотелиальных функций во многом определяются теми механизмами, изменения которых характерны для процессов развития нарушений биоустойчивосги (рис. 2.12).
ибс-
Нарушения БЦО ; гип^р!ензия
сердечная недостаточность
Рис. 2.12. Эндотелиальные факторы доклинического и паранозологического типового патологического процесса
Существует два основных варианта последовательности со- 2 бытий:
- Дисфункция БЦО эндотелиальная дисфункция блокада микроциркуляции патология (атеросклероз, гипертензия,
ИБС и др.).
- Патология эндотелиальная дисфункция блокада микроциркуляции недостаточность БЦО.
Ог существования одного из этих вариантов во многом зависит стратегия подходов к диагностике, профилактике и лечению. При терапии ряда заболеваний (или их экспериментальных моделей) наряду с улучшением симптоматики наблюдается нормализация функциональных характеристик эндотелия. Так, введение L-аргинина или оксвда азота предупреждает развитие экспериментального атеросклероза. Блокада эндотелиновых рецепторов нормализует NO-зависимые функции эндотелия и способствует обратному развитию атеросклеротических бляшек. Применение ингибиторов АПФ при лечении гипертензии вызывает увеличение способности к дилатации артерий на фоне снижения артериального давления. Заместительная гормональная терапия у женщин после менопаузы приводит к нормализации артериального давления и увеличению базального уровня N0. И, наконец, имеются данные, что изменения регуляции сосудистого тонуса (увеличение констрикции) могут определяться эндотелийзависимыми факторами.
Существует динамическое равновесие между эндотелием и нейтрофилами, которое нарушается при адгезии лейкоцитов к ЭК. Адгезивные молекулы, в число которых входят интраце- люлярные адгезивные молекулы — ICAM-1 и Е-селективные молекулы, легко подвергаются протеолитическому расщеплению и способны поступать из ЭК в гемоциркуляцию. ICAM-1 — это эндотелиальная адгезивная молекула, которая распознается СД11/СД18 адгезивной молекулой циркулирующих нейтрофи-
лов. Е-селекгин — специфическая лейкоцитарная молекула, которая является партнером адрессина — молекулы эндотелиальной поверхности в определенных тканях. Выделение адресси- нов эндотелиальными клетками наступает только при резком снижении ЭДП под влиянием медиаторов воспаления. Следовательно, растворимый Е-селектин может служить специфическим маркером патологической активности ЭК. Стимуляция ЭК, небольшая модификация и повреждение эндотелиальной поверхности сопровождаются экспрессией рецепторов к Fc-фраг- ментам и таким образом может индуцироваться каскад реакций, связанный с активацией системы комплемента. Среди важнейших последствий такой активации следует отметить образование мембрано-атакующего комплекса (С5Ь-С9), ближайшей и непосредственной мишенью которого становятся клеточные мембраны самих ЭК.
Обширные повреждения эндотелиальных и альвеолярных клеток при РДС частично связаны с такой локальной активацией системы комплемента. Эндотелий является одним из основных продуцентов факторов, регулирующих в обоих направлениях все фазы тромбообразования — агрегацию, коагуляцию и фибринолиз. ЭК способны связывать на своей поверхности и эффективно инактивировать тромбин, серотонин и некоторые другие прокоагулянтные агенты, которые освобождаются при активации тромбоцитов. Повреждение ЭК нарушает биоре- гуляторные механизмы распределения ЭДП. Многие цитопато- генные эффекты ЭК опосредуются системой Ь-аргинин-NO. Выделяющаяся в больших количествах индуцибельная окись азота действует, как правило, вместе с супероксидным анионом (О2 ), также выделяемым активируемыми макрофагами, нейтро- филами, другими клетками. Образующиеся в результате реакций между двумя радикалами (N0 и Ог ) пероксинитрит (0N00 ) и двуокись азота (NO2), гидроксильный анион (ОН )
и другие оказывают исключительно сильное цитотоксическое 2 действие. Окись азота, кроме того, нарушает функции митохондрий, тормозя активность ферментов, осуществляющих электронный транспорт. N0 подавляет рибонуклеотидредуктазу (один из ключевых ферментов в процессе репликации ДНК), разрушает ДНК, расщепляет Fe' и Си'содержащие белки с высвобождением свободных Fe2+ и Си2+. Недостаток или избыток окиси азота играет существенную роль в патогенезе ряда заболеваний и патологических процессов в сердечно-сосудистой системе: гипертония, гипотония, шок, понижение насосной функции сердца и нарушение кровообращения при сердечной недостаточности (из-за отрицательного инотропного влияния окиси азота на миокардиоциты), дилатационная идиопатическая кар- диомиопатия, так называемый синдром посгишемической реперфузии, ишемическая болезнь сердца, атеросклероз. Помимо чисто сосудистых эффектов, система L-аргинин — окись азота регулирует агрегацию тромбоцитов. N0 сдерживает проагрега- ционное действие тромбоксана Аг, осуществляя тем самым саморегуляцию тромбоцитами собственной функциональной активности. N0 с успехом была применена в клинике для лечения легочной гипертензии, респираторного дистресса новорожденных и взрослых. Ингаляция окиси азота расширяет легочные сосуды, снижая давление в них, но не вызывает снижения системного АД. Кроме того, вдыхаемая окись азота дилатирует только примыкающие к вентилируемым альвеолам сосуды. В результате происходит шунтирование крови от плохо к хорошо вентилируемым участкам легких, что ведет к уменьшению нагрузки на правый желудочек сердца и улучшает оксигенацию крови.
В случаях передозировки окиси азота развивается резкая метге- моглобинемия, образуется высокотоксичная N02.
N0 играет важную роль в регуляции почечного кровотока, экскреторной функции почек, тубулогломерулярного баланса.
2 Эти эффекты частично осуществляются взаимодействием с сис
темой ренин-ангиотензин и другими биорегуляторами функций почек. При гломерулонефрите обнаружено значительное повышение синтеза окиси азота из-за инфильтрации макрофагами, активации мезангиальных клеток, в которых действует индуци- бельная NO-синтетаза. Сдвиги в активности системы L-арги- нин — окись азота участвуют в механизмах протеинурии, мезан- гиальной пролиферации, лейкоцитарной инфильтрации, патогенезе почечной гипертонии, обструктивных нефропатий с нарушением пассажа мочи. В качестве нейромедиатора в головном мозгу роль окиси азота состоит в сопряжении локальных уровней нейрональной активности и кровотока в одном и том же участке мозга, а также в облегчении выделения нейротрансмиттеров из окружающих синапсов. Поэтому N0 играет существенную роль при спазмах мозговых сосудов после субарахноидального кровотечения, при судорожном синдроме, гипоксии мозга, посги- шемических поражениях и черепно-мозговых травмах.
Из приведенных данных ясно, что любое повреждение эндотелия сопровождается нарушениями распределения ЭДП в МКТ. Окончательную судьбу пострадавших соматических клеток определяет прилегающий эндотелий, биорегуляторные системы которого индуцируют, соответственно тяжести развивающейся БЭН, апоптоз или некроз. Поэтому повреждение эндотелия неизбежно нарушает биологическую устойчивость организма.
