Современная диагностика аневризм брюшной аорты
Помимо указанных выше приемов пальпации живота и общего ангиологического осмотра необходимо собрать тщательный анамнез больного и семейный анамнез для выявления возможных случаев «семейного» формирования АБА.
Для диагностирования артериальной гипертензии целенаправленно обследуют больного с целью определения ее симптомов — вазоренальной гипертензии и особенно опухолей надпочечников. Для диагностики последних решающим методом должна быть компьютерная томография надпочечников. Это очень важно для исхода оперативного вмешательства, поскольку неустраненная феохромоцитома может привести как во время операции, так и в послеоперационном периоде к резким изменениям гемодинамики с самыми тяжелыми последствиями для больного.
При наличии данных о вазоренальном генезе гипертензии внимание специалиста по ультразвуковому сканированию должно быть обязательно обращено на состояние кровотока по почечным артериям, размеры и контур почек, а также на уродина-мику в связи с возможной частичной обструкцией мочеточников.
В план ангиологического обследования обязательным компонентом должна войти ультразвуковая допплерография ветвей дуги аорты и артерий конечностей с целью установления их поражений, а также определения тактики ангиографического обследования и этапности оперативного вмешательства.
Больной должен быть тщательно обследован по поводу поражения коронарных артерий (даже если он не предъявляет жалоб со стороны сердца) с учетом состояния дыхательной функции и мочеполовой системы, особенно почек и предстательной железы. Большую роль играет проведение гастродуоденоскопии при малейших жалобах и наличии в анамнезе язвенной болезни желудка и двенадцатиперстной кишки.
Наиболее простым и доступным методом диагностики аневризм брюшной аорты до недавнего времени была обзорная рентгенография брюшной полости. Признаками заболевания считались тень аневризмы и кальциноз ее стенки (рис. 17). На основании этих изменений диагноз устанавливали, по данным разных авторов, в 50-97% случаев (Gore J., Hirst A. E., 1973 г.;
Collin J., 1990 г.). Однако с появлением современных неинвазив-ных и информативных методов этому способу диагностики придают второстепенное значение вследствие малой диагностической ценности.
Наиболее широко для диагностики АБА в настоящее время используют метод ультразвукового сканирования (УЗС) и особенно его разновидность - цветное дуплексное сканирование (ДС) (Сандриков В.
А. и др., 1996 г.; Спиридонов А. А. и др., 1999 г.; Lindholt J. S. et al., 1999 г.). Это связано с его доступнос-
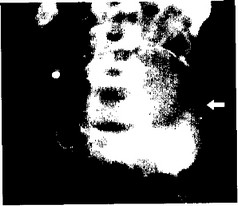
Рис. 17. На обзорной рентгенограмме брюшной полости и за- брюшинного пространства определяются контуры кальцинированной аневризмы брюшной аорты (указаны стрелкой). Снимок произведен в процессе внутривенной урографии.
тью, абсолютной безопасностью, высокой информативностью и чувствительностью. Точность данного метода (чувствительность и информативность) составляет 95—100%, поданным разных авторов (Kremer H. et al., 1984 г.; Спиридонов А. А., Омиров Ш. Р., 1992 г.; Зубарев А. Р., Григорян Р. А., 1992 г.; Lindholt J. S. et al., 1999 г.). Ошибка техники ультразвукового измерения диаметра аорты находится в пределах ±0,3 см (Hollier L. et al., 1992 г.). С помощью этого метода возможно определить характер тромбоза, состояние стенки,
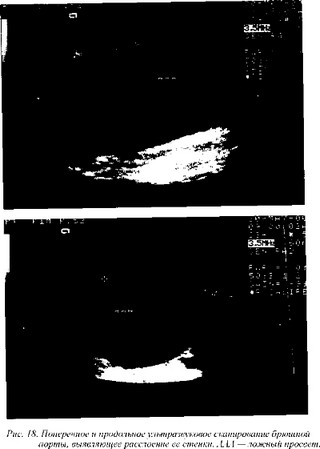
распространенность аневризмы (рис. 18). Немаловажной особенностью УЗС является его относительная дешевизна (Vowden P. et al., 1989 г.). Благодаря всему этому УЗС стал методом выбора при проведении популяционных скринин-говых обследований для выявления АБА (Гамбарин Б. Л. и др., 1986 г.; Кохан Е. П. и др., 1992 г.; Зубарев А. Р., Григорян Р. А., 1992 г.; Спиридонов А. А., Омиров Ш. Р., 1992 г.; Борисов И. В. и др., 1996 г.; Scott R. А. et al., 1988 г.; Morris G. Е. et al., 1994 г.;
Lindholt J. S. et al., 1999 г.). Возможность дополнительного окрашивания улучшает в сравнении с серошкальным изображением визуализацию структур аневризмы: стенок, атеросклеротичес-ких бляшек,
пристеночных тромбов, сохраняющегося просвета (рис. 19).
Недостатком методики, особенно у тучных больных, являются
трудности в определении взаимоотношений АБА с висцеральными, почечными и подвздошными артериями (Григорян Р. А., 1985 г.; Казанчян П. О. и др., 1992 г.; Сандриков В. А. и др., 1996г.).
При ультразвуковом исследовании по методике, принятой в НЦССХ им. А. H. Бакулева РАМН, производилось продольное и поперечное сканирование брюшной аорты сразу под диафрагмой, над бифуркацией и в зоне наибольшего расширения диаметра аорты, а также определялись проксимальный уровень АБА, ее «шейка», размер и положение относительно уровня почечных артерий и, конечно, дистальный уровень поражения, распространение аневризмы на подвздошные артерии.
Важной информацией служили данные о состоянии внутри- мешкового тромба и кальциноза стенок аорты. На рис. 20 представлена атеросклеротическая веретенообразная аневриз-
ма брюшной аорты с циркулярным тромбозом и девиацией аорты влево. Размеры аневризмы: поперечный наружный диаметр — 57,5— 55,9 мм; поперечный внутренний диаметр — 28,0—15,5 мм; продольный размер — 57,9—85,5 мм; диаметр проксимальной шейки
- 21,8 мм, диаметр дистальной шейки — 13, 3 мм. Присте-ночный тромбоз аневризматического мешка при ультразвуковом сканировании по обычной методике не виден, однако с помощью допплеровской приставки со специальной программой он достаточно информативно фиксируется по наличию или отсутствию кровотока на поперечных сканах. На рис. 21 представлена большая
атеросклеротическая веретенообразная аневризма инфра- ренального отдела брюшной аорты с тромбозом по передней и задней стенкам, переходящая на область ее бифуркации, с аневризматическим расширением и деформацией начальных отделов общих подвздошных артерий. Размеры аневризмы: 115—63 — 74,3 мм, диаметр дистальной шейки аневризмы — 35 мм.
Кальциноз также можно оценить ориентировочно по усилению эхосигналов и наличию «следовой дорожки», возникающей за пе- трификатом. Полученные с помощью УЗИ данные были всегда достаточны для выработки плана оперативного вмешательства, и ин- траоперационных неожиданностей нами не отмечено (рис. 22).
С помощью рентгеноконтрастной ангиографии нам не удалось точно определить размеры АБА у 42,9% больных из-за наличия внутримешкового пристеночного тромбоза. При ультразвуковом сканировании этих проблем практически нет. Его результаты, как правило, совпадали с интраоперационными, и разница в измерении размеров АБА в среднем составила 3±0,2 мм, что не является существенным.
Приведем для иллюстрации выписку из истории болезни одного пациента:
Больной Д., 70 лет, поступил в отделение с жалобами на боли в животе и наличие пульсирующего образования. Болен год. При осмотре общее состояние больного удовлетворительное. При пальпации живота в мезогастраль-ной области определялось пульсирующее образование
размером 13х8 см, с систолическим шумом над ним. При ультразвуковом исследовании на продольных и поперечных сканограммах (рис. 23) четко видна аневризма брюшной аорты (размер 11,6х 6,0 см).
При рентгеноконтрастной ангиографии наличие аневризмы не вызывало сомнений, однако размеры ее, по данным этого исследования, были меньше (8,0х5,5 см) (рис. 24). Клинический диагноз: аневризма брюшной аорты.
Произведена операция. Аневризма брюшной аорты была расположена в инфраренальном отделе (размер 12х7 см), полость ее тромбирована. Произведена резекция аневризмы с замещением аорты прямым аллопротезом, эндар-терэктомия из нижней брыжеечной артерии с имплантацией в протез на аортальной площадке (рис. 25).
Послеоперационный период протекал гладко. Больной выписан в удовлетворительном состоянии.
Ультразвуковая диагностика разрывов АБА имеет ряд преимуществ перед ангиографическим исследованием. Это прежде всего простота, меньшее время исследования и большая информативность по сравнению с ангиографией, которая далеко не всегда позволяет диагностировать наличие гематомы. Тампонада отверстия в стенке аорты дезинформирует интерпретаторов ангиограмм.
Забрюшинная гематома имеет несколько вариантов изображения. Контуры ее обычно неровные, трудно дифференцируются, но тем не менее прилегают к стенке аневризматического мешка. Тромботические массы определяются как неоднородная структура.
При разрыве, как правило, устанавливают нарушение целостности всех трех слоев стенки аорты, что позволяет достаточно часто (примерно у половины больных) точно локализовать место разрыва. С помощью УЗИ можно определить даже величину разрыва стенки АБА, которая бывает достаточно большой —1-4 см.
Забрюшинная гематома обычно имбибирует задний листок брюшины, утолщает его, и это при определенном опыте дает возможность фиксировать его на экране монитора. В норме при по-
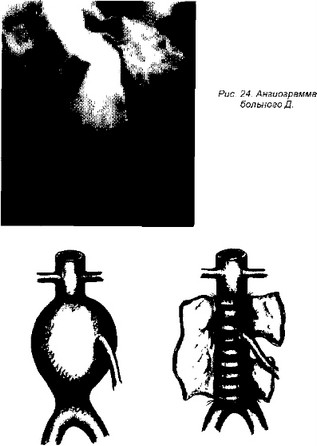
Рис. 25. Схема патологии и операции больного Д., 70 лет. 82
150 больных с поражением магистральных артерий и 13 — с жалобами на наличие опухолевидного образования в животе и чувство усиленной пульсации (Спиридонов А. А. и др., 1992 г.).Следует сразу отметить, что ни у одного из этих 13 больных диагноз не подтвердился: у одного выявлена киста брюшной полости, у двух — опухоли, у остальных — девиация брюшной аорты на фоне артериальной гипертензии.
На экране ультразвукового сканера нормальная брюшная аорта представляет собой конус, суживающийся от супрареналь-ного отдела к бифуркации: диаметр аорты в поддиафрагмаль-ном отделе у мужчин в среднем составил 23,4±0,6 мм, а над бифуркацией — 18,8±0,5 мм, у женщин он меньше — соответственно 19,5±0,5 и 16,4±0,3 мм (рlt;0,05).
У больных с артериальной гипертензией средние показатели диаметра брюшной аорты были выше (под диафрагмой 26,8±0,9 мм, над бифуркацией — 23,4±1,4 мм), чем у лиц с нормальным артериальным давлением (соответственно 23,4±0,6 и 18,8±0,5 мм; рlt;0,05).
Поскольку большинство обследованных больных имели заболевания магистральных сосудов или артериальную гипертензию, то процент выявления АБА оказался достаточно высоким — 6,1. Среди больных с ишемией нижних конечностей этот показатель был несколько выше — 6,9% (7 из 102 больных), причем при изолированных поражениях бедренной артерии подколенного сегмента АБА не обнаружена ни у одного. При поражении подвздошного сегмента частота выявления АБА достаточно высока — 8,3%.
Эти показатели свидетельствуют о том, что механическое препятствие кровотоку в проксимальных отделах артерий нижних конечностей способствует формированию АБА. Очевидно, при этой локализации атеросклероза одновременно поражается и сама стенка инфраренального отдела аорты, что в конечном итоге и определяет развитие аневризм.
Среди больных с артериальной гипертензией частота АБА была еще выше — 11,9% (8 из 67 больных), а при сочетании ее с хронической ишемией нижних конечностей самой высокой — 20,0% (5 из 25 больных). При хронической ишемии нижних конечностей у больных с нормальным артериальным давлением частота АБА была равна лишь 2,6% (2 из 77 больных).
Таким образом, основополагающим фактором для развития АБА в инфраренальном отделе служит атеросклеротический процесс на фоне артериальной гипертензии в сочетании с окклю-зирующими заболеваниями артерий нижних конечностей, особенно в проксимальных ее отделах — в подвздошных артериях, Именно эта группа больных и должна подвергаться обязательному скринингу на наличие АБА даже при отсутствии какой-либо симптоматики.
Обращает на себя внимание и тот факт, что среди 6 больных с аневризмами грудной аорты (исключая посттравматические) у двух при УЗИ обнаружены асимптомные АБА, что составляет по частоте 33,3%. Следовательно, все больные с рентгенологически диагностированными аневризмами грудной аорты должны обязательно подвергаться ультразвуковому сканированию брюшной аорты для установления у них возможного развития асимптомных АБА. Малое количество наблюдений не должно быть причиной сомнений в справедливости этого вывода. При применении специального статистического метода определения доверительных границ относительного показателя в генеральной совокупности с помощью инструментального исследования доказано с 95%-ной вероятностью прогноза (р=95%), что АБА должны выявляться у больных с аневризмами грудной аорты не реже, чем в 27,1% случаев, и не чаще, чем в 39,5%. Этим же статистическим методом определено число больных с теми или иными поражениями аорты и магистральных артерий, у которых обнаружены АБА (табл. 16).
Для медико-биологических исследований достоверными
считаются доверительные границы, установленные с вероятностью
безошибочного прогноза в 95% и более (р=95%). Доверительные границы относительного показателя позволяют судить о
распространенности патологии в генеральной совокупности по наблюдениям, сделанным в выборочной популяции.
Компьютерную томографию проводили у наших больных на аппарате 3-го поколения «Томоскан-СН» фирмы «Филлипс»
(Голландия), в котором используется принцип прямого веерного луча с вращающимся массивом детекторов и пульсирующим источником рентгеновского излучения. Геометрия данного сканера
Таблица 16
Доверительные границы и характер поражения дуги аорты и ее ветвей
Характер и локализация поражения аорты и ее ветвей
Частота выявления АБА, по данным
нцссх
абс. %
Доверительные границы относительного показателя, %
Общая скрининговая группа 150 19 6,7 2,7—10,7
Аневризмы грудной аорты 6 2 33,3 27,1—39,5
Артериальная гипертензия 67 8 11,9 4,0—19,8
Вазоренальная гипертензия 36 2 5,0 0—13,3
Хроническая ишемия
нижних конечностей 102 7 6,9 1,9—11,9
Хроническая ишемия нижних конечностей +
артериальная гипертония 25 5 20,0 4,0—36,0
Ишемическая болезнь
сердца 57 6 10,5 4,0-36
Ишемическая болезнь сердца + хроническая
ишемия нижних конечностей 45 6 13,3 3,3—23,3
Окклюзионные поражения
ветвей дуги аорты 57 2 3,5 0—8,6
Окклюзии висцеральных
артерий (чревного ствола и
верхней брыжеечной
артерии) 300 —
оптимальная для получения компьютерно-томографических изображений высокого качества при возможно минимальной дозе облучения больного. Минимально и время самого сканирования, а также обработки получаемых результатов, что обеспечивает практически одновременную реконструкцию изображения. Максимальный темп сканирования — 12 срезов в минуту. Анод трубки обладает повышенной теплоемкостью, что позволяет выпол-
нять непрерывно до 40 сканов в максимальном режиме (рис. 26). Спиральная томография выполнялась на компьютерном томографе «Toshiba Xpress HS-1».
Предварительной подготовки больного не требуется. На первом этапе выполняют стандартное компьютерно-томографичес-кое исследование брюшного отдела аорты, начиная с уровня ее висцеральных ветвей, что позволяет легко выявить проксималь-ный уровень поражения, всегда достаточно точно фиксируемый при УЗИ. При нормальном диаметре интервисцерального сегмента аорты делают 2-3 томограммы с толщиной среза 8 мм и шагом стола 18-24 мм (рис. 27). При этом обычно достигается уровень левой почечной артерии. Ниже этого уровня шаг стола уменьшается до 4—5 мм, получается изображение обеих почечных артерий и начального отдела (шейки аневризмы брюшной аорты). Ни-
а б
Рис. 26. Ангиограмма (а.) и компьютерная томограмма в режиме SSD (6) больного с аневризмой инфраренального отдела брюшной аорты и левой общей подвздошной артерии.
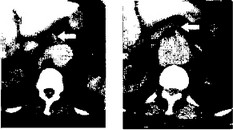
а б
Рис. 27. Компьютерно-томографическое исследование брюшного отдела аорты. На фоне выраженного кальциноза аорты определяется отхождение чревного ствола (а) и верхней брыжеечной артерии (6} от аневризматическо-го мешка (указаны стрелками).
же почечных артерий шаг стола увеличивается до 8 мм. При этом четко фиксируются отклонения хода аорты (обычно вперед и вправо). Важно определить состояние и общих подвздошных артерий, которые нередко вовлекаются в аневризматический процесс.
Для получения изображения просвета аневризмы, внутримеш- кового тромбоза, расслоения, кальциноза применяют контрастное усиление изображения с помощью болюсного введения контрастного вещества — внутривенно 40 мл со скоростью 3 мл/с (рис.28).
Получение изображения внутримешкового тромбоза очень важно для выбора хирургической тактики. Плотность крови в просвете аорты обычно составляет 45—50 Ед., в то время как плотность тромботических масс меньше — 30—40 Ед.
Тромбы могут располагаться тонким пристеночным слоем или по одной из стенок аорты и иметь характерную форму «серпа». Иногда тромботическая чашка может быть циркулярной толстой и на ангиограмме выглядеть как нормальный просвет аорты. В таких случаях разрешающая способность компьютерной томографии превышает информативность ангиографическо-
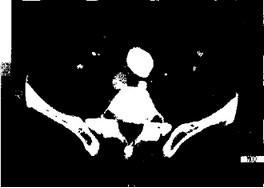
Рис. 28. Компьютерно-томографическое исследование брюшного отдела аорты с контрастным усилением изображения.
го исследования. Если тромботические массы расположены по задней поверхности, то это позволяет предполагать окклюзию устьев поясничных артерий, и в результате кровопотеря во время операции будет меньше.
Очень существенно определение кальциноза стенки аорты, особенно в сегментах предполагаемого наложения проксималь-ного и дистального анастомоза. Это поражение стенок аорты бывает очень серьезным препятствием для хирурга во время операции, и лучше быть подготовленным к нему заранее (рис. 29). Разрешающая способность компьютерной томографии для определения тромбоза равна 80%, кальциноза — более 90%.
С помощью этого метода исследования можно распознать и осложненное течение аневризмы брюшной аорты — расслоение, угрозу разрыва и сам разрыв. Специфическим признаком расслоения аорты служит наличие отслоенной интимы, возникновению которой могут способствовать разнообразно располагающиеся в интиме (перпендикулярно, хаотично, как бы находясь в просвете мешка) глыбки кальция (рис. 30). При контрастирова-нии ложный просвет достаточно хорошо визуализируется. Плот-88
29. ¦ Рентгеновская компьютерная томогра
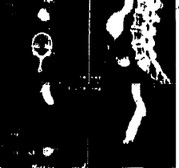 фическая ангиография (компьютерная ангиография) аневризмы инфрареналь-ного отдела брюшной аорты (многоплоскостная реконструкция —— i MPR).
фическая ангиография (компьютерная ангиография) аневризмы инфрареналь-ного отдела брюшной аорты (многоплоскостная реконструкция —— i MPR).


Рис. 30. Компьютерная томограмма висцерального отдела брюшной аорты, демонстрирующая наличие расслоения (указано стрелкой) и отхождение верхней брыжеечной артерии и правой почечной артерии от истинного просвета аорты, а левой почечной артерии — от ложного просвета аорты (реконструкция с затененной наружной поверхностью — SSD}.
ность крови в истинном и ложном просвете аорты достаточно велика (до 130—200 Ед.), в то время как плотность отслоенной ин-тимы значительно ниже (40-50 Ед.).
Кровоток по ложному просвету нередко замедлен, и это запаздывание позволяет достаточно информативно дифференцировать истинный просвет от ложного, особенно при построении графика «время—плотность» над областью двух просветов аорты. Если ложный просвет тромбируется, то он по плотности идентичен внутрипросветному тромбозу, однако при этом отслоенная интима будет хорошо визуализироваться в виде прямолинейного образования с кальцинозом.
При полном разрыве стенки АБА гематома обнаруживается за пределами стенки аневризмы аорты, где ее стенками могут стать позвоночник и обычно смещенная левая поясничная мышца. Подобная картина визуализируется при забрюшинном прорыве аневризмы брюшной аорты.
В течение последних лет наблюдается бурное развитие меди - цинской техники. Рентгеновская компьютерная томография (КТ) является одним из самых ярких примеров практической реализации достижений научно-технического прогресса в области лучевой диагностики. Как известно, в 80-е годы КТ фактически вышла на «плато» своего развития. Преимущества непрерывно развивающейся магнитно-резонансной томографии (МРТ) перед КТ, особенно после внедрения магнитно-резонансной ангиографии (МРА) и быстрых (градиентных) импульсных последовательностей, были очевидными. Однако эта ситуация стала меняться в начале 90-х годов после появления спиральной КТ (СКТ) (рис. 31). Создание этой технологии позволило преодолеть ряд существенных недостатков и ограничений КТ и дало мощный толчок дальнейшему развитию метода. СКТ, в свою очередь, дала начало такому направлению, как рентгеновская компьютерная томогра-фическая ангиография (КТА), компьютерная ангиография. Всего за несколько лет КТА превратилась в один из важнейших методов исследования сосудов.
С середины 80-х годов появилась еще одна разновидность рентгеновской компьютерной томографии — электронно-луче-
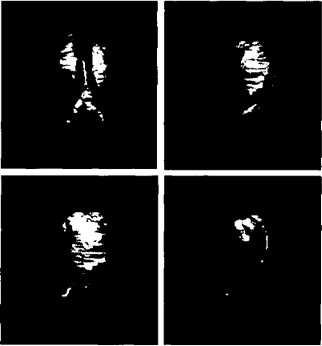
Рис. 31. Компьютерная томограмма брюшной аорты при ее аневризме в разных проекциях. SSD-способ представления данных объемной КТ (реконструкция с затененной наружной поверхностью}.
вая томография (ЭЛТ), радикально отличающаяся от КТ по технике получения изображений. Уникальная технология ЭЛТ позволила в 10—20 раз сократить время получения одного среза. Однако по объективным (высокая стоимость) и субъективным (негативное отношение некоторых специалистов, конкурентная
борьба) причинам применение данной методики на сегодняшний день весьма ограничено.
По сравнению с обычной КТ, СКТ представляет гораздо больше возможностей для трехмерных реконструкций (рис. 32). Реконструкция изображений с перекрывающимися срезами позволяет получать трехмерные реконструкции несравненно более высокого качества.
Можно отметить следующие основные достоинства СКТ:
- Объемная визуализация всей исследуемой анатомической области без артефактов от движений.
- Лучшее выявление очаговых изменений в движущихся при дыхании органах (легкие, печень, селезенка).
- Оптимальная визуализация болюса контрастного вещества в различные фазы, что приводит к более четкой визуализации сосудов и позволяет выполнять трехмерные реконструкции (КТА).
- Возможность ретроспективной реконструкции срезов с варьирующим шагом (интервалом) после окончания исследования.
- Улучшение качества многоплоскостных реконструкций.
- Уменьшение лучевой нагрузки из-за более широких возможностей ретроспективной реконструкции изображений (реже приходится прибегать к повторным исследованиям с другой толщиной и шагом срезов).
- Уменьшение времени исследования пациентов и соответственно увеличение пропускной способности приборов. Высокая скорость получения изображений имеет особенно большое значение при исследовании пациентов, находящихся в тяжелом состоянии (например с травмой), лиц, плохо выполняющих команды медперсонала, детей, пожилых пациентов.
СКТ практически не имеет недостатков по сравнению с обычной КТ и имеет те же ограничения по отношению к другим методам визуализации (например МРТ), что и обычная КТ (лучевая нагрузка, необходимость введения контрастных веществ, малая вариабельность плоскости среза, относительно невысокое контрастное разрешение).
При КТА брюшной аорты возможности ЭЛТ и СКТ примерно
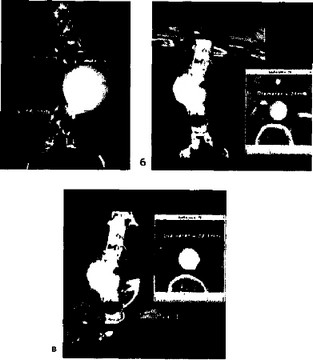
Рис. 32. Современные возможности представления данных объемной КТ с применением реконструкции с затененной наружной поверхностью и отображением нескольких поверхностей с различными их свойствами: а — общий вид аорты; б — общий вид аорты с параметрами проксималь-ной шейки; в — общий вид аорты с параметрами дисталь-ной шейки.
одинаковы. Хотя в большинстве случаев УЗИ служит адекватным методом выявления аневризм брюшной аорты, при планировании хирургического лечения для их детальной оценки обычно используют КТА или МРА. При адекватно выполненной КТА можно обойтись без брюшной аортографии. КТА можно считать адекватно выполненной, если на основании данных обследования можно ответить на вопросы о том, какова точная локализация аневризмы по отношению к основным ветвям брюшной аорты; ее диаметр на разных уровнях и протяженность; наличие вну-триполостных тромбов, кальцинатов, отслоившейся интимы, па-рааортальных гематом; состояние ветвей аорты (наличие стенозов, окклюзии, аберрантных и вариантных сосудов).
Зона анатомического охвата при исследованиях брюшной аорты должна быть достаточно большой — желательно от диафрагмы до начальных сегментов общих подвздошных артерий. Обычно используют срезы 5/5 или 6/6 мм. Если необходима более детальная оценка ветвей аорты, то при ЭЛТ возможно выполнить обследование всей анатомической области со срезами 3/3 мм. В случае КТ можно рекомендовать использование спиралей с различной толщиной среза и различным шагом на фоне двухфазного протокола введения контрастного препарата. Срезы по 2—3 и 1-1,5 мм наиболее подходят для оценки чревного ствола и почечных артерий. После прохождения этих сегментов можно использовать более толстые срезы 5/5 или 6/6 мм для исследования нижних отделов брюшной аорты до уровня подвздошных артерий. У некоторых больных аневризмы распространяются на подвздошные артерии, в этих случаях область исследования приходится перемещать дистальнее.
У большинства больных с абдоминальными аневризмами аорты поперечные срезы позволяют получить всю информацию, необходимую для диагностики и планирования хирургического вмешательства.
Помимо указанных методов диагностики необходимо проводить детальное рентгенологическое исследование, включающее следующие методы:
- рентгенография осанок брюшной полости и забрюшин-ного пространства в прямой и боковой проекциях с целью выяв
ления кальциноза мешка, тени самого мешка (обычно слева от позвоночника) с помощью мягких рентгеновских снимков (важным симптомом служит тот факт, что газ в кишечнике как бы раздвинут в стороны от центра брюшной полости), а также редкого признака узурации передней поверхности тел поясничных позвонков (II-III-IV-V) в боковой проекции; - томография органов забрюшинного пространства на фоне пневморетроперитонеума, позволяющая дифференцировать аневризму аорты от опухолей органов забрюшинного пространства и получить информацию о размерах и форме почек;
- внутривенная урография, с помощью которой можно установить отклонение почек, мочеточников, а также диагностировать аневризмы подвздошных артерий (обусловливающие необычный ход мочеточников), подковообразную почку, опухоль или кисту почек.
В предварительный диагностический комплекс исследований следует обязательно включить радиоизотопные методы:
- Сцинтиграфия почек дает возможность дифференцировать аневризму брюшной аорты и подковообразную почку, а также выявить функциональное состояние почек.
- Радионуклидная ангиография. Визуализация брюшной аорты, ее ход, участки расширения и стенозов четко фиксируются на гамма- камере при внутривенном введении Те". Следует отметить, что с проникновением изотопа в тромботические массы аневризматического мешка информативность данного метода может быть более высокой, чем рентгеноконтрастной ангиографии. При применении обоих методов значительно повышается информативность диагностических средств.
- Рентгеноконтрастная ангиография. Благодаря современному комплексу диагностических неинвазивных методик ряд авторов не проводят ангиографическое исследование (Покровский А.
В., 1979 г.). До эры внедрения неинвазивных методов лучевой диагностики ангиография была практически единственным методом топической диагностики заболевания (Даниленко М. В. и др., 1980 г.; Дмитриев О. П. и др., 1980 г.; Baur G. М. et al., 1978 г.;
Kwaan J., 1977 г.; Robicsek F., 1981 г.; Bunt T. J., Cropper L, 1986 г.).
Приведем клинический пример диагностики и хирургического лечения аневризм брюшной аорты в нашем отделении на более ранних этапах работы.
Б-ой К., 68 лет, поступил в отделение с жалобами на боли в животе. Болен 3 месяца. При пальпации в мезогаст-ральной области определялось пульсирующее образование (размер 15— 12 см). При эхографии обнаружена аневризма брюшной аорты (рис. 33).
При рентгеноконтрастной аортографии отмечена неровность контуров, изгиб и диффузное расширение ин- фраренальной аорты (диаметр 3 см) в результате контрастирования лишь свободного от тромбов просвета. Об этом свидетельствует тень неконтрастированной части расширенной аорты и смещение ее ветвей (рис. 34).
На серийных ангиограммах обнаружен умеренный стеноз чревного ствола, почечных и подвздошных артерий.
Клинический диагноз: аневризма брюшной аорты. Стеноз чревного ствола, почечных и подвздошных артерий. Хроническая коронарная недостаточность.
Произведена операция. Аневризма брюшной аорты располагалась в инфраренальном отделе (размер 12х8 см). Полость аневризмы была заполнена тромботическими массами. Произведена резекция аневризмы аорты с аортальным протезированием. В послеоперационном периоде наблюдались ухудшение коронарного кровообращения и умеренная почечная недостаточность, с которой удалось справиться благодаря медикаментозной терапии. Больной выписан в удовлетворительном состоянии.
На данном этапе развития сердечно-сосудистой хирургии рентгеноконтрастная ангиография уступила первенство в диагностической значимости более современным методикам (Todd G. J. et al., 1991 г.). Этому способствовал ряд обстоятельств. Во-первых, использование этого метода часто приводит к ложноотрицательным результатам при аневризмах небольшого диаметра, тромбозе ее полости, так как ангиография дает представление только о диаметре функционирующего просве-
Рис. 33. Двухмерные эхо- граммы (a — продольная, 6 — поперечная) брюшной аорты больного К., 68 лет. А — левая общая подвздошная артерия;
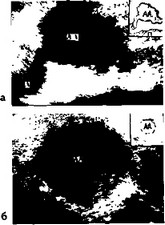 АА — аневризма аорты.
АА — аневризма аорты.


Рис. 34. Аортограмма больного К., 68 лет, с аневризмой брюшной аорты. На аортограмме виден контрастированный просвет аневризмы, свободный от тромбов (amp;). Тромбо-тическая чаша (б), извлеченная из полости аневризмы во время операции у этого больного.
та, а не о наружном диаметре аорты (Todd G. J. et al., 1991 г.). Кроме того, исследование может приводить к осложнениям, непосредственно связанным с катетеризацией, необходимостью внутриартериального введения рентгеноконтрастных веществ, что нежелательно для некоторых групп пациентов (например у больных с почечной недостаточностью). Основное поле применения ангиографии на сегодняшний день ограничивается случаями АБА, когда необходимо уточнять состояние ветвей брюшной аорты (висцеральных, почечных и артерий нижних конечностей) и вовлечение их в аневризму (Казанчян П. О. и др., 1993 г.;
Белозеров Г. Е. и др., 1999 г.; Landtman M. et al., 1984 г.).
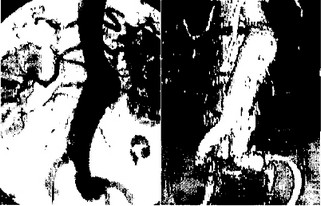
Следует, однако, учитывать, что только ангиографическое исследование позволяет получить наиболее полную и достоверную информацию, а значит, обеспечивает выбор наиболее оптимального хирургического доступа, объема операции с максимальным радикализмом и минимальной травматичностью (рис. 35).
Методом выбора следует считать трансфеморальную ангиографию по Сельдингеру в двух проекциях (рис. 36). Но необходимо помнить об опасности данной методики при поражении подвздошных извитых артерий в плане перфорации их стенок, тромбоза, тромбоэмболии, расслоения стенок (рис. 37). При ясности
проксимального уровня аневризмы в подобных случаях возможно проведение высокой транслюмбальной аортографии. При поражении подвздошных артерий и при супраренальной локализации аневризмы показана ангиография через подмышечную артерию.
Трактовка ангиограмм должна быть направлена на установление размеров аневризмы, ее локализации, состояния проксимального сегмента и путей оттока, а также состояния ветвей брюшной аорты и степени их вовлечения в процесс.
Малыми следует считать аневризмы диаметром 3—5 см, средними — 5-7 см, большими — более 7 см. Последние крайне опасны в плане разрыва (76%, по данным Bernstein Е. Р., 1978 г.). Существуют и аневризмы «гигантских» размеров, превышающие нормальный диаметр инфраренального сегмента аорты (1,5—1,7 см) в 8-10 раз.

Рис. 35. Ангиограмма: а — больного с ложной аневризмой проксимального и обоих дистальных анастомозов после операции бифуркационного аортобедренного шунтирования;
6 — больного с ложной аневризмой супраренального отдела аорты.
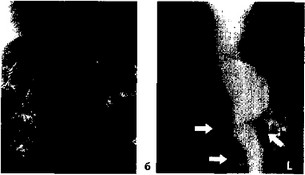
Рис. 36. Ангиограмма: а — прямая проекция при аневризме ин-
фраренального отдела брюшной аорты; б — боковая проекция при супраренальной аневризме брюшной аорты (стрелками указаны почечные артерии и верхняя брыжеечная артерия).

Таблица 17 Сопутствующие заболевания у больных с
АБА
|
Заболевание |
Число больных абс. % |
|
|
Хроническая ишемическая болезнь сердца |
143 |
44 |
|
из них с инфарктом миокарда в анамнезе |
69 |
21 |
|
Хроническая ишемия головного мозга |
32 |
10 |
|
из них с инсультом в анамнезе |
9 |
3 |
|
Артериальная гипертензия (160/90) |
158 |
49 |
|
Хронические заболевания легких |
142 |
44 |
|
Хроническая почечная недостаточность |
87 |
27 |
|
Язвенная болезнь желудка и двенадцатиперстной кишки |
26 |
8 |
|
Пороки клапанов сердца |
9 |
3 |
|
Прочие (сахарный диабет, глаукома, аденома |
|
|
|
предстательной железы) |
16 |
5 |
Таблица 18
Характер поражения артерий нижних конечностей у оперированных больных с АБА, по данным ангиографии и УЗДГ
Число больных
Локализация и форма поражения
|
|
Источник: Бокерия Л.А., «Аневризмы аорты» 2001 А так же в разделе «Современная диагностика аневризм брюшной аорты » |