На основе многолетнего опыта нами разработан алгоритм и предложена оптимальная схема инвазивной ПД хромосомных болезней (рис. 9.9). Ее важными составляющими являются: 1) приготовление хромосомных препаратов «прямым» способом и анализ дифференци-
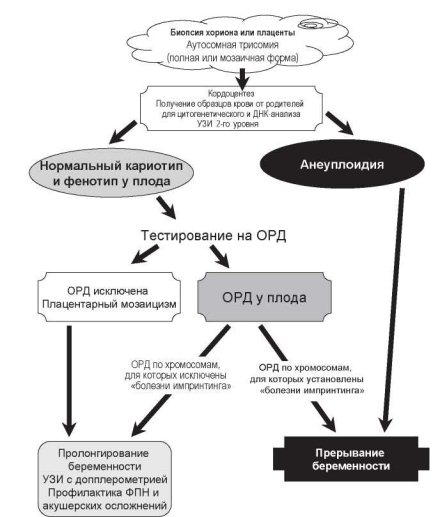
Рис. 9.8. Диагностический алгоритм при подозрении на однородительскую дисомию у плода
ально окрашенных хромосом уже через 3-4 часа после хорион- или плацентобиопсии; 2) кариотипирование с использованием системы анализа изображений в интерактивном режиме; 3) реальные условия для диагностики моногенных и хромосомных болезней на одном образце плодного материала.
Алгоритм состоит из нескольких последовательных этапов (рис. 9.9). Цитогенетический анализ начинается с анализа дифференциально окрашенных хромосом на «прямых» препаратах из хориона или плаценты. При нормальном кариотипе у плода рекомендуется продолжение беременности. При недостаточной митотической активности в клетках цитотрофобласта рекомендуется повторная биопсия. В случае однотипной хромосомной патологии во всех проанализированных метафазных пластинках рекомендуется прерывание беременности.
При обнаружении в образцах хориона или плаценты структурных перестроек или сверхчисленных маркерных хромосом обязательным этапом обследования является кариотипирование родителей и УЗИ второго или экспертного уровня. Как правило, предлагается проведение кордоцентеза для уточнения кариотипа плода. Аналогичная тактика (УЗИ второго или экспертного уровня и кордоцентез) целесообразна и в случаях обнаружения хромосомного мозаицизма в плаценте. По результатам кордоцентеза с учетом данных УЗИ рекомендуется продолжение беременности или, в случае подтверждения патологии, ее прерывание.
Если показанием к инвазивной ПД является высокий риск моногенной болезни у плода, то после исключения основного диагноза методами ДНК-диагностики, целесообразно провести анализ кариотипа у такого плода. Сочетание моногенной болезни и патологии кариотипа у одного и того же плода, в действительности, встречается не так редко. В частности, нами зарегистрировано несколько случаев хромосомной патологии плода у беременных, направленных на ПД гемофилии, миодистрофии Дюшенна, муковисцидоза и фенилкето- нурии. Поэтому во избежание повторных инвазивных вмешательств при планировании ПД моногенных болезней необходимо предусмотреть получение материала, пригодного не только для ДНК- диагностики, но и цитогенетического анализа.
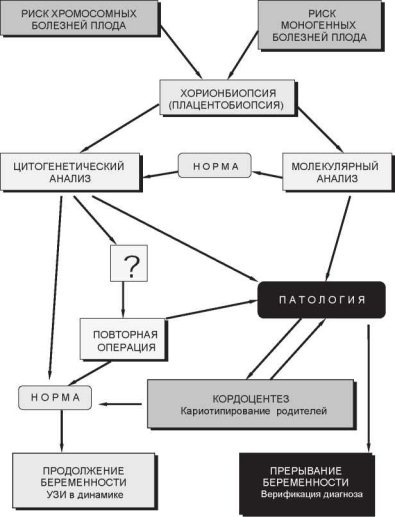
Рис. 9.9. Принципиальная схема инвазивной пренатальной диагностики наследственных болезней
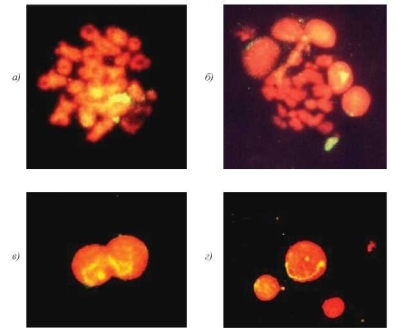
Рис. 4.3. Клетки сперматогенного ряда из образца эякулята пациента с кариотипом 46,XY и микроделецией в локусе AZF (а — стадия диакинеза; б—метафаза I; в, г — спер- матоциты II). FISH c цельнохромосомным ДНК-зондом к хромосоме Х
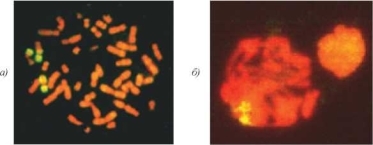
Рис. 4.4. Метафазная пластинка из ФГА-стимулированного лимфоцита периферической крови (а) и сперматоцит I из образца эякулята (б) от пациента с кариотипом 46,XY,t(9;13). FISH c цельнохромосомным ДНК-зондом к хромосоме 9
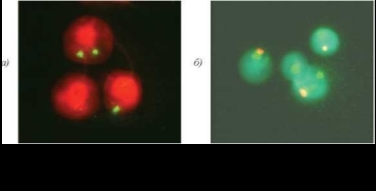
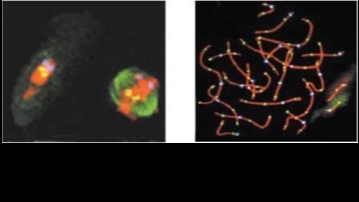
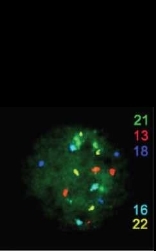 Рис.4.14. Мультиплексная FISH с ДНК-зонда- ми, специфичными к прицентромерным районам хромосом 13, 16, 18, 21 и 22 (указаны соответствующим гибридизационному сигналу цветом) на изолированном бластомере от триплоидного эмбриона (любезно предоставлено CMackie Ogilvie, Gay Hospital, London)
Рис.4.14. Мультиплексная FISH с ДНК-зонда- ми, специфичными к прицентромерным районам хромосом 13, 16, 18, 21 и 22 (указаны соответствующим гибридизационному сигналу цветом) на изолированном бластомере от триплоидного эмбриона (любезно предоставлено CMackie Ogilvie, Gay Hospital, London)
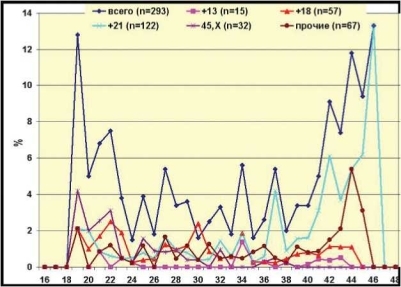
Рис. 6.1. Частота гетероплоидии у плодов в зависимости от возраста матери (по результатам пренатального кариотипирования в 10-26 недель беременности без учета показаний к инвазивной пренатальной диагностике). По оси абсцисс — возраст беременной (в годах), по оси ординат — частота плодов с геномными мутациями (в % от общего числа пренатальных диагностик, выполненных в каждой возрастной группе). Группа “Прочие” объединяет случаи 47,ХХХ, 47,XXY, 47,XYY, триплоидии, а также аутосомные трисомии 7, 9, 22
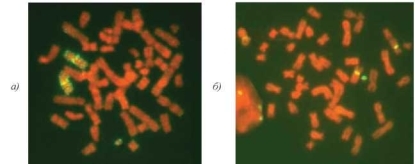
Рис. 6.10. Идентификация маркерной хромосомы der (7). Метафазные пласт-инки из ФГА- стимулированных лимфоцитов: FISH c ДНК-зондом, специфичным к прицентромерному району хромосомы 7 (а) и c цельнохромосомным ДНК-зондом 7 (б)
 Рис. 10.12. Общность рисунка линейной дифференцированности метафазных хромосом из эмбриональных клеток человека при различных способах воздействия: а — методRBA (хромосомы из ФГА- стимулированных лимфоцитов пуповинной крови, полученных при кордоцентезе в 22 недели беременности); б — метод ник-трансляции in situ с предобработкой HpaII (хромосомы из эмбриональных клеток медицинского абортуса 5/6 недель беременности, слева - FITC+PI, справа — FITC)
Рис. 10.12. Общность рисунка линейной дифференцированности метафазных хромосом из эмбриональных клеток человека при различных способах воздействия: а — методRBA (хромосомы из ФГА- стимулированных лимфоцитов пуповинной крови, полученных при кордоцентезе в 22 недели беременности); б — метод ник-трансляции in situ с предобработкой HpaII (хромосомы из эмбриональных клеток медицинского абортуса 5/6 недель беременности, слева - FITC+PI, справа — FITC)
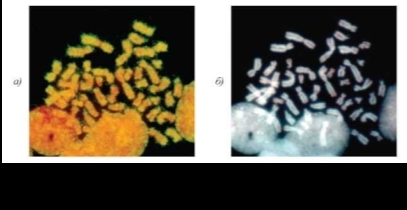

Рис.10.15. Распределение ник-трансляционного сигнала (желтый) на метафазной хромосоме 11 из клеток цитотрофобласта хор-иона после предобработки Hpa II (а) и ДНКазъР (б). Указаны районы Т-сегментов (Hpl5, Hql3, Hq23)

Рис.10.17. Различия в интенсивности флуоресценции ник-трансляционного сигнала в районе 15q11-q13 (предобработкаНра II) на гомологичных хромосомах из метафазной пластинки (аутопсийный материал почки от медицинского абортуса, беременность 6/7 недель). Регистрация изображений каждого из гомологов в последовательности слева направо — DAPI, FITC+PI, FITC, PI
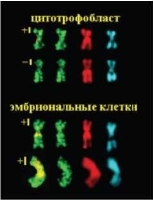
Рис.10.18. Метафазные хромосомы 11 из цитотрофобласта хор-иона и эмбриональных клеток (аутопсийный материал от медицинского абортуса, беременность 8/9 недель) после ник-трансляции in situ c предобработкой Нра II. Гомологи хромосомы 11 из метафазных пластинок соответствующих тканей расположены по вертикали. Регистрация изображений каждой из хромосом в последовательности слева направо — FITC+PI, FITC, PI, DAPI. Наличие ник-трансляционного сигнала в районе 11р15 отмечено знаком «+», отсутствие сигнала — знаком «-»
