Эффекторные механизмы иммунного ответа. Взаимосвязь факторов врожденного и адаптивного иммунитета
Особенности развития иммунного ответа определяются природой и локализацией патогенов. Существует 3 главные стратегии адаптивного иммунитета в отношении внутриклеточных и внеклеточных патогенов (рис. 1.7). Наиболее разнообразные эффекторные механизмы задействованы в защите от внеклеточных патогенов, при которой преобладает гуморальный иммунный ответ. Основные эффекторные молекулы при этом — антитела, секретируемые плазматическими клетками, дифференцирующимися из В-лимфоцитов при участии Th2-клеток.
Антитела способны связываться с антигенами, представленными как на клеточной мембране, так и в свободной растворимой форме. Прямое защитное действие антител в отношении свободных антигенов проявляется в нейтрализации их биологической активности (наиболее характерный пример — нейтрализация токсинов). В отношении антигенов, связанных с мембраной патогена, нейтрализующее действие антител проявляется в изменении биологической активности микроорганизма, например, в подавлении его подвижности или способности к адгезии на клетках хозяина, в предотвращении инфицирования вирусом клетки и т.д.
Более универсальны защитные механизмы, реализуемые антителами с участием других факторов или клеток. Главный из них — опсонизация — покрытие клеток молекулами иммуноглобулинов, облегчающими их распознавание и поглощение фагоцитами, которые имеют на мембране рецепторы для «хвостовой» части антител (Fc-рецепторы). Опсонизация значительно ускоряет фагоцитоз патогенов. Другой механизм защитного действия антител состоит в активации комплемента по классическому пути. Комплекс «антиген—антитело» связывает сывороточный фактор C1q, что вызывает каскадную активацию других компонентов комплемента. Этот процесс имеет
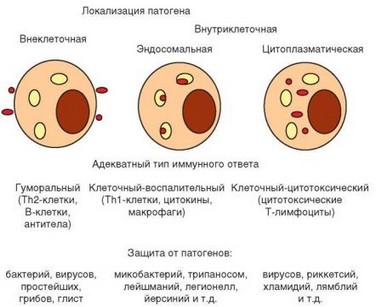
Рис. 1.7. Стратегия иммунной защиты зависит от локализации патогена
2 основных эффекта. Первый и главный из них — опсонизация клеток, но не антителами, а продуктами расщепления С3-компонента — C3b. Фагоциты имеют рецепторы к фрагментам С3 компонента и легко распознают опсони- зированный патоген. Второй результат, опосредующий защитный эффект комплемента, — цитолиз клетки за счет формирования мембраноатакующего комплекса. Кроме того, имеющие Fc-рецепторы естественные киллеры распознают опсонизированную антителами клетку и вызывают ее лизис по контактному механизму. Наконец, антитела облегчают распознавание патогенов макрофагами, имеющими высокоаффинные Fc-рецепторы, что резко усиливает защитные свойства этих клеток.
Защита от другой разновидности внеклеточных патогенов — макропаразитов (гельминтов) также осуществляется по ^2-зависимому механизму. Однако в этом случае наибольшую роль играют эозинофилы, привлекаемые цитокинами, которые секретируют ^2-лимфоциты и тучные клетки. Эозинофилы располагаются по поверхности паразита и выделяют содержащиеся в их эозинофильных гранулах высокоактивные белки, убивающие паразитов.
Антитела не способны проникнуть внутрь клеток и фактически бессильны против патогенов, имеющих внутриклеточную локализацию. Для защиты от внутриклеточных патогенов иммунная система имеет 2 стратегии. Как уже упоминалось, TM-клетки активируют макрофаги. При взаимодействии этих клеток ТЫ-лимфоцит получает дополнительный стимул через TCR, а макрофаг — через действие IFNy и костимулирующую молекулу CD40. Этот
«диалог» приводит к дополнительной активации макрофагов, в частности, к повышению бактерицидной активности этих клеток и формированию нового фактора — оксида азота и его производных (благодаря экспрессии макрофагами индуцибельной NO-синтазы). Это стимулирует разрушенние внутриклеточных патогенов, резистентных к действию факторов врожденного иммунитета до подключения Т-хелперов.
Таким образом, в данном случае истинными эффекторами становятся клетки врожденного иммунитета — макрофаги, завершающие элиминацию патогенов, поглощеных ими путем фагоцитоза. Только стимулирующие сигналы, поставляемые ТЫ-клетками, позволяют реализовать этот способ защиты от внутриклеточных (поглощенных, но не разрушенных) патогенов. В процессе иммунного ответа возникает еще одна разновидность индуцируемых Т-хелперов — Th17 (названы по доминирующему продукту — IL-17). Они привлекают нейтрофилы и реализуют свои эффекты, активируя эти клетки. В то же время их действие часто переходит в область патологии, выражающийся в развитии аутоиммунных процессов.
Другая стратегия борьбы с внутриклеточными патогенами направлена на элиминацию локализующихся в цитозоле патогенов (микоплазмы, лямблии и т.д.) или вирусов, геном которых интегрируется в геном клетки. Если в основе предыдущего механизма лежит усиление активности эффекторных клеток врожденного иммунитета, позволяющее им «излечиться» от патогена, то в данном случае иммунная система выбирает более радикальный путь — убивает инфицированную клетку вместе с патогеном (убитая клетка затем фагоцитируется). Функцию киллеров выполняют цитотоксические СD8+ Т-лимфоциты, отличающиеся от естественных киллеров не столько механизмом цитолиза, сколько специфичностью: прежде чем убить клетку, цитотоксический Т-лимфоцит должен распознать антигенный пептид патогена, выносимый на поверхность клетки-мишени в составе молекул MHC-I. Такой же механизм иммунная система использует при борьбе с опухолевыми клетками и при отторжении чужеродного трансплантата. Он же может участвовать в развитии аутоиммунной патологии (сахарный диабет I типа и др.).
Сопоставляя эффекторные механизмы врожденного (реализуемые на первой линии защиты) и адаптивного иммунитета (формируются в ходе иммунного ответа), следует отметить их сходство; при адаптивном ответе они незначительно модифицируются. Действительно, и во врожденном, и в адаптивном иммунитете используется киллинг патогенов или инфицированных клеток, регулируемый цитокинами или антителами. Таким образом, под влиянием факторов адаптивного иммунитета фагоцитоз интенсифицируется и становится более целенаправленным. Т-киллеры действуют подобно натуральным киллерам, но спектр их мишеней ограничен специфичностью их рецепторов, т.е. Т-киллеры действуют более избирательно. Внеклеточный цитолиз, осуществляемый эозинофилами, при адаптивном ответе проявляется локально благодаря выработке цитокинов, привлекающих эозинофилы к гельминтам. Наконец, реакции комплемента, активируемого через альтернативный и классический пути, приводят к одинаковым результатам, но включаются по антигенспецифическому механизму только во втором случае. Иными словами, адаптивный иммунитет использует

Рис. 1.8. Взаимосвязь врожденного и адаптивного иммунитета. Врожденный иммунитет обеспечивает презентацию антигена и костимуляцию, необходимые для запуска адаптивного иммунитета. В свою очередь, адаптивный иммунитет благодаря выработке антител и цитокинов придает реакциям врожденного иммунитета избирательность действия и повышает их эффективность
эффекторные механизмы врожденного иммунитета, придавая им специфичность и усиливая их путем контактных межклеточных взаимодействий и стимулирующего действия цитокинов (рис. 1.8).
Источник: Ярилин.А.А , «Иммунология » 2010
А так же в разделе «Эффекторные механизмы иммунного ответа. Взаимосвязь факторов врожденного и адаптивного иммунитета »
- Зарождение иммунологии
- Развитие иммунологии до середины ХХ века
- «Новая иммунология» 50-80-х годов ХХ века
- Современный этап развития иммунологии — молекулярная иммунология
- ЕСТЕСТВЕННАЯ ИСТОРИЯ ИММУНИТЕТА
- КРАТКОЕ ИЗЛОЖЕНИЕ ИММУНОЛОГИИ
- Молекулы-мишени иммунитета (образы патогенности, антигены) и распознающие их рецепторы
- Иммунная система
- Первая линия иммунной защиты
- Адаптивный иммунный ответ
- Иммунологическая память
- РЕЗЮМЕ