Селекция тимоцитов и формирование субпопуляций CD4+ и CD8+ клеток
Многие особенности селекции Т-клеток (по сравнению с селекцией В-лимфоцитов) характеризуются большей сложностью процесса распознавания антигена Т-клетками и их особой ролью в обеспечении толерантности к собственным антигенам организма. Схематично положительная и отрицательная селекция тимоцитов отражены на рис. 3.49.
Положительная селекция
Дважды положительные клетки очень чувствительны к апоптозу (в связи с низкой экспрессией ими антиапоптотических факторов, таких, как Bcl-2 и Bcl-XL). Для выживания дифференцирующимся Т-клеткам нужна поддержка микроокружения, особенно эпителиальных клеток коры тимуса, в которой локализуются CD4+CD8+ тимоциты. Сигнал, необходимый для выживания, тимоциты получают в ходе положительной селекции. Набор рецепторов, формируемый в ходе случайной перестройки генов, никак не связан с реальными потребностями иммунной системы. В то же время для нормального функционирования иммунной системы нужно, чтобы Т-клетки несли TCR, распознающие молекулы MHC, содержащие пептидные фрагменты антигенов. Положительная селекция обеспечивает отбор только тех тимоцитов, которые экспрессируют TCR, обладающие сродством к молекулам MHC.
Положительной селекции подвергаются дважды положительные тимо- циты фенотипа CD4+ CD8+ CD3l0 CD27-. В качестве «отбирающего фактора» выступают кортикальные эпителиальные клетки, экспрессирующие цито-
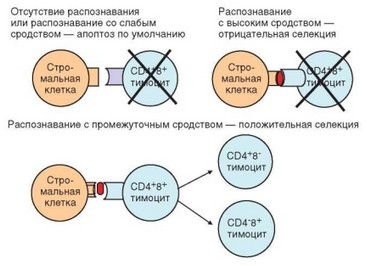
Рис. 3.49. Селекция клонов тимоцитов. Связь с особенностями распознавания комплекса «аутологичный пептид—MHC»
кератин СК8 и молекулы MHC обоих классов, но лишенные костимули- рующих молекул. Тимоциты, перемещаясь от периферии коры к кортикомедуллярной зоне, тесно контактируют с эпителиальным ретикулумом, образующим трехмерный каркас тимуса. При этих механических контактах TCR тимоцитов взаимодействуют с экспрессированными на поверхности эпителиальных клеток молекулами MHC как I, так и II классов, содержащими фрагменты различных эндогенных молекул (чужеродные молекулы в тимусе отсутствуют). Если TCR обладает сродством к молекуле MHC, тимо- цит получает поддерживающий сигнал, основными результатами которого служат повышение экспрессии антиапоптотического фактора Вс1-2 и продвижение тимоцита по клеточному циклу. Внешний признак успешного прохождения тимоцитом положительной селекции — экспрессия маркера активации клетки CD69, а также молекул CD5, CD27 и костимулирующей молекулы CD28, сопровождающаяся повышением плотности экспрессии рецепторного комплекса TCR—CD3 на поверхности клетки. Т-лимфоциты, рецепторы которых лишены сродства к МНС, подвергаются апоптозу «по умолчанию», т.е. не в силу сигнала извне, передаваемого через мембранные рецепторы, а вследствие срабатывания внутренних (митохондриальных) механизмов. Поскольку сродством к молекулам MHC обладают TCR лишь незначительной части клонов образующихся тимоцитов, на этапе положительной селекции погибает 90% CD4+ CD8+ тимоцитов.
Отрицательная селекция
Тимоциты, прошедшие положительную селекцию, мигрируют в кортикомедуллярное сочленение и в мозговой слой тимуса, где они проходят следующий этап отбора — отрицательную селекцию. На этом этапе тимоциты представлены дважды положительными клетками или «полузрелыми» моноположительными клетками фенотипа CD4+/CD8+ CD24hl. Отрицательную селекцию осуществляют медуллярные дендритные и эпителиальные клетки. Те и другие клетки экспрессируют молекулы MHC обоих классов и костимулирующие молекулы (CD80, CD86, CD40). Маркеры медуллярных эпителиальных клеток — цитокератин 5 и лектин улитки UEA1.
На этом этапе происходит дискриминация тимоцитов по степени сродства к комплексу MHC—пептид. Клетки, обладающие высоким сродством, подвергаются апоптозу как потенциально опасные (поскольку они хорошо распознают пептидные фрагменты аутологичных белков в составе аутологичных молекул MHC, они могут индуцировать аутоиммунные реакции). Сигналом к реализации апоптоза служит экспрессия ядерного фактора Nur77, который, таким образом, служит маркером клеток, подлежащих элиминации. В результате жизнеспособность сохраняют только тимоциты, рецепторы которых обладают умеренным (промежуточным) сродством к аутологичным комплексам MHC—пептид. Именно такие клетки мигрируют в периферический отдел иммунной системы и участвуют в развитии иммунного ответа и реализации антигенспецифической иммунной защиты.
Постоянно возникает вопрос, почему сигнал, поступающий в тимо- циты через TCR, в одном случае (положительная селекция) обеспечивает поддержание жизнеспособности клеток, а в другом (отрицательная селекция) вызывает их гибель. Основой этих различий являются особенности клеток, вступающих в соответствующую фазу селекции. В силу различной молекулярной конститутции внутриклеточная сигнализация при аналогичных внешних сигналах и использовании практически одних и тех же сигнальных путей приводит к доминированию различных факторов и включению различных результирующих механизмов, приводящих в одном случае к поддержанию жизнеспособности, в другом — к развитию апоптоза. Полностью детали внутриклеточной сигнализации при положительной и отрицательной селекции тимоцитов не выяснены. Однако известно, например, что при положительной селекции в передачу сигнала в большей степени вовлекаются ферменты MAP-каскада, приводящие к образованию транскрипционного фактора c-Fos, а также Са2+-зависимый сигнальный путь, обеспечивающий формировнаие фактора NF-AT. В то же время при отрицательной селекции доминируют JNK- и p38-ветви MAP-каскада, приводящие к образованию транскрипционного фаткора с-Jun. Маркером отрицательной селекции является киназа MINK.
Из сказанного выше следует, что Т-клетки как бы «натаскиваются» на распознавание собственных антигенов, а не чужеродных молекул, но степень агрессивности Т-клеток в отношении собственных молекул ограничивается отрицательной селекцией. Этим клеткам предстоит распознавать комплексы аутологичных молекул МНС с пептидными фрагментами чужеродных белков, что осуществляется в силу высокой перекрестной реактивности TCR. Тем не менее, риск аутоагрессивности сохраняется и для его ограничения требуются дополнительные механизмы, такие как контроль со стороны регуляторных Т-клеток (см. 3.6.6.4).
При отрицательной селекции удаляются клоны, распознающие с высоким сродством антигены, представленные в тимусе. В связи с этим возникает вопрос, насколько набор антигенов, экспрессируемых в тимусе, является представительным для всего организма. Общеизвестно, что существуют органоспецифические антигены — белки, характерные для того или иного органа и выполняющие специфические функции. Из этого следует, что в популяции тимоцитов, прошедших отрицательную селекцию, должны сохраняться клоны, способные распознавать органоспецифические антигены других органов (не тимуса).
Однако такие клетки элиминируются при отрицательной селекции (если не полностью, то в значительной степени) благодаря эктопической экспрессии в тимусе небольших количеств органоспецифических антигенов. Этот процесс контролирует продукты гена AIRE (от Autoimmunity regulator). Белок, кодируемый геном AIRE, содержит домены, предназначенные для взаимодействия с ДНК (т.е. он является транскрипционным фактором), домены, ответственные за взаимодействие с ядерными рецепторами, а также 2 домена со структурой «цинковых пальцев» (zink finger). Механизмы действия белка AIRE неизвестны. Результат его активности — экспрессия генов органоспецифических антигенов различных органов (прежде всего эндокринных) в клетках мозговой зоны тимуса — эпителиальных, в меньшей степени — дендритных и В-лимфоцитах (редких, но тем не менее выявляемых в тимусе). Всего в тимусе экспрессируется 2000—3000 генов внетимусных белков, для экспрессии 500 из них доказана роль AIRE. Эта экспрессия мозаична: обычно в каждой клетке может экспрессироваться один из белков, причем каждый белок экспрессируется всего примерно в 100 клетках. В связи этим возникает вопрос, как столь незначительное количество антигена может обеспечить элиминацию аутореактивных клонов. Считают, что в этом принимают участие дендритные клетки, утилизировавшие продукты распада эпителиальных клеток или получившие антиген путем «откусывания» фрагментов эпителиальных клеток. О результативности такого механизма отрицательной селекции свидетельствует резкое возрастание аутоиммунных патологий при мутациях гена AIRE, ведущих к развитию синдрома APECED (Autoimmune polyendocrinopathy, candidiasis, endodermal dystrophy — аутоиммунная полиэндокринопатия, кандидоз, энто- дермальная дистрофия).
На этапе отрицательной селекции гибнет почти 50% тимоцитов, прошедших положительную селекцию (около 5% от числа незрелых дважды положительных тимоцитов). Однако в действительности достаточно много аутоспецифических Т-клеток не элиминируется в процессе отрицательной селекции и пополняет пул зрелых Т-лимфоцитов, создавая угрозу аутоагрессии. Для предотвращения этой угрозы необходимы дополнительные механизмы защиты в виде редактирования генов a-цепей TCR, индукции анергии и контроля иммунного ответа регуляторными Т-лимфоцитами (вопросы формирования и нарушения аутотолерантности будут специально рассмотрены в разделах 4.3.2.1 и 4.4.1.1).
Дифференцировка CD4+ и CD8 тимоцитов
Одновременно с селекцией тимоцитов происходит разделение их на субпопуляции, основанное на избирательной экспрессии корецепторов CD4 или CD8. Поскольку зрелые моноположительные тимоциты локализуются в мозговом слое тимуса, можно предположить, что разделение на субпопуляции происходит на этапе отрицательной селекции, однако не исключено, что этот процесс может быть связан с положительной селекцией. Дифференцировка Т-клеток регулируется как внутренними (диф- ференцировочные факторы), так и внешними (сигналы, генерируемые при контактах между клетками) стимулами. Несмотря на то, что факторы группы Notch действуют на этом этапе развития тимоцитов, они не оказывают решающего влияния на выбор пути дифференцировки. Считают, что для дифференцировки Т-лимфоцитов в CD8+ клетки нужен сигнал большей интенсивности, чем для дифференцировки CD4+ Т-клетки. Более специфично действие других факторов: сочетанная экспрессия в клетках факторов Th-POK и GATA-3 направляет Т-клетку по CD4+-пути, тогда как экспрессия факторов Tox и Runx3 — по CD8+ пути (рис. 3.50).
Сложнее объяснить механизмы, с помощью которых достигается соответствие корецептора, остающегося на Т-клетке при ее переходе на стадию моноположительных клеток, и специфичности TCR, который различает структуру не только пептида, но и молекулы MHC, в которую пептид встроен (рис. 3.51). Установлено, что на CD4CD8+ клетках в определенный момент ослабляется экспрессия корецептора CD8 (фенотип СD4+CD8lo). Если TCR специфичен к MHC-II, как и доминирующий корецетор (CD4), то в клетке генерируется сильный сигнал, и она переходит на стадию CD4CD8-. Если TCR обладает более высоким сродством к комплексу
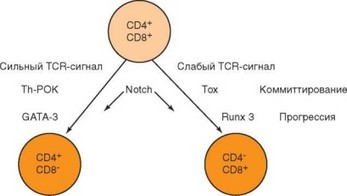
Рис. 3.50. Факторы, контролирующие дифференцировку арТ-клеток
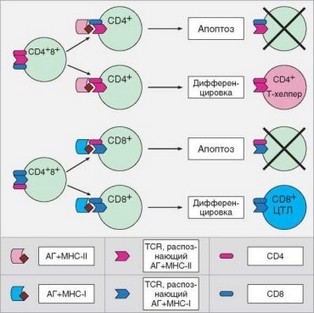
Рис. 3.51. Проверка специфичности корецептора при дифференцировке CD4+ и CD8+ Т-лимфоцитов (селекционная модель). Клетка выживает, если специфичность корецептора к молекулам главного комплекса гистосовместимости совпадает со специфичностью T-клеточного рецептора (на схеме в таких вариантах рецептор и корецептор окрашены одним цветом). Несовпадение специфичностей рецептора и корецептора приводит к апоптозу клетки
пептид-MHC-I, т.е. специфичность TCR и CD4 не совпадает, формируется слабый сигнал. Это приводит к усилению экспрессии CD8 и утрате CD4, т.е. к развитию CD4-CD8+ Т-клеток.
После такой селекции путем подтверждения адекватности корецеп- тора клетка приобретает функциональные свойства, соответствующие ее назначению. Так, CD8+ T-клетки (Т-киллеры) приобретают способность формировать цитолитический молекулярный комплекс, что обеспечивает функционирование такой Т-клетки в качестве цитотоксического Т-лимфо- цита. В CD4+ T-лимфоцитах (Т-хелперах) формируются внутриклеточные механизмы, необходимые для выполнения «хелперной» функции, прежде всего — способность активно вырабатывать цитокины при активации. В результате Т-клетки дифференцируются в функционально полноценные субпопуляции цитотоксических и хелперных Т-лимфоцитов.
В результате описанных выше процессов в тимусе образуется популяция функционально полноценных арТ-лимфоцитов, способных участвовать в иммунном ответе и обеспечивать антигенспецифическую иммунную защиту организма. Популяция зрелых Т-клеток гетерогенна по двум параметрам — специфичности TCR и функциональной активности. Разнообразие специфичностей TCR служит основой клональной структуры популяции Т-клеток. Тимоциты, сформировавшие уникальный по составу и специфичности рецептор, пройдя селекцию, образуют клон — группу потомков родоначальной клетки с рецепторами той же специфичности. В результате селекции клонов сохраняются и поддерживаются только клетки, распознающие комплексы аутологичных молекул MHC и эндогенных пептидов с умеренным сродством, недостаточным для развития ответа на аутоантигены, но достаточным для распознавания чужеродных пептидов в составе молекулы MHC на основе перекрестной реактивности.
Созревшие тимоциты довольно долго (7—14 сут) не покидают тимус, пребывая преимущественно в наружных слоях мозгового слоя, богатых дендритными клетками. В этот период завершается формирование аутотолерантности и Т-клетки приобретают свойства, важные для поддержания их жизнеспособности вне тимуса. Так, вследствие активации сиалилтранс- фераз происходит сиалирование мембранных гликопротеинов, защищающее лимфоциты от поглощения макрофагами. Созревшие Т-лимфоциты начинают экспрессировать набор мембранных молекул адгезии и рецепторов для хемокинов, необходимые для направленной миграции клеток в специализированные участки иммунной системы и для последующей рециркуляции. Например, под влиянием фактора KLF2 (Kruppel-like factor 2) на тимоцитах экспрессируются селектин L (CD62L), р7-интегрины, хемокиновый рецептор CCR7 и рецептор SIP-1 для сфингозин-1-фосфата. Последнему фактору приписывают основную роль в эмиграции зрелых Т-клеток из тимуса: созревшие клетки мигрируют в кровяное русло, т.к. их привлекает присутствующий в нем сфингозин-1 фосфат, который выступает в роли хемотаксического фактора.
Развитие Т-клеток в тимусе длится около 20 сут. За это время, с одной стороны, происходит массовая (до 99%) гибель тимоцитов в процессе их созревания (главным образом, на разных этапах селекции), а с другой — пролиферация выживших клеток с образованием клонов. В зрелом возрасте из тимуса ежедневно эмигрируют Т-клетки в количестве, равном 1% от общей численности тимоцитов.
Помимо рассмотренных выше субпопуляций CD4+ и CD8+ Т-лимфоци- тов в тимусе дифференцируются «неклассические» субпопуляции Т-клеток. Определенные успехи в изучении этих субпопуляций были достигнуты только в последние годы. Свойства этих клеток представлены в табл. 3.14.
Таблица 3.14. Естественные субпопуляции перферических Т-лимфоцитов
Положительная селекция
Дважды положительные клетки очень чувствительны к апоптозу (в связи с низкой экспрессией ими антиапоптотических факторов, таких, как Bcl-2 и Bcl-XL). Для выживания дифференцирующимся Т-клеткам нужна поддержка микроокружения, особенно эпителиальных клеток коры тимуса, в которой локализуются CD4+CD8+ тимоциты. Сигнал, необходимый для выживания, тимоциты получают в ходе положительной селекции. Набор рецепторов, формируемый в ходе случайной перестройки генов, никак не связан с реальными потребностями иммунной системы. В то же время для нормального функционирования иммунной системы нужно, чтобы Т-клетки несли TCR, распознающие молекулы MHC, содержащие пептидные фрагменты антигенов. Положительная селекция обеспечивает отбор только тех тимоцитов, которые экспрессируют TCR, обладающие сродством к молекулам MHC.
Положительной селекции подвергаются дважды положительные тимо- циты фенотипа CD4+ CD8+ CD3l0 CD27-. В качестве «отбирающего фактора» выступают кортикальные эпителиальные клетки, экспрессирующие цито-

Рис. 3.49. Селекция клонов тимоцитов. Связь с особенностями распознавания комплекса «аутологичный пептид—MHC»
кератин СК8 и молекулы MHC обоих классов, но лишенные костимули- рующих молекул. Тимоциты, перемещаясь от периферии коры к кортикомедуллярной зоне, тесно контактируют с эпителиальным ретикулумом, образующим трехмерный каркас тимуса. При этих механических контактах TCR тимоцитов взаимодействуют с экспрессированными на поверхности эпителиальных клеток молекулами MHC как I, так и II классов, содержащими фрагменты различных эндогенных молекул (чужеродные молекулы в тимусе отсутствуют). Если TCR обладает сродством к молекуле MHC, тимо- цит получает поддерживающий сигнал, основными результатами которого служат повышение экспрессии антиапоптотического фактора Вс1-2 и продвижение тимоцита по клеточному циклу. Внешний признак успешного прохождения тимоцитом положительной селекции — экспрессия маркера активации клетки CD69, а также молекул CD5, CD27 и костимулирующей молекулы CD28, сопровождающаяся повышением плотности экспрессии рецепторного комплекса TCR—CD3 на поверхности клетки. Т-лимфоциты, рецепторы которых лишены сродства к МНС, подвергаются апоптозу «по умолчанию», т.е. не в силу сигнала извне, передаваемого через мембранные рецепторы, а вследствие срабатывания внутренних (митохондриальных) механизмов. Поскольку сродством к молекулам MHC обладают TCR лишь незначительной части клонов образующихся тимоцитов, на этапе положительной селекции погибает 90% CD4+ CD8+ тимоцитов.
Отрицательная селекция
Тимоциты, прошедшие положительную селекцию, мигрируют в кортикомедуллярное сочленение и в мозговой слой тимуса, где они проходят следующий этап отбора — отрицательную селекцию. На этом этапе тимоциты представлены дважды положительными клетками или «полузрелыми» моноположительными клетками фенотипа CD4+/CD8+ CD24hl. Отрицательную селекцию осуществляют медуллярные дендритные и эпителиальные клетки. Те и другие клетки экспрессируют молекулы MHC обоих классов и костимулирующие молекулы (CD80, CD86, CD40). Маркеры медуллярных эпителиальных клеток — цитокератин 5 и лектин улитки UEA1.
На этом этапе происходит дискриминация тимоцитов по степени сродства к комплексу MHC—пептид. Клетки, обладающие высоким сродством, подвергаются апоптозу как потенциально опасные (поскольку они хорошо распознают пептидные фрагменты аутологичных белков в составе аутологичных молекул MHC, они могут индуцировать аутоиммунные реакции). Сигналом к реализации апоптоза служит экспрессия ядерного фактора Nur77, который, таким образом, служит маркером клеток, подлежащих элиминации. В результате жизнеспособность сохраняют только тимоциты, рецепторы которых обладают умеренным (промежуточным) сродством к аутологичным комплексам MHC—пептид. Именно такие клетки мигрируют в периферический отдел иммунной системы и участвуют в развитии иммунного ответа и реализации антигенспецифической иммунной защиты.
Постоянно возникает вопрос, почему сигнал, поступающий в тимо- циты через TCR, в одном случае (положительная селекция) обеспечивает поддержание жизнеспособности клеток, а в другом (отрицательная селекция) вызывает их гибель. Основой этих различий являются особенности клеток, вступающих в соответствующую фазу селекции. В силу различной молекулярной конститутции внутриклеточная сигнализация при аналогичных внешних сигналах и использовании практически одних и тех же сигнальных путей приводит к доминированию различных факторов и включению различных результирующих механизмов, приводящих в одном случае к поддержанию жизнеспособности, в другом — к развитию апоптоза. Полностью детали внутриклеточной сигнализации при положительной и отрицательной селекции тимоцитов не выяснены. Однако известно, например, что при положительной селекции в передачу сигнала в большей степени вовлекаются ферменты MAP-каскада, приводящие к образованию транскрипционного фактора c-Fos, а также Са2+-зависимый сигнальный путь, обеспечивающий формировнаие фактора NF-AT. В то же время при отрицательной селекции доминируют JNK- и p38-ветви MAP-каскада, приводящие к образованию транскрипционного фаткора с-Jun. Маркером отрицательной селекции является киназа MINK.
Из сказанного выше следует, что Т-клетки как бы «натаскиваются» на распознавание собственных антигенов, а не чужеродных молекул, но степень агрессивности Т-клеток в отношении собственных молекул ограничивается отрицательной селекцией. Этим клеткам предстоит распознавать комплексы аутологичных молекул МНС с пептидными фрагментами чужеродных белков, что осуществляется в силу высокой перекрестной реактивности TCR. Тем не менее, риск аутоагрессивности сохраняется и для его ограничения требуются дополнительные механизмы, такие как контроль со стороны регуляторных Т-клеток (см. 3.6.6.4).
При отрицательной селекции удаляются клоны, распознающие с высоким сродством антигены, представленные в тимусе. В связи с этим возникает вопрос, насколько набор антигенов, экспрессируемых в тимусе, является представительным для всего организма. Общеизвестно, что существуют органоспецифические антигены — белки, характерные для того или иного органа и выполняющие специфические функции. Из этого следует, что в популяции тимоцитов, прошедших отрицательную селекцию, должны сохраняться клоны, способные распознавать органоспецифические антигены других органов (не тимуса).
Однако такие клетки элиминируются при отрицательной селекции (если не полностью, то в значительной степени) благодаря эктопической экспрессии в тимусе небольших количеств органоспецифических антигенов. Этот процесс контролирует продукты гена AIRE (от Autoimmunity regulator). Белок, кодируемый геном AIRE, содержит домены, предназначенные для взаимодействия с ДНК (т.е. он является транскрипционным фактором), домены, ответственные за взаимодействие с ядерными рецепторами, а также 2 домена со структурой «цинковых пальцев» (zink finger). Механизмы действия белка AIRE неизвестны. Результат его активности — экспрессия генов органоспецифических антигенов различных органов (прежде всего эндокринных) в клетках мозговой зоны тимуса — эпителиальных, в меньшей степени — дендритных и В-лимфоцитах (редких, но тем не менее выявляемых в тимусе). Всего в тимусе экспрессируется 2000—3000 генов внетимусных белков, для экспрессии 500 из них доказана роль AIRE. Эта экспрессия мозаична: обычно в каждой клетке может экспрессироваться один из белков, причем каждый белок экспрессируется всего примерно в 100 клетках. В связи этим возникает вопрос, как столь незначительное количество антигена может обеспечить элиминацию аутореактивных клонов. Считают, что в этом принимают участие дендритные клетки, утилизировавшие продукты распада эпителиальных клеток или получившие антиген путем «откусывания» фрагментов эпителиальных клеток. О результативности такого механизма отрицательной селекции свидетельствует резкое возрастание аутоиммунных патологий при мутациях гена AIRE, ведущих к развитию синдрома APECED (Autoimmune polyendocrinopathy, candidiasis, endodermal dystrophy — аутоиммунная полиэндокринопатия, кандидоз, энто- дермальная дистрофия).
На этапе отрицательной селекции гибнет почти 50% тимоцитов, прошедших положительную селекцию (около 5% от числа незрелых дважды положительных тимоцитов). Однако в действительности достаточно много аутоспецифических Т-клеток не элиминируется в процессе отрицательной селекции и пополняет пул зрелых Т-лимфоцитов, создавая угрозу аутоагрессии. Для предотвращения этой угрозы необходимы дополнительные механизмы защиты в виде редактирования генов a-цепей TCR, индукции анергии и контроля иммунного ответа регуляторными Т-лимфоцитами (вопросы формирования и нарушения аутотолерантности будут специально рассмотрены в разделах 4.3.2.1 и 4.4.1.1).
Дифференцировка CD4+ и CD8 тимоцитов
Одновременно с селекцией тимоцитов происходит разделение их на субпопуляции, основанное на избирательной экспрессии корецепторов CD4 или CD8. Поскольку зрелые моноположительные тимоциты локализуются в мозговом слое тимуса, можно предположить, что разделение на субпопуляции происходит на этапе отрицательной селекции, однако не исключено, что этот процесс может быть связан с положительной селекцией. Дифференцировка Т-клеток регулируется как внутренними (диф- ференцировочные факторы), так и внешними (сигналы, генерируемые при контактах между клетками) стимулами. Несмотря на то, что факторы группы Notch действуют на этом этапе развития тимоцитов, они не оказывают решающего влияния на выбор пути дифференцировки. Считают, что для дифференцировки Т-лимфоцитов в CD8+ клетки нужен сигнал большей интенсивности, чем для дифференцировки CD4+ Т-клетки. Более специфично действие других факторов: сочетанная экспрессия в клетках факторов Th-POK и GATA-3 направляет Т-клетку по CD4+-пути, тогда как экспрессия факторов Tox и Runx3 — по CD8+ пути (рис. 3.50).
Сложнее объяснить механизмы, с помощью которых достигается соответствие корецептора, остающегося на Т-клетке при ее переходе на стадию моноположительных клеток, и специфичности TCR, который различает структуру не только пептида, но и молекулы MHC, в которую пептид встроен (рис. 3.51). Установлено, что на CD4CD8+ клетках в определенный момент ослабляется экспрессия корецептора CD8 (фенотип СD4+CD8lo). Если TCR специфичен к MHC-II, как и доминирующий корецетор (CD4), то в клетке генерируется сильный сигнал, и она переходит на стадию CD4CD8-. Если TCR обладает более высоким сродством к комплексу

Рис. 3.50. Факторы, контролирующие дифференцировку арТ-клеток

Рис. 3.51. Проверка специфичности корецептора при дифференцировке CD4+ и CD8+ Т-лимфоцитов (селекционная модель). Клетка выживает, если специфичность корецептора к молекулам главного комплекса гистосовместимости совпадает со специфичностью T-клеточного рецептора (на схеме в таких вариантах рецептор и корецептор окрашены одним цветом). Несовпадение специфичностей рецептора и корецептора приводит к апоптозу клетки
пептид-MHC-I, т.е. специфичность TCR и CD4 не совпадает, формируется слабый сигнал. Это приводит к усилению экспрессии CD8 и утрате CD4, т.е. к развитию CD4-CD8+ Т-клеток.
После такой селекции путем подтверждения адекватности корецеп- тора клетка приобретает функциональные свойства, соответствующие ее назначению. Так, CD8+ T-клетки (Т-киллеры) приобретают способность формировать цитолитический молекулярный комплекс, что обеспечивает функционирование такой Т-клетки в качестве цитотоксического Т-лимфо- цита. В CD4+ T-лимфоцитах (Т-хелперах) формируются внутриклеточные механизмы, необходимые для выполнения «хелперной» функции, прежде всего — способность активно вырабатывать цитокины при активации. В результате Т-клетки дифференцируются в функционально полноценные субпопуляции цитотоксических и хелперных Т-лимфоцитов.
В результате описанных выше процессов в тимусе образуется популяция функционально полноценных арТ-лимфоцитов, способных участвовать в иммунном ответе и обеспечивать антигенспецифическую иммунную защиту организма. Популяция зрелых Т-клеток гетерогенна по двум параметрам — специфичности TCR и функциональной активности. Разнообразие специфичностей TCR служит основой клональной структуры популяции Т-клеток. Тимоциты, сформировавшие уникальный по составу и специфичности рецептор, пройдя селекцию, образуют клон — группу потомков родоначальной клетки с рецепторами той же специфичности. В результате селекции клонов сохраняются и поддерживаются только клетки, распознающие комплексы аутологичных молекул MHC и эндогенных пептидов с умеренным сродством, недостаточным для развития ответа на аутоантигены, но достаточным для распознавания чужеродных пептидов в составе молекулы MHC на основе перекрестной реактивности.
Созревшие тимоциты довольно долго (7—14 сут) не покидают тимус, пребывая преимущественно в наружных слоях мозгового слоя, богатых дендритными клетками. В этот период завершается формирование аутотолерантности и Т-клетки приобретают свойства, важные для поддержания их жизнеспособности вне тимуса. Так, вследствие активации сиалилтранс- фераз происходит сиалирование мембранных гликопротеинов, защищающее лимфоциты от поглощения макрофагами. Созревшие Т-лимфоциты начинают экспрессировать набор мембранных молекул адгезии и рецепторов для хемокинов, необходимые для направленной миграции клеток в специализированные участки иммунной системы и для последующей рециркуляции. Например, под влиянием фактора KLF2 (Kruppel-like factor 2) на тимоцитах экспрессируются селектин L (CD62L), р7-интегрины, хемокиновый рецептор CCR7 и рецептор SIP-1 для сфингозин-1-фосфата. Последнему фактору приписывают основную роль в эмиграции зрелых Т-клеток из тимуса: созревшие клетки мигрируют в кровяное русло, т.к. их привлекает присутствующий в нем сфингозин-1 фосфат, который выступает в роли хемотаксического фактора.
Развитие Т-клеток в тимусе длится около 20 сут. За это время, с одной стороны, происходит массовая (до 99%) гибель тимоцитов в процессе их созревания (главным образом, на разных этапах селекции), а с другой — пролиферация выживших клеток с образованием клонов. В зрелом возрасте из тимуса ежедневно эмигрируют Т-клетки в количестве, равном 1% от общей численности тимоцитов.
Помимо рассмотренных выше субпопуляций CD4+ и CD8+ Т-лимфоци- тов в тимусе дифференцируются «неклассические» субпопуляции Т-клеток. Определенные успехи в изучении этих субпопуляций были достигнуты только в последние годы. Свойства этих клеток представлены в табл. 3.14.
Таблица 3.14. Естественные субпопуляции перферических Т-лимфоцитов
|
Название |
TCR |
Корецепторы |
Распознава емые лиганды |
Локализация, содержание |
Функции |
|
Т-хелперы |
р4 и Н со. б |
CD4+ CD8- |
Пептид- MHC-II |
Кровь (35-40%), лимфатические узлы (30-40%), селезенка (20-25%), тимус (8-10%), кожа, слизистые |
Предшест венники Т-хелперов |
|
Т-килле- ры |
CD4- CD8ap+ |
Пептид- MHC-I |
Кровь (20-25%), лимфатические узлы (15-20%), селезенка (10-15%), тимус (4-5%), слизистые, кожа |
Предшест венники цитотокси ческих Т-лимфоци- тов |
|
|
Дважды положи тельные (DP) |
CD4+ CD8+ |
Нет данных |
Кровь (около 1%) |
Нет данных |
|
|
Дважды отрица тельные (DN) |
CD4- CD8- |
Нет данных |
Печень, брюшная полость, костный мозг |
Нет данных |
|
|
NKT- клетки |
CD4+/- CD8- |
Липид- CD1d |
Печень (gt;10%), селезенка, слизистые |
Первая линия защиты — источник IFNy |
|
|
Регуляторные T-к летки |
CD4+ CD8- CD25hi |
Пептид- MHC-II |
Кровь (5-6%), лимфатические узлы, селезенка, тимус (3-6%), слизистые, нелимфоидные органы |
Предот вращение аутоагрессии, иммунорегу ляция |
|
|
убТ-клет- ки |
a н 'f. |
CD4- CD8- |
Фосфопро- теины и др. |
Лимфатические узлы, селезенка, кровь (2-3%), тимус (1%), слизистые, кожа (до 20%) |
Первая линия защиты, иммунорегуляция |
|
CD8aa- клетки |
CD4- CD8aa+ |
Вероятно, пептид- Qа-1/TL |
Слизистые, особенно кишечника |
Первая линия защиты, иммунорегуляция |
Источник: Ярилин.А.А , «Иммунология » 2010