Исследование суспензионной стабильности крови
Реологические параметры крови самым тесным образом связаны с ее суспензионными свойствами. Эти свойства крови характеризуются ее стабильностью, т е. способностью форменных элементов находиться во взвешенном состоянии в плазме и не взаимодействовать между собой. Таким образом, понятие суспензионной стабильности крови шире, чем понятие агрегации, так как агрегационная устойчивость — лишь один из факторов, определяющих суспензионную стабильность. На практике обычно имеют дело с седиментационной устойчивостью крови, под которой понимают способность форменных элементов оседать в стандартных условиях. Процесс оседания исследуют при помощи седиментометрии, включающей несколько методик.
Процесс седиментации форменных элементов крови весьма сложен. Его изучению посвящены детальные исследования [Чижевский А.А., 1980; Левтов В.А. и др., 1982].
В клинической практике целесообразно использовать простейшую седиментометричес- кую методику — построение зависимости СОЭ ~ f(t), называемую СОЭ-граммой. Это своего рода интегральный показатель суспензионной стабильности крови. Если кровь содержит эритроцитарные агрегаты, скорость оседания увеличивается. Увеличение скорости оседания приводит к ускоренному перемещению плазмы против сил гравитации. Ускорение этого своеобразного тока плазмы является вторичным по отношению к начальному увеличению скорости оседания за счет агрегации.
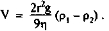
Скорость оседания форменных элементов и их агрегатов подчиняется закону Стокса:
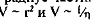 где g — ускорение силы тяжести, р, — плотность дисперсной фазы, р2 — плотность дисперсионной среды, г — пяпиус чястиц, п — вязкость дисперсионной среды.
где g — ускорение силы тяжести, р, — плотность дисперсной фазы, р2 — плотность дисперсионной среды, г — пяпиус чястиц, п — вязкость дисперсионной среды.
Очевидно, что ' . Таким образом, укрупнение частиц (или их агрегатов), т.е.
увеличение г и соответствующее уменьшение вязкости плазмы (ц) ведут к закономерному увеличению скорости оседания. Характерно, что зависимость от радиуса частиц более сильная, так как радиус в уравнении возводится в квадрат.
СОЭ-грамму можно строить двумя способами: откладывая от оси ординат абсолютное значение высоты слоя плазмы или его процент по отношению к длине капилляра. При использовании стандартного капилляра длиной 0,1 м эти величины совпадают. Следует отметить, что для оценки суспензионной стабильности нежелательно добавление таких количеств антикоагулянтов, которые могут разбавлять кровь, как это происходит при определении СОЭ в классическом варианте. Для предупреждения свертывания крови предпочтительнее добавлять к ней лишь небольшое количество гепарина.
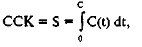
Изменения реакции седиментации во времени оказываются далеко не идентичными в норме и патологии. Вероятно, целесообразно рассматривать и сравнивать площади, описываемые кривыми седиментации, рассчитывая суспензионную стабильность крови (ССК.) по следующей формуле:
где С — максимальный размах СОЭ-граммы.
Суспензионная стабильность крови, несомненно, должна оцениваться при характеристике ее реологических свойств. Необходимость такой оценки явствует и из чувствительности данного показателя, о которой можно судить по широкому использованию СОЭ в качестве неспецифического теста при лабораторной диагностике самых различных заболеваний. Приложение показателей суспензионной стабильности крови к оценке ее текучести достаточно сложно, оно должно осуществляться в комплексном анализе с привлечением других показателей, отражающих реологические свойства, прежде всего с показателями агрегации форменных элементов.
Суспензионная стабильность крови и агрегация форменных элементов тесно связаны с величиной электрического заряда эритроцитов (потенциала). Заряд эритроцита определяется из соотношения G. Seaman (1971):
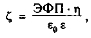
где ЭФП — электрофоретическая подвижность эритроцитов, е0 — электрическая постоянная, е — диэлектрическая проницаемость крови.
Электрофоретическую подвижность эритроцитов в свою очередь рассчитывают по формуле:
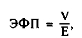
где V — скорость движения эритроцитов в электромагнитном поле; Е — напряженность электрического поля.
Электрофоретическая подвижность измеряется при помощи специальных устройств, основным узлом которых является прозрачная камера, позволяющая наблюдать движение эритроцитов в электромагнитном поле. Устройства отличаются друг от друга формой и размерами камер. Наиболее широко распространены цилиндрическая [Abramson Н., 1930] и щелевая прямоугольная камеры [Харомоненко С.С., Ракитянская А.А, 1974]. Достоинства и недостатки различных конструкций весьма подробно изложены в соответствующей литературе. Между тем результаты определения ЭФП в различных камерах мало отличаются друг от друга. Так, электрофоретическая подвижность эритроцитов, измеренная в цилиндрической камере, составляет 1,3-10"® м2/Вс, а в камере С.С. Харамоненко — 1,32-10”® м2/Вс-
Заряд эритроцита в среднем составляет (16— 18)* 10-3 В. [Харамоненко С.С., Ракитянская А.А., 1974). Между тем существует точка зрения, что в действительности он несколько больше, а именно: (25,1±0,44)-10~3 В [Мищук И.И., 1979]. Последний результат получен при помощи метода подвижной границы, разработанного автором. Предлагаемая методика в отличие от существующих не требует разведения крови. Это весьма ценно, так как, с одной стороны, метод исключает изменение дзета-потенциала за счет нарушения существующего в цельной крови гидропонного равновесия, а с другой — соответствует современной тенденции в медицинской лабораторной технике — стремлению к сокращению времени и объема пробоподготовки.
Кроме того, обычно применяемые агар-агаровые ключи часто выходят из строя вследствие ослизнения; в микрокамерах при электрофорезе, как правило, не удается избавиться от электроосмоса. Предлагаемый же метод подвижной границы лишен этих недостатков.
Заслуживает внимания метод определения ЭФП эритроцитов, предложенный Н.Д. Китаевой и соавт. (1976). Электрофорез клеток крови проводят в камере Горяева. При этом применяют плоские хлорсеребряные электроды, создающие весьма однородное электромагнитное поле с минимальным искривлением силовых линий в измерительном отделе камеры.
Если необходимо произвести более детальные исследования электрокинетического компонента суспензионной стабильности крови, целесообразно определять диэлектрическую проницаемость крови, а также ее электропроводность и тангенс угла потерь при помощи высокочастотных мостов и другой аппаратуры.
Наряду с электрокинетическими свойствами эритроцитов следует определять их некоторые простейшие геометрические параметры:
- средний объем единичного эритроцита;
- толщину отдельного эритроцита (ТОЭ);
- показатель сферичности (а) [Кассирский Н.А., Алексеев Г.А., 1970]. Норма 3,4-3,9, а lt;, 3,4 — предрасположенность к сфероцитозу, а ? 3,9 — предрасположенность к пла- ноцитозу;
- распределение эритроцитов по объему;
- построение кривой Прайс-Джонса.
Адгезивность форменных элементов — способность форменных элементов крови взаимодействовать с сосудистой стенкой (осаждаться на ней) [Swank R., 1961]. A. Copley и соавт. (1960) предложили определять адгезивность форменных элементов по осаждению их на внутреннюю поверхность стеклянного капилляра из определенного объема крови, которая «прогоняется» по этому капилляру с известной скоростью или при известном давлении. В последнем случае измеряют время прохождения крови по данному капилляру, его длину, а затем скорость.
Толщину слоя осаждения (5) форменных элементов, характеризующую их адгезивные свойства, вычисляют по формуле:
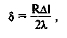
где R — радиус капилляра; Д I — уменьшение длины основного индекса (пробы крови); % — длина слоя осаждения.
При пропускании проб крови через стандартный капилляр толщина слоя осаждения в норме составляет 4,7±0,3 мкм [Селезнев С.А. и др., 1976].
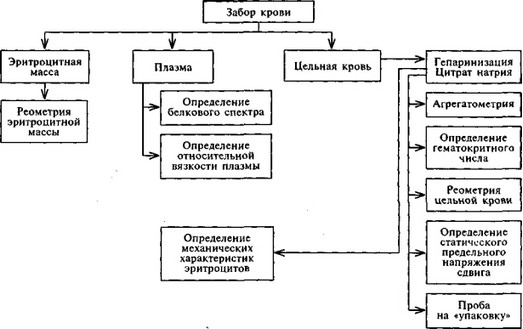
Таким образом, исследование реологических свойств крови включает комплекс методик, требующих разнообразных, порой весьма трудоемких, вычислений. На схеме 10.2 представлены объем и алгоритмы комплексного реологического анализа.
Схема 10.2. КОМПЛЕКСНЫЙ РЕОЛОГИЧЕСКИЙ АНАЛИЗ КРОВИ
Источник: Г.И. Назаренко, А.А. Кишкун, «Клиническая оценка результатов лабораторных исследований» 2000
А так же в разделе «Исследование суспензионной стабильности крови »
- Пренатальная диагностика врожденных заболеваний
- Постнатальная диагностика врожденных заболеваний
- Г л а в а 10 РЕОЛОГИЧЕСКИЕ СВОЙСТВА КРОВИ И ИХ ЗНАЧЕНИЕ В КЛИНИЧЕСКОЙ ПРАКТИКЕ
- ОПРЕДЕЛЕНИЕ ПОНЯТИЙ И ЕДИНИЦ ИЗМЕРЕНИЯ
- ОСНОВЫ ТЕОРИИ НЕНЬЮТОНОВСКИХ ЖИДКОСТЕЙ
- КРОВЬ КАК НЕНЬЮТОНОВСКАЯ ЖИДКОСТЬ И ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ ЕЕ РЕОЛОГИЧЕСКИЕ СВОЙСТВА
- КРОВООБРАЩЕНИЕ В СОСУДАХ ЗОНЫ МИКРОГЕМОЦИРКУЛЯЦИИ И ЕГО СВЯЗЬ С СИСТЕМНОЙ ГЕМОДИНАМИКОЙ
- СИСТЕМА МИКРОГЕМОЦИРКУЛЯЦИИ (СТРУКТУРА И ФУНКЦИИ)
- МЕТОДЫ ИССЛЕДОВАНИЯ РЕОЛОГИЧЕСКИХ И СУСПЕНЗИОННЫХ СВОЙСТВ КРОВИ
- Исследование процесса агрегации форменных элементов крови
- Общие закономерности расстройств микрогемоциркуляции
- Феномен внутрисосудистой агрегации форменных элементов крови
- Синдром повышенной вязкости крови
- Нарушения проницаемости и транскапиллярного обмена
- МЕТОДЫ ИЗУЧЕНИЯ ПРОНИЦАЕМОСТИ СОСУДОВ