Эта группа анемий является наиболее распространенной во всем мире. Нарушение обмена железа на уровне его поступления в организм, утилизации или реутилизации из эритроцитов является ключевым моментом большинства из них.
Железо является необходимым элементом многих белков и ферментов, участвующих в ключевых процессах метаболизма, роста, пролиферации и регенерации клеток, транспорте кислорода к тканям, тканевом дыхании и др. Исключительная роль железа определяется биологическими функциями белков, в состав которых входит этот биометалл. К наиболее известным железосодержащим белкам относятся гемоглобин и миоглобин, в составе которых железо, доставляя кислород к тканям, обеспечивает тканевое дыхание. Дефицит железа приводит к нарушению синтеза гемоглобина и развитию гипоксии. Железо входит также в состав значительного количества ферментов, участвующих в окислительно-восстановительных реакциях, в процессах энергообразования (цитохромы, НАДН-дегидрогеназа, сукци- натдегидрогеназа), биосинтезе ДНК (рибонуклеотидредуктаза) и делении клеток, детоксикации продуктов эндогенного распада, нейтрализующих активные формы кислорода (оксидазы, пероксидазы, цитохромоксидазы, каталазы) (табл. 6).
В последние годы установлена роль железосодержащих белков (ферритин) в реализации клеточного иммунитета, регуляции кроветворения. Вместе с тем Железо может быть исключительно токсичным элементом, если присутствует в организме в повышенных концентрациях, превышающих емкость железосодержащих белков. Потенциальная токсичность свободного двухвалентного железа (Fe2+) объясняется его способностью запускать цепные свободноради-
кальные реакции, приводящие к перекисному окислению липидов биологических мембран, образованию высокореактивных кислородных радикалов, способных повреждать мембраны клеток, белки, нуклеиновые кислоты и в целом вызывать гибель клетки. Двойственная сущность функций железа диктует необходимость формирования жесткой регуляции концентрации железа в организме человека.
Таблица 6
Основные железосодержащие белки и ферменты, их функции
|
Железосодержащие белки и ферменты |
Функции |
|
Гемоглобин |
Транспорт кислорода |
|
Миоглобин |
Транспорт и депонирование кислорода в мышцах |
|
Каталаза |
Расщепление перекиси водорода |
|
Цитохромы |
Тканевое дыхание |
|
Пероксидаза |
Окислительные реакции |
|
Трансферрин |
Транспорт железа |
|
Лактоферрин |
Транспорт железа, бактерицидная функция |
|
Ферритин |
Депонирование железа в тканях |
|
Гемосидерин |
Депонирование железа в тканях |
|
Ксантиноксидаза |
Образование мочевой кислоты |
|
Рибонуклеотидредуктаза |
Синтез ДНК |
Системный гомеостаз железа регулируется на уровне всасывания железа в тонком кишечнике. Процесс выведения (экскреции) железа пассивный, нерегулируемый. В норме баланс железа остается стабильным, и потери железа уравновешиваются повышением доставки его во время абсорбции. Транспорт и депонирование железа осуществляются специальными белками - трансферрином, трансферриновым рецептором 1 и ферритином.
Общее количество железа в организме здорового человека составляет 3,5-5,0 г, примерно 2/3 приходится на гемоглобин эритроцитов и эритроидных предшественников. Распределение железа в организме взрослого человека в норме представлено на рис. 27.
В норме из пищи всасывается в тонком кишечнике 1-2 мг железа. Обязательные суточные потери железа также составляют около 1-2 мг. Повышенные потери железа во время менструации (0,5 -1 мг в день) или повышенные
М
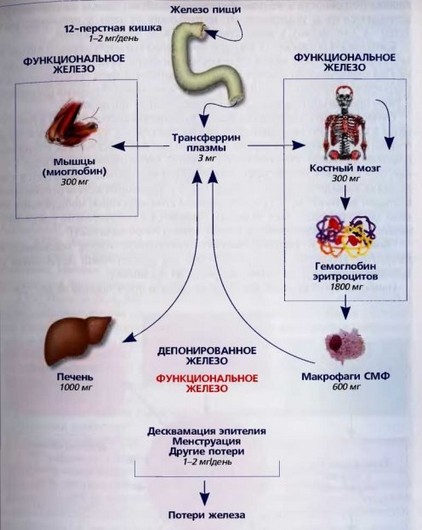
Рис. 27. Обмен железа в организме взрослого человека
потребности в железе во время беременности (около 500 мг) компенсируются увеличением всасывания алиментарного железа (максимальная способность всасывания - 3 мг в день). У детей потеря железа составляет 0,1-0,3 мг в сутки, увеличиваясь до 0,5-1,0 мг в сутки у подростков. Ежедневная потребность детскою организма в железе - 0,5-1,2 мг в день. У детей раннего возраста в связи с быстрыми темпами роста и развития наблюдается повы-
шенная потребность в железе. В этот период жизни запасы железа быстро истощаются из-за усиленного его потребления из депо: у недоношенных детей - к 3-му месяцу, у доношенных - к 5-6-му месяцам жизни.
Ежедневная потребность в железе превышает его поступление с пищей и составляет около 20 мг, которые в основном расходуются на синтез гемоглобина. Она удовлетворяется за счетреутилизированного железа, образующегося в макрофагах селезенки и других органах системы мононуклеарных фагоцитов (СМФ) при фагоцитозе старых или поврежденных эритроцитов.
Около % общего содержания железа в организме сосредоточено в гепато- цитах и макрофагах селезенки, печени и костного мозга. Мобилизация железа из депо осуществляется в период отрицательного баланса железа, например при недостаточном поступлении его с пищей, избыточной кровопотере. Совокупность гомеостатических и транспортных механизмов используется для создания динамического равновесия между утилизацией железа (в основном клетками костного мозга) и поступлением его (абсорбция, мобилизация из депо, реутилизация). Этот баланс и отражается в относительно узком диапазоне концентрации железа в плазме крови (10-30 мкмоль/л).
Обмен железа в организме состоит из нескольких этапов: всасывание в желудочно-кишечном тракте, транспорт, внутриклеточный метаболизм и депонирование, реутилизация, экскреция из организма.
Наиболее простая схема метаболизма железа представлена на рис. 28.
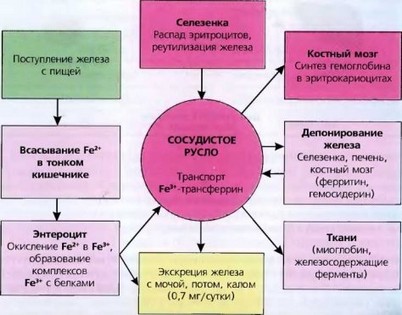
Рис. 28. Схема метаболизма железа в организме
Железо в организм человека поступает с пищей в виде неорганического и гемового железа. При обычном питании неорганическое, или окисное, железо (Fe3') составляет в пище 80-90%, на гемовое, или закисное, железо (Fe2+) ппиходится 10-20%. Механизм всасывания неорганического железа хорошо изучен в отличие от абсорбции гемового железа. Fe3+ нерастворимо в растворах с pH выше 3,0 и должно быть растворено в желудке, чтобы в последующем абсорбироваться в более щелочной среде 12-перстной кишки. Растворенное в желудке железо хелатируется соединениями, которые сохраняют его в растворе, когда оно поступает в 12-перстную кишку. Хелатирование выполняется муцином и некоторыми компонентами пищи (аминокислоты, сахара, амины и др.). Лимонная, аскорбиновая, янтарная, яблочная кислоты, фруктоза, сорбит, метионин, цистеин, микроэлементы (медь), никотинамид способствуют всасыванию железа в организме. Другие вещества пищи вызывают преципитацию железа и образуют макромолекулы, которые не всасываются в кишечнике. Адсорбцию железа ухудшают танины чая и кофе, фосфаты, карбонаты, оксалаты, ЭДТА, используемая в качестве консервантов, антацидные препараты, теграциклины. Нормальному усвоению железа препятствует хеликобактерная инфекция. Гемовое железо (Fe2+) растворимо в дуоденальном содержимом и всасывается энтероцитами, на него не влияют компоненты пищи.
Адсорбция железа, как неорганического, так и гемового, происходит в проксимальных отделах тонкого кишечника, наиболее интенсивно в 12-перст- ной кишке. При дефиците железа зона всасывания расширяется дистально, захватывая слизистую верхнего отдела подвздошной кишки, что обеспечивает усиление его абсорбции.
Всасывание железа в кишечнике является ключевым пунктом в гомеостазе железа и включает следующие этапы:
- окисление Fe3+B Fe2+;
- всасывание железа апикальной мембраной энтероцита и внутриклеточный транспорт;
- перенос железа через базолатеральную мембрану с помощью транспортера железа ферропортина (IREG-1).
В 12-перстной кишке Fe3+ превращается в Fe2+ с помощью витамин С-за- висимой ферриредуктазы (DcytB - дуоденальный цитохром В) щеточной каймы энтероцита. Предполагается возможное участие и других редуктаз в этом процессе. При сидеропении синтез ферриредуктазы повышается, что приводит к увеличению скорости всасывания алиментарного железа. Свободное жЖлезо (Fe2+) транспортируется через щеточную кайму апикальной мембраны энтероцита (обращена в просвет кишечника) с помощью Двухвалентного транспортера металла DMT-1 (divalent metal transporter-1). Данный белок синтезируется только в криптах двенадцатиперстной кишки.
МТ-1 транспортирует также и другие двухвалентные металлы (марганец, кобальт, медь, цинк, кадмий, свинец) из просвета кишечника в энтероцит. 1 фисутствие высоких концентраций ионов кальция, являющегося конкурентным ингибитором DMT-1, снижает всасывание железа. Экспрессия DMT-1
регулируется запасами железа в организме, а также алиментарным железом и повышается при ЖДА.
Молекулярные механизмы всасывания и транспорта в энтероцит гемового железа до конца не изучены. Исследования последних лет позволили открыть единственный транспортер гемового железа в энтероцитах 12-перстной кишки - НСР-1 (heme carrier protein-1). Наибольшей гемсвязывающей активностью обладает 12-перстная кишка. Поступление гемового железа не конкурирует с негемовым железом. Внутри энтероцита гемоксигеназа-1 высвобождает железо из протопорфирина, который затем распадается, а свободное железо вместе с негемовым железом выводится из энтероцита. При ЖДА в клетках обнаруживается повышенное количество гемоксигеназы.
Поступившее в энтероцит Fe2+ может быть депонировано в виде феррити- на или переносится с транспортным белком (мобилферрином или клеточным трансферрином) к базолатеральной мембране, где находится трансмембранный белок ферропортин. Это единственный транспортер железа через базолатеральную мембрану, известный в настоящее время (рис. 9). Высокая экспрессия ферропортина обнаружена в клетках, участвующих в экспорте
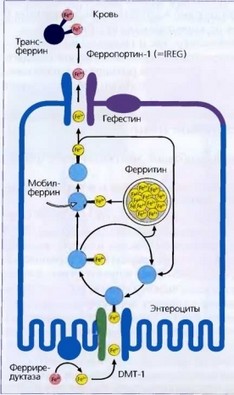 Рис. 29. В 12-перстной кишке Fe3+ превращается в Fe2+ с помощью витамин С зависимой ферриредуктазы (дуоденальный цитохром В) щеточной каймы энтероцита. Свободное железо (Fe2+) транспортируется через щеточную кайму апикальной мембраны энтероцита (обращена в просвет кишечника) с помощью двухвалент ного транспортера металла - ДМТ-1 (divalent metal transporter-1). Поступившее в энтероцит Fe2+ может быть депонировано в виде ферритина или переносится с транспортным белком (мобилферрином) к базола теральной мембране, где находится трансмембранный белок ферропор- тин-1, передающий железо трансфер- рину плазмы крови
Рис. 29. В 12-перстной кишке Fe3+ превращается в Fe2+ с помощью витамин С зависимой ферриредуктазы (дуоденальный цитохром В) щеточной каймы энтероцита. Свободное железо (Fe2+) транспортируется через щеточную кайму апикальной мембраны энтероцита (обращена в просвет кишечника) с помощью двухвалент ного транспортера металла - ДМТ-1 (divalent metal transporter-1). Поступившее в энтероцит Fe2+ может быть депонировано в виде ферритина или переносится с транспортным белком (мобилферрином) к базола теральной мембране, где находится трансмембранный белок ферропор- тин-1, передающий железо трансфер- рину плазмы крови
железа (дуоденальные энтероциты, макрофаги, гепатоциты, синцитиотро- Лобласты плаценты). Ферропортин играет решающую роль в транспорте железа от матери плоду. В экспериментальных исследованиях показано, что дефицит ферропортина у мышей вызывет гибель эмбриона. Подобно DMT-1 ферропортин связывается с Fe2+, пересекая базолатеральную мембрану где Fe2+ окисляется вновь в Fe3+. Ферропортин с участием ферроксидазы (гефестин в энтероцитах и церулоплазмин в макрофагах и гепатоцитах) осуществляет экспорт железа из клетки в плазму крови, где оно соединяется с трансферрином. Функцией церулоплазмина, обладающего ферроксидазной активностью, является мобилизация железа из депо, в основном из макрофагов. Кроме того, при стрессовых ситуациях, затрагивающих метаболизм железа (хроническая кровопотеря), церулоплазмин способен стимулировать процесс всасывания железа.
Особенности всасывания железа у новорожденных детей. У детей, находящихся на грудном вскармливании, всасывание железа из грудного молока происходит очень активно, хотя содержание железа в грудном молоке невелико - 1,5 мг в литре. Биодоступность железа составляет 60%, этому способствует особая его форма - железосодержащий белок лактоферрин. В молекуле лактоферрина определено два центра связывания ионов Fe;". Лактоферрин в грудном молоке находится в двух формах - ненасыщенной и насыщенной, соотношение которых меняется в зависимости от периода лактации. В течение 1-3 месяцев жизни превалирует насыщенная железотранспортная форма лактоферрина. Наличие специфических рецепторов к лактоферрину на эпителиальных клетках слизистой кишечника способствует адгезии с ними лактоферрина и более полной его утилизации. Кроме того, лактоферрин, связывая лишнее, невсосавшееся железо в кишечнике, лишает условно-патогенную микрофлору необходимого для ее жизнедеятельности микроэлемента и запускает неспецифические бактерицидные механизмы. Установлено, что бактерицидная функция IgA реализуется только в присутствии лактоферрина. Интересен тот факт, что грудное молоко повышает абсорбцию железа из продуктов, употребляемых одновременно с ним. Интенсивные обменные процессы у грудных детей приводят к тому, что к 5-6-му месяцу жизни антенатальные запасы железа истощаются даже У детег^с благополучным перинатальным анамнезом и вскармливаемых грудным молоком.
