Из азотсодержащих органических соединений наиболее доступны для микроорганизмов аминокислоты. Сами по себе аминокислоты не являются макроэргическими соединениями, но расщепление некоторых из них сопровождается синтезом АТФ или образованием пировиноградной кислоты, входящей в цикл трикарбоновых кислот. Определенные микроорганизмы обладают специальными механизмами для получения энергии за счет расщепления аминокислот.
Расщепление аминокислот. Аминокислоты ассимилируются бактериями как источник пластического материала или как источники энергии. Внутри клетки происходит расщепление аминокислот под действием эндоферментов - дезаминаз и декарбоксилаз. В результате этого может отщепляться или аминная NH2 (процесс дезаминирования), или карбоксильная С02 (процесс декарбоксилирования) группы. Характер превращения аминокислот зависит главным образом от реакции среды в период роста бактерий. В кислой среде происходит декарбоксилирование, в щелочной - дезаминирование. Так, расщепление аспарагиновой кислоты происходит по следующей схеме:
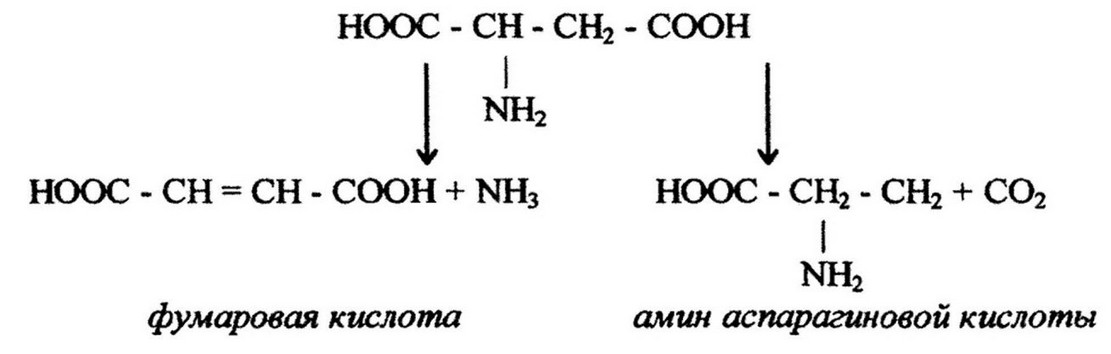
Оптимум pH для декарбоксилаз лежит в пределах 4-5,5, а для большинства дезаминаз - в пределах 8-9. При декарбоксилировании
в связи с освобождением веществ, содержащих основные группы - амины, происходит нейтрализация среды; при дезаминировании - подкисление. На основании этого было высказано предположение, что обе системы ферментов действуют как механизмы нейтрализации среды, в результате чего pH сохраняется в физиологических пределах. При декарбоксилировании образуются амины соответствующих кислот по уравнению:
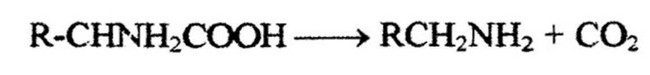
В настоящее время обнаружены декарбоксилазы почти для всех 20 аминокислот. Они характеризуются специфичностью катализируемых реакций. Специфичность определяет белковый носитель, так как простетическая группа (кофермент) одинаковая во всех декарбоксилазах. Она представляет собой пиридоксальфосфат (витамин В6).
Декарбоксилазы бактерий действуют только на L-амино- кислоты с образованием аминов. Функция аминов полностью не выяснена. Однако установлено, что некоторые из них играют роль ростовых факторов (например, р-аланин является ростовым фактором для дифтерийной палочки), другие участвуют в сложных обменных реакциях и могут служить источником энергии.
В распределении декарбоксилаз у различных видов бактерий закономерностей не наблюдается. Эти ферменты можно обнаружить в любом сочетании у различных видов. Есть предположение, что декарбоксилазы, как и дезаминазы, являются адаптивными ферментами.
Благоприятные условия для образования декарбоксилаз создаются в конце логарифмической фазы размножения. Старые культуры характеризуются весьма слабой активностью.
Дезаминирование аминокислот сопровождается выделением NH3 и осуществляется многочисленными и разнообразными реакциями. Разнообразие реакций определяется набором ферментов, присущих тому или иному микроорганизму. Различают несколько типов дезаминирования. У аэробов распространено окислительное дезаминирование, приводящее к образованию а-кетокислоты:
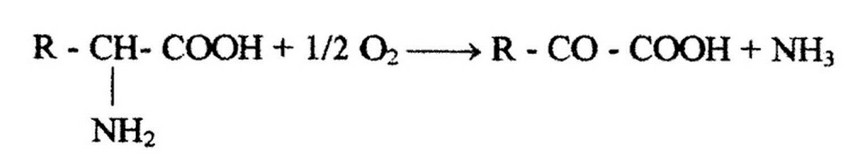
Оно осуществляется под влиянием оксидаз и дезаминаз. Некоторые из оксидаз в качестве акцептора электронов используют кислород, у других этот процесс связан с цепью транспорта электронов, в результате чего путем окислительного
фосфорилирования происходит образование АТФ.
Ряд микроорганизмов производит дезаминирование
аминокислот с образованием пировиноградной кислоты, которая включается в энергетический обмен одним из описанных выше путей. Так, для Е. coli характерно образование пировиноградной кислоты из аланина:
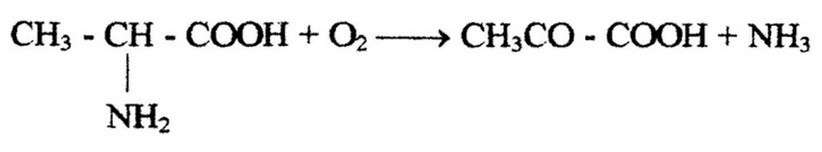
Аналогичным образом эта бактерия потребляет и другие аминокислоты. Пировиноградная кислота образуется также при дезаминировании серина, глутамата. Продукты расщепления аминокислот включаются в ЦТК через ацетил-КоА, а-кето- глутаровую кислоту и сукцинил-КоА.
Микроорганизмы для своих жизненных процессов используют энергию, выделяемую при катаболизме продуктов дезаминирования. Но значительная часть энергии микроорганизмам может постановляться из смеси аминокислот, за счет сопряженных окислительно-восстановительных реакций между двумя соответствующими аминокислоты. Впервые эти реакции были описаны Стиклендом в 1934-1935 гг. в культурах анаэробных клостридиев. При этих реакциях одни аминокислоты играют роль доноров, а другие - акцепторов водорода. Например, реакция Стикленда между аланином и глицином:
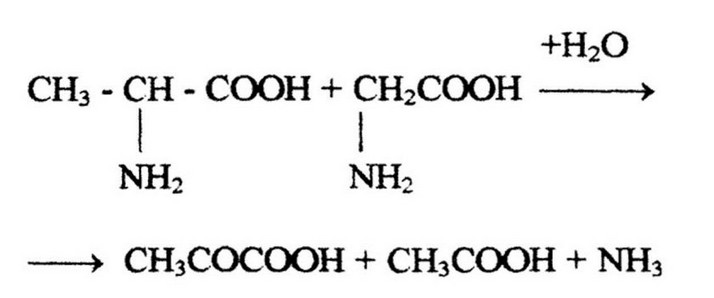
Образовавшаяся кетокислота декарбоксил ируется, а если декарбоксилирование происходит в присутствии фосфата, то образуется макроэргическое фосфорное производное:
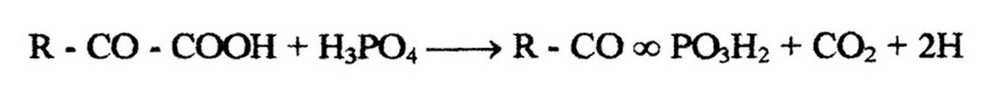
Данное производное может высвобождать накопленную энергию, образуя при этом соответствующую жирную кислоту.
Переаминирование. Сущность процесса переаминирования (трансаминирования) заключается в том, что аминогруппа а-амино- кислоты перемещается в a-положение кетокислоты, т. е. происходит взаимодействие аминокислоты с кетокислотой, в процессе которого ферменты трансаминазы переносят аминогруппу с одной кислоты (аминокислоты) на другую (кетокислоту). Так, образуется новая аминокислота и кетокислота. Реакция идет по схеме:
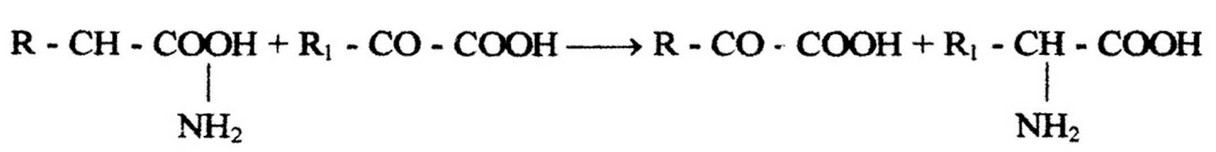
В реакцию переаминирования легко вступают аланин и кетоглутаровая кислота. В результате образуются глутаминовая и пировиноградная кислоты. Последняя через ацетил-КоА вовлекается в цикл трикарбоновых кислот и окисляется до углекислоты и воды. Впервые эту реакцию описали А. Е. Браунштейн и М. Г. Крицман (1937-1938) для тканей животных. У бактерий трансаминазы впервые описаны Б. Лихштейном и Г. Коэном в 1944 г. Реакции переаминирования ими были обнаружены у бактерий различных родов: стрептококков, стафилококков, кишечной палочки,
азотобактера, клостридиев. Они также получили бесклеточный
препарат глутаминаспарагинтрансаминазы и исследовали механизм реакции переаминирования:
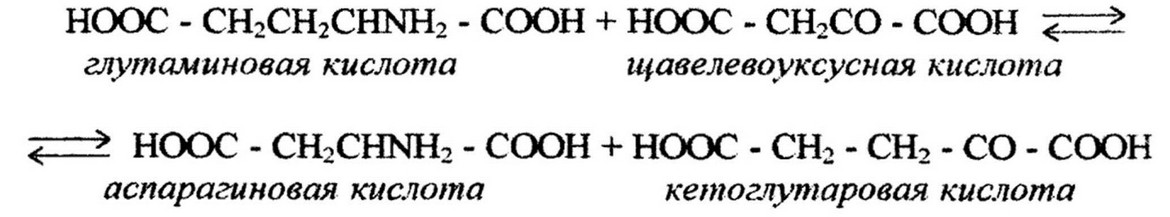
Авторами было показано и то, что коферментом является пиридоксальфосфат.
Переаминирование широко распространено у бактерий и является весьма важным процессом биологического распада и синтеза аминокислот. Но не все бактерии обладают одинаковой способностью к расщеплению аминокислот. Многие из обычных грамотрицательных бактерий содержат ферменты, расщепляющие значительное количество аминокислот. Так, Proteus vulgaris, Aerobac. aerogenes, E. coli расщепляют свыше 13 аминокислот. Грамположительные кокки (стрептококки, стафилококки) расщепляют ограниченное количество аминокислот. Поэтому для них аминокислоты не являются существенным источником энергии.
