2.10. Синдром “пустого” турецкого седла
Термин “пустое” турецкое седло (ПТС) введен в литературу в 1951 г., когда впервые на анатомическом материале было обнаружено заполнение полости турецкого седла не гипофизом, а цереброспинальной жидкостью (ликво- ром), оттесняющим уменьшенный в объеме гипофиз, и иногда распластывающим его по дну и стенкам турецкого седла. Синдром ПТС является одной из малоизученных проблем нейроэндокринологии. Значение этой проблемы возросло с внедрением неинвазивного метода МРТ, который способствовал более частому его выявлению.
Этиология и патогенез. Формирование ПТС связано с рядом причин. В тех случаях, когда развитию этого синдрома предшествовала операция на селлярной области (например, удаление краниофарингиомы, аденомы), лу- v чевая или фармакотерапия аденомы гипофиза, принято говорить о вторичном “пустом” турецком седле. Если в анамнезе нет указаний на вмешательства в области гипофиза, то выявленный феномен ПТС расценивается как первичное “пустое” турецкое седло. Уменьшение гипофиза в объеме, какими бы причинами оно ни было вызвано, ведет к расширению супраселлярного субарахноидального пространства в полость седла. Пролабированию арах- ноидальной оболочки в полость турецкого седла способствуют анатомическая неполноценность диафрагмы седла и повышение внутричерепного давления. Анатомическая неполноценность диафрагмы может быть врожденной или приобретенной. По некоторым данным, полное отсутствие диафрагмы седла выявляется у 20 % здоровых лиц. Приобретенная недостаточность диафрагмы седла может быть следствием заместительной гормональной терапии, пероральной контрацепции, беременности, менопаузы, т.е. состояний, сопровождающихся гипертрофией гипофиза и его ножки с последующей инволюцией и уменьшением их объема. Физиологическая инволюция гипофиза наблюдается в основном у женщин, что объясняет значительно большую частоту первичного ПТС у женщин, особенно после 40 лет, по сравнению с мужчинами. К факторам, ведущим к сморщиванию гипофиза и увеличению дефекта диафрагмы седла причисляют спонтанный некроз аденомы гипофиза, сосудистые заболевания головного мозга, тяжелый сахарный диабет (с апоплексией гипофиза), черепно-мозговую травму, менингит. Недостаточность диафрагмы приводит к расширению субарахноидаль- ного пространства в интраселлярную область; возникает возможность непосредственной передачи пульсации ликвора на гипофиз, что обусловливает уплощение последнего с прижиманием ко дну или спинке турецкого седла. Объем гипофизарной ямки в таком случае увеличивается. Таким образом, важным фактором патогенеза ПТС является повышение пульсового давления ликвора (внутричерепная гипертензия, гипертоническая болезнь, гид1 роцефалия, внутричерепные опухоли).
Исследования указывают на возможное участие аутоиммунных механизмов в патогенезе синдрома ПТС. Предполагается роль аутоиммунного гипофизита в генезе атрофии гипофиза. Лимфоцитарный аденогипофизит (J1A) рассматривается как одна из причин последующей атрофии гипофиза с недостаточностью его функции. Впервые J1A был выявлен при аутопсии в 1962 г. у женщины с тиреоидитом Хашимото. Как и при аутоиммунных заболеваниях других желез, при JIA обнаруживается инфильтрация аденогипофиза лимфоцитами, плазматическими клетками, эозинофилами с формированием лимфоидных фолликулов и интерстициального фиброза. Современная методика транссфеноидальной пункционной биопсии гипофиза позволяет идентифицировать ДА при жизни. У большинства таких больных имеются сопутствующие аутоиммунные заболевания: пернициозная анемия, аутоиммунный тереоидит, адреналит, лимфоидная инфильтрация околощи- товидных желез, болезнь Аддисона. Частый спутник J1A — гиперпролактинемия. Некоторые авторы отмечают присутствие у больных с JIA антител (Ат) к поверхностным антигенам (Аг) клеток аденогипофиза. Однако корреляция между наличием таких Ат и гипофизарной недостаточностью отсутствует. Можно заключить, таким образом, что первичное и вторичное “пустое” турецкое седло — полиэтиологический синдром.
Клиническая картина. Основные жалобы: на головные боли, головокружения, прибавку массы тела, подъемы АД, изменения половой функции, слабость, утомляемость, нарушения сна, настроения. Наиболее распространенным симптомом ПТС является головная боль (у 70 % больных). Головная боль, как правило, постоянная, выражена больше в области лба, имеет оболочечный характер, т.е. возникает в результате ликворной гипертензии и натяжения твердой мозговой оболочки. Некоторые исследователи считают, что синдром ПТС следует предполагать у женщин среднего возраста с избытком массы тела и ежедневной головной болью. Половая патология у женщин проявляется олигоаменореей и нарушением репродукции. У большинства больных наблюдается гиперпролактинемия с лактореей или без нее. При динамическом исследовании регистрируются колебания уровня ПРЛ в сыворотке от нормального до умеренно повышенного. У мужчин нарушение гонадотропной функции гипофиза часто проявляется снижением либидо, олигоспермией, бесплодием. Вторичный гипогонадизм связан со снижением секреции гипофизом ЛГ и ФСГ. Одним из клинических признаков синдрома
ПТС является несахарный диабет. Описаны случаи сочетания этого заболевания с гипогонадизмом. У 10 % больных обнаруживается первичный или вторичный гипотиреоз. Клинические проявления гипотиреоза иногда слабо выражены.
У большинства больных с первичным и вторичным ПТС секреция СТГ имеет тенденцию к снижению; это чаще выявляется при пробе с инсулиновой гипогликемией. Клиническими проявлениями могут служить ожирение, потеря костной массы и т. д. Синдром ПТС иногда сочетается с различными врожденными аномалиями, в частности с так называемым ДИДМОАД-синдромом (несахарный диабет, ИЗСД, атрофия зрительных нервов, неврит слуховых нервов).
По нашим наблюдениям, при ПТС почти постоянно отмечается цереб- растенический синдром, проявляющийся преходящими когнитивно-аффективными нарушениями даже у молодых больных (снижение памяти, концентрации внимания и интеллектуальной работоспособности; раздражительность, слабость, обидчивость, плаксивость). Характерны также общее снижение работоспособности, переносимости физических нагрузок, нарушение сна. Церебрастенический синдром при ПТС может быть связан с тем, что повышение внутричерепного давления затрудняет венозный отток и дренаж ликвора, снижает артериальный приток и ухудшает микроциркуляцию мозга. Весьма часто у больных с ПТС имеются жалобы, характерные для вестибулярного синдрома: несистемное головокружение, периодическая неуверенность при ходьбе, шаткость походки. Выраженные статико-координа- торные нарушения обычно отсутствуют. Отмечается пошатывание в усложненной позе Ромберга (ноги стоят одна за другой, ступни в одну линию, руки вытянуты вперед, глаза закрыты), легкий дисдиадохокинез (затруднения синхронизации при быстром вращении кистей вытянутых вперед рук), негрубое промахивание при выполнении пальценосовой пробы. Генез вестибулярного синдрома аналогичен церебрастеническому. В тесной связи с двумя предыдущими находится синдром вегетативной дистонии, характеризующийся перманентно-пароксизмальным течением с частыми эпизодами сердцебиений, неудовлетворенности вдохом, ощущением нехватки воздуха, кома в горле, метеозависимостью, приступообразными головными болями, нарушением сна. Основные неврологические проявления, ведущие к снижению качества жизни пациентов с ПТС, обусловлены наличием арахнои- дальной грыжи в полости турецкого седла, и, видимо, имеют с ней общую причину — повышение внутричерепного давления.
Клиническая картина синдрома ПТС полиморфна. Эндокринная функция гипофиза может оставаться нормальной, снижаться или повышаться, если ПТС развивается на фоне гормонально-активной опухоли гипофиза. В зависимости от степени нарушения функции передней или задней доли гипофиза формируются различные клинические синдромы: несахарный диабет, гипопитуитаризм, пангипопитуитаризм, синдром лактореи-аменореи, болезнь Иценко — Кушинга, акромегалия.
Синдром ПТС имеет хроническое волнообразное течение с длительными периодами ремиссии. Лечение, как правило, улучшает самочувствие больных. Декомпенсация наступает чаще всего в связи с повышением внутричерепного давления после перенесенной черепно-мозговой травмы, гриппа, хронического перенапряжения.
Диагноз и дифференциальный диагноз. Развитие ПТС можно предположить на основании характерных жалоб и анамнеза больных, а визуализи-
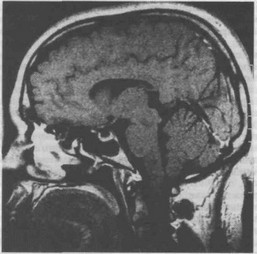
Рис. 2.11. MPT-изображение “пустого” турецкого седла.
рующие исследования подтверждают этот диагноз. При рутинной краниографии часто выявляется увеличение размеров турецкого седла, его шаровидная форма, редко асимметрия. Дно седла выпуклое, выступающее, без признаков местной или общей атрофии, которые характерны для гипофизарных аденом. При пневмоэнцефалографии выявляется арахноидальная грыжа в полости турецкого седла. В последнее время чаще используют неинвазивные методы диагностики — КТ и МРТ (рис.2.11).
При КТ головного мозга хорошо визуализируются как костные структуры (бугорок и спинка турецкого седла, передние клиновидные отростки, отграничивающие гипофизарную ямку латерально), так и ликворные пространства и структуры головного мозга (супраселлярная цистерна, другие цистернальные пространства, желудочковая система), а также гипофиз и его стебель. Костные структуры “пустого” турецкого седла чаще всего не имеют признаков атрофии и деформации. На последовательных сканах головного мозга инфражелудочкового уровня визуализируется супраселлярная цистерна, далее появляются костные ориентиры турецкого седла и гипофизарная ямка, заполненная по сравнению с гипофизом менее плотным содержимым. При ширине срезов 4 мм один или два верхних скана через полость турецкого седла имеют плотность, близкую к ликворной. На дальнейших сканах в области дна турецкого седла определяется ткань гипофиза. Срезы головного мозга, полученные при обычной КТ, располагаются параллельно или под определенным углом к орбитомеатальной линии. При МРТ сагиттальная проекция оказывается наиболее наглядной: костные структуры турецкого седла не визуализируются, но ткань гипофиза дает отчетливый “слепок” гипофизарной ямки. При этом хорошо выявляются форма и размеры гипо
физа, контрастно определяется жидкостная плотность цереброспинальной жидкости ликвора, что позволяет судить о характере содержимого турецкого седла. При тотальном ПТС виден тонкий серповидный гипофиз, выстилающий дно и чаще заднюю стенку седла. При частично “пустом” турецком седле, или так называемом формирующемся ПТС, гипофиз имеет более или менее полулунную форму. На фронтальных МР-сканах хиазмально-селляр- ной области в отсутствие костных ориентиров картина ПТС менее наглядна, но в основном аналогична таковой при КТ.
Признаки внутричерепной гипертензии на краниограмме, а также на КТ- и MPT-сканах косвенно указывают на наличие ПТС. В сомнительных случаях для дифференциации ПТС от эндоселлярной кисты и арахноидаль- ной грыжи можно использовать КТ-цистернографию с малотоксичными йодсодержащими препаратами (амипак, омнипак), которые вводятся суб- арахноидально и контрастируют ликворную систему.
Деминерализация турецкого седла встречается как при нормальной, так и при нарушенной функции гипофиза и свидетельствует о повышенном внутричерепном давлении. Длительное его повышение и признаки нарушенной циркуляции цереброспинальной жидкости (ликвора) ведут к увеличению турецкого седла. При ПТС могут наблюдаться и другие симптомы нарушения циркуляции ликвора — блок свода и гидроцефалия. Все это подтверждает роль нарушения ликвороциркуляции в формировании первичного ПТС. Признаки нарушенной циркуляции цереброспинальной жидкости обнаруживаются и у лиц с пангипопитуитаризмом, несмотря на нормальные размеры турецкого седла.
Для синдрома ПТС характерно нарушение зрения — снижение его остроты, изменение полей, отек диска зрительного нерва, одно- или двусторонняя его атрофия. Это может быть обусловлено как повышением внутричерепного давления со сдавлением стволов зрительного нерва, ухудшением микроциркуляции по vasa nervorum и вторичным отеком нервных стволов, так и более редким состоянием — пролабированием перекреста зрительных нервов в полость турецкого седла через отверстие в диафрагме. Офтальмологическое исследование у пациентов с ПТС имеет исключительную важность, так как изменение полей зрения и дисков зрительных нервов может наблюдаться при открытоугольной глаукоме или глаукоме с низким или нормальным внутриглазным давлением, которая иногда сочетается с синдромом ПТС. Ввиду различий в тактике лечения этих заболеваний необходимо исключить глаукому как причину дефектов полей зрения.
В редких случаях единственным проявлением синдрома ПТС является t ликворинорея, возникающая в результате дефекта кости дна турецкого седла под действием пульсации цереброспинальной жидкости. Сообщение между внутриселлярным субарахноидальным пространством и сфеноидальным синусом должно повышать риск менингита.
Как уже отмечалось, при первично “пустом” турецком седле в сыворотке больных могут присутствовать антипитуитарные Аг, которые не выявляются при другой патологии гипофиза — аденомах, несахарном диабете, а также при других аутоиммунных заболеваниях — хроническом аутоиммунном тиреоидите, системной красной волчанке.
Лечение. При гиперпролактинемии при ПТС необходимо назначать препараты типа бромокриптина для нормализации уровня ПРЛ и восстановления репродуктивной функции. При гипогонадотропном гипогонадизме у женщин и мужчин проводят заместительную терапию половыми гормонами, при явлениях гипотиреоза — тиреоидными препаратами. При недостаточности функции надпочечников показаны синтетические глкжокор- тикоиды.
Важно подчеркнуть, что ослабление тропных функций гипофиза при первичном ПТС выражено незначительно и поэтому не всегда требуется заместительная терапия. При вторичном ПТС гиперпролактинемия часто сочетается с гипопитуитаризмом и реже с пангипопитуитаризмом. Комбинированная заместительная терапия, как правило, приводит к компенсации обмена вешеств, восстанавливает работоспособность больных и улучшает качество их жизни. Применяют также препараты, повышающие осмотическое давление плазмы и обеспечивающие мягкую дегидратацию головного мозга и нервных стволов: 50 % глицерин в дозе 100—150 мл в сутки в 3 приема, повторными курсами по 7—10 дней с 10-дневными перерывами; 15 % раствор маннита по 200—400 мл внутривенно капельно (5—7 вливаний).
Среди основных диуретических препаратов, используемых по разным* показаниям, удовлетворительным эффектом в отношении внутричерепной гипертензии обладает фуросемид, назначаемый по традиционной схеме по 40 мг утром 2—3 раза в неделю. Нарушения венозного оттока, лимфатического дренажа, сопровождающие дегенеративные изменения шейного отдела позвоночника, усугубляют внутричерепную гипертензию, ухудшают церебральную микроциркуляцию. В таких случаях применяют препараты, стабилизирующие сосудистую стенку: венорутон — по 0,5 г 2 раза в день или капсулы по 0,3 г 3 раза в день во время еды в течение 2—4 нед, повторными курсами. Назначают также капсулированную форму сулодексида (антитром- ботического гликозаминогликана естественного происхождения), препарат вессел-дуэ-Ф — по 1—2 капсулы 2 раза в день во время еды. Курсы продолжаются 1—6 мес и могут повторяться. Применять сосудистые препараты на фоне внутричерепной гипертензии необходимо с осторожностью, так как увеличение кровенаполнения головного мозга может усугублять симптомы повышенного внутричерепного давления, усиливая головную боль. Тем не менее при наличии церебрастенических и вестибулярных жалоб показаны сосудорасширяющие препараты (пентоксифиллин, кавинтон, циннаризин, ницерголин, винпоцетин, вазобрал и др.) в сочетании с ноотропными (це- ребролизин, пирацетам, пикамилон, энцефабол) средствами.
В комплексе лечебных мероприятий необходимо предусмотреть ЛФК, массаж и самомассаж шейно-воротниковой зоны, а также растирание мазями, улучшающими состояние опорно-двигательного аппарата и местный кровоток (ревмагель, никофлекс, випросал В и др.).
При синдроме ПТС достаточно эффективно симптоматическое лечение: при вестибулярных жалобах — бетагистидина гидрохлорид; при вегетативных кризах, панических атаках — монотерапия клоназепамом, алпразо- ламом, антидепрессантами седативного (леривон) или активизирующего действия (коаксил).
Прогноз синдрома ПТС благоприятный как для жизни, так и для работы. На фоне адекватной терапии удается обеспечивать длительные ремиссии заболевания, предотвращать нарастание симптоматики. Необходимо обучить пациентов оценивать свое состояние без ипохондрической фиксации, своевременно обращаться к невропатологу, эндокринологу, а также проводить регулярные повторные курсы поддерживающей терапии в амбулаторных условиях.
Нервная анорексия — патологическое пищевое поведение, проявляющееся сознательным отказом от еды с целью коррекции внешности и приводящее к выраженным эндокринным и соматическим нарушениям.
Нервная анорексия наиболее распространена в северных европейских странах, где ее частота составляет 4,06 на 100 тыс. населения. Среди молодых девушек этот показатель значительно выше (до 1 % среди лиц в возрасте 16—18 лет). Это патологическое состояние более характерно для лиц женского пола и особенно распространено среди учащихся балетных школ и студентов высших учебных заведений.
Отсутствие морфологических изменений в аденогипофизе при патологоанатомическом исследовании позволило отказаться от представления о нервной анорексии как о варианте болезни Симмондса (гипофизарной кахексии).
При проведении эпидемиологических исследований обнаруживаются изменения частоты и характера заболеваний. Частота заболеваний возросла особенно у мужчин. Наблюдается рост случаев булимической формы нервной анорексии. Больные все чаще прибегают к искусственно вызываемой рвоте и приему слабительных средств после переедания. Подобные эпизоды были названы синдромом пищевого “кутежа”. Получил распространение термин “нервная булимия”.
Этиология и патогенез. Зарубежные авторы часто трактуют возникновение нервной анорексии с позиций фрейдизма как “бессознательное бегство от сексуальной жизни”, “стремление вернуться в детство”, “отказ от беременности”, “фрустрация оральной фазы” и т. д. Однако психоаналитические концепции не полностью объясняют причины заболевания. В формировании нервной анорексии и ее развитии играют роль как изменения психики, так и гуморальные факторы.
Большое значение придается преморбидным особенностям личности, физическому и психическому развитию, воспитанию, микросоциальным факторам. Нервная анорексия возникает в пре-, пост- и собственно пубертатном периоде, т.е. на фоне дисрегуляторных изменений в эндокринной системе, характерных для этого периода. Формирование именно булимической формы нервной анорексии также связывают с преморбидными особенностями функции гипоталамо-гипофизарной системы.
В последние годы активно исследуется роль лептина в патогенезе заболеваний, связанных с нарушением пищевого поведения. Лептин — белок, регулирующий пищевое поведение путем воздействия на центральные нейроэндокринные механизмы. Он вырабатывается и секретируется адипоци- тами. Содержание лептина в сыворотке четко коррелирует с индексом массы тела (ИМТ) и составом тела (процентом жировой ткани). Уровень лептина может дать информацию о запасах жировой ткани в организме, но не может оказать реальной помощи в диагностике или прогнозе нервной анорексии и других болезней, связанных с нарушением правильного пищевого поведения.
Само по себе голодание, приводящее к истощению организма, вызывает вторичные нейроэндокринные и метаболические изменения, которые в свою очередь влияют на функцию структур мозга, изменяя психику больного. Формируется замкнутый крут психобиологических сдвигов.
Одним из диагностических критериев нервной анорексии является аменорея. Именно нарушения менструальной функции часто заставляют больных обращаться к врачу. Согласно распространенной точке зрения, прекращение менструаций происходит вторично из-за потери массы тела. Существует представление о критической массе тела — достаточно индивидуальном ее пороге, при котором наступает аменорея. Однако у многих больных менструации прекращаются в самом начале заболевания, когда масса тела еще не изменена. Более того, при восстановлении последней менструальная функция может долго оставаться нарушенной. У больных с булимией аменорея чаще возникает без выраженного дефицита массы тела. Все это позволяет думать о первичности гипоталамических нарушений. При восстановлении массы тела важно добиться нормализации коэффициента жировая ткань/масса тела, обеспечивающего нормальный метаболизм эстрогенов. ’
При исследовании гонадотропной секреции выявлено снижение циркулирующих гипофизарных и овариальных гормонов. При введении больным ЛРГ (люлиберина) отмечается сниженный по сравнению со здоровыми выброс ЛГ и ФСГ. Восстановление чувствительности к экзогенному ГнРГ на фоне нормализации массы тела подтверждает центральный генез аменореи. У больных нервной анорексией с выраженным дефицитом массы тела секреция гонадотропинов аналогична таковой у девочек пубертатного возраста. При полном восстановлении массы тела суточный ритм секреции этих гормонов налаживается.
Полагают, что звеном, обеспечивающим связь контроля потребления пищи с секрецией ГнРГ, является гипоталамический нейропептид Y. В ответ на пищевую депривацию уровень нейропептида Y в цереброспинальной жидкости возрастает. Клетки, продуцирующие нейропептид Y, располагаются в области аркуатного ядра гипоталамуса. Этот пептид стимулирует пищевое поведение и одновременно регулирует гонадотропную функцию гипофиза (преимущественно за счет подавления импульсной секреции ГнРГ).
При нервной анорексии обнаружены повышение уровня тестостерона и снижение содержания эстрадиола в сыворотке, что связано с изменением функции ферментных систем синтеза и метаболизма этих стероидов в тканях.
Концентрации свободного и общего Т4 в сыворотке больных нормальные, однако уровень тестостерона при выраженном дефиците массы тела снижается, а содержание ТТГ не меняется, что указывает на парадоксальную резистентность гипофиза к снижению уровня Т3. Вместе с тем взаимоотношения между гипоталамусом и гипофизом сохраняются, о чем свидетельствует нормальная реакция ТТГ на экзогенный ТРГ. Снижение концентрации тестостерона связано с изменением периферической конверсии Т4 в тестостероне и расценивается как компенсаторная реакция, способствующая сохранению энергии в условиях истощения.
У больных нервной анорексией содержание кортизола в сыворотке повышено, но реакция АКТГ на КРГ оказывается существенно менее выраженной, чем в норме, хотя базальная концентрация АКТГ в сыворотке остается нормальной. Важно отметить, что изменение ритма секреции кортизола и отсутствие подавления при проведении пробы с дексаметазоном, характерные для нервной анорексии, наблюдаются и при некоторых психических нарушениях, не сопровождающихся дефицитом массы тела.
У больных, отказывающихся от приема пищи, отмечается хроническая гипогликемия. Описано развитие гипогликемической комы у таких больных. Нервная анорексия у больных ИЗСД является причиной необъяснимой лабильности течения сахарного диабета.
При высоком уровне НЬА1с у молодых пациенток с ИЗСД с исключенными другими признаками декомпенсации углеводного обмена необходимо исследование особенностей пищевого поведения для исключения нервной анорексии.
Уровень СТГ при тяжелом состоянии больных и значительном дефиците массы тела повышен. Отмечается его парадоксальная реакция на введение глюкозы.
Выраженная тенденция к хронизации заболевания (более 50 % случаев) и длительный период аменореи обусловливают у больных с нервной анорексией развитие остеопороза. Так, у лиц со средней массой тела 43,6 кг и ИМТ менее 20 кг/м2 обнаружено резкое снижение плотности костной ткани. Остеопороз у таких больных нередко остается невыявленным. На фоне терапии эстрогенами у женщин с хроническим течением нервной анорексии потеря костной массы продолжает прогрессировать. Восстановление массы тела ведет к нормализации плотности костей.
Уже на ранних этапах заболевания меняется состояние ферментных систем печени. Нарушается функция почек: снижаются минутный диурез, клиренс эндогенного креатинина, экскреция электролитов с мочой. Эти сдвиги имеют, по-видимому, адаптивный характер.
У больных с разными формами нервной анорексии отмечаются падение уровня калия в плазме и клетках, внутриклеточный ацидоз (хотя при рвоте может наблюдаться и алкалоз). Внезапную смерть больных нервной анорексией связывают именно с электролитными нарушениями. Объем циркулирующей крови уменьшается, однако при расчете на 1 кг массы тела отмечается гиперволемия, что требует особой осторожности при назначении таким больным внутривенных инфузий. Неадекватная инфузионная терапия может приводить к смертельному исходу.
Клиническая картина. Выделяют несколько периодов заболевания — инициальный, аноректический, кахектический и этап редукции нервной анорексии. Первый период — формирование дисморфомании (недовольство внешностью, стремление к коррекции фигуры). Второй период (аноректический) заканчивается потерей 25—50 % массы тела. В этом периоде отмечается широкая клиническая симптоматика: вторичные соматические нарушения, изменения в эндокринной системе. Больные скрывают свое состояние, утверждают, что у них нет аппетита. Однако при психологическом Обследовании выявляется высокая пищевая потребность. Истинная анорексия отсутствует. Больные сознательно ограничивают прием пищи, используют интенсивные физические нагрузки. Более половины больных не выдерживают чувства голода, но после еды вызывают у себя искусственную рвоту, которая быстро перестает вызывать неприятные вегетативные симптомы. После рвоты или промывания желудка большим количеством воды возникает чувство легкости, удовольствия от “очищенности”. Больные часто прибегают к приему мочегонных и слабительных средств. Практически во всех случаях на этом этапе возникает аменорея, появляются брадикардия и гипотензия. На этом фоне сохраняется высокая физическая активность. Отмечаются гипотермия, зябкость, сухость кожи, алопеция, запоры, отеки.
После потери более 50 % исходной массы тела развивается кахектический этап. Больные полностью утрачивают критическое отношение к своему состоянию: подкожная жировая клетчатка отсутствует, отмечаются гипертрихоз, сухость кожи, отеки, трофические изменения, брадикардия, гипотензия, выраженные нарушения электролитного баланса. Это состояние без терапевтического вмешательства приводит к смерти.
При КТ- и MPT-исследовании выявляются морфологические изменения в ЦНС, которые могут быть обратимыми после восстановления массы тела. При позиционной эмиссионной томографии обнаруживается каудальная гиперактивность. При депрессиях, а также при нервной булимии регистрируется ряд межполушарных асимметрий.
Диагноз нервной анорексии чаще всего устанавливается лишь при выраженном дефиците массы тела, поскольку, как уже отмечалось, больные тщательно скрывают свое состояние. Часто такие больные длительно обследуются терапевтами и гастроэнтерологами и даже подвергаются ненужным оперативным вмешательствам. Обычно устанавливают ошибочный диагноз гипофизарной кахексии и назначают заместительную гормональную терапию. Американской Ассоциацией психиатров предложены критерии анорексий, в том числе нервной (DSM-X). К ним относятся: боязнь “потолстеть” (не уменьшается, несмотря на потерю массы тела); нарушение восприятия своего тела (“чувствую себя толстой” — даже при наличии истощения); отказ сохранять массу теЛа выше минимальной нормальной для своего возраста и роста; аменорея.
Больных, которые только ограничивают прием пищи, причисляют к типу I, а тех, которые, кроме того, еще и “очищаются” (вызывают рвоту, принимают слабительные, диуретики), — к типу II.
Критериями булимии являются повторяющиеся эпизоды переедания (быстрое потребление больших количеств пищи) и по крайней мере два из следующих пунктов:
Если одновременно присутствуют критерии нервной анорексии, устанавливают оба диагноза.
Представленные схемы не полностью отражают особенности больных и не учитывают тяжести соматоэндокринных нарушений и характеристик особенностей личности.
Дифференциальный диагноз. После исключения соматической патологии эндокринологу нужно дифференцировать нервную анорексию от болезни Симмондса и надпочечниковой недостаточности. Это состояние приходиться дифференцировать также от невроза, шизофрении с аноректическим синдромом, депрессий.
Лечение, Больные нуждаются в длительном лечении у психиатра. Особое внимание уделяется выведению больного из состояния кахексии. Необходима обязательная госпитализация в психиатрический стационар: наазор за адекватным питанием, изоляция от семьи. Наилучший эффект дает адекватное энтеральное питание элементными смесями. Следующий этап — специфическая терапия психотропными средствами, а затем — психосоциальная адаптация.
По нашим данным, у 30—40 % больных не происходит восстановления менструальной функции после нормализации массы тела и ее стабилизации в течение 5—6 мес на фоне отмены психотропных препаратов. Это требует консультаций гинеколога-эндокринолога. Соответствующую группу составляют больные с поздним появлением менструаций, их высоким “весовым порогом”, началом заболевания в допубертатном периоде и длительным его течением.
Прогноз не вполне удовлетворительный. По данным разных авторов, частота смертельных исходов колеблется от 2—3 до 16—20 %. Среди причин смерти — инфекции, сепсис, некроз кишечника и др.
Описанный в литературе случай субэндокардиального инфаркта миокарда у 20-летней женщины с нервной булимией, которая с суицидальной целью ввела себе 20 г кофеина, подчеркивает широту возможных последствий и медицинских проблем, возникающих при этих состояниях.
При длительном наблюдении за такими больными (в среднем 5—6 лет) установлено, что нервная анорексия или булимия сохраняются в 38—56 % случаев. Выздоровление наблюдается главным образом через 6—12 лет после начала заболевания. Опыт 10-летнего наблюдения за больными нервной анорексией показывает, что смертность составила 6,6 %. Полное излечение наблюдалось лишь у 64 % больных. Более чем в половине случаев развивался булимический вариант пищевого поведения.
Несмотря на большое количество исследований, посвященных этим состояниям, в настоящее время не существует адекватных методов их лечения. Это лишь подчеркивает необходимость раннего распознавания и коррекции психологических проблем на этапе отсутствия выраженных эндокринных и соматических проявлений болезни.
ЛИТЕРАТУРА
Алгоритмы диагностики и лечения болезней эндокринной системы/Под ред.акад. У И.И.Дедова. — М., 1995. — 256 с.
Бсиюболкин М.И. Эндокринология. — М., 1998. — 581 с.
Вакс ВВ., Марова Е.И., Гончаров Н.П. и др. Клинические, морфологические и гормональные особенности “неактивных” аденом гипофиза/Хирургия эндокринных желез. — СПб., 1995. — С. 28—35.
Дедов И.И., Мельниченко ГА. Персистируюшая галакторея-аменорея. — М.: Медицина, 1985. — 253 с.
Диагностика и лечение соматотропной недостаточности у детей (методические ре- комендации)/Под ред.И.И.Дедова. — М., 1995.
Клиническая эндокринология/Под ред.Н.Т.Старковой. — М.: Медицина, 1991. — 512 с.
Марова Е.И. Болезнь Иценко — Кушинга (патогенез, клиника, диагностика, лечение): Дисс. ... д-ра мед. наук. — М., 1992.
Почечная эндокринология: Пер. с англ./Под ред.М.Дж.Данна. — М.: Медицина, 1987. - 672 с.
Эндокринология и метаболизм: Пер. с англ./Под ред.Ф.Фелига, Дж.Д.Бакстера, А.Е.Бродуса, Л.А.Фромена. — М.: Медицина, 1985. — 520 с.
A clinical problem: microprolactinoma. Diagnosis and treatment/ Ed. G.M. Molinatti//Pro- ceedings of an international Workshop.—Saint Vincent, Italy. — 1982. — 22 April.
Asa S.L., Kovacs K. Clinically non-functioning human pituitary adenomas//Can.J. Neurol.Sci. - 1992. - Vol. 14. - Bd 19. -P.228-235.
Bengtsson S. The consequences of growth hormone deficiency in adults//Acta Endocri- nolo.-1993.-Vol. 128 (Suppl.2).-P.2-5.
Bjerre P. The empty sella. A reappraisal of etiology and pathogenesis//Acta-neurol.-scand.— 1990.—Bd 130 (Suppl.).—P.l—25.
Colao A., A di Sarno. Samacchiario Prolactinomas Resistent to Standard Dopamine Agonists Respond to Chronic Cabergoline Treatment//J.clin.Endocr.Metab.— 1997.— Vol.82(3).—P.876—883.
Faglia G., Ambrosi B. Functionless pituitary tumours/Clinical Endocrinology edited $y A. Grossman.—Oxford, 1992.—P. 169—176.
Greenman Y, Melmed S. Diagnosis and management of nonfunctioning pituitary tumors// Ann.Rev.Med.—1996,—Vol.47.-P.95—106.
Harris A. Acromegaly and its management.—USA: Lippincott-Raven Publishers.—1996.— P. 175.
Hartman D. Anorexia nervosa-diagnosis, aetology and treatment Postgrad//Med. S.—1995.— Vol.71.—issue 841.—P.712—716.
Herder W.W., Lamberts S.W.J. Advances in the diagnosis and treatment of Cushing’s// Clin.Endocr.and Metab.-1995.-Vol.9.-N 2.-P.315—336.
Melmed S. Pituitari neoplasia//Amer.J.Endocr.Metab.Clin.North.—1994.—Vol.23(1).— P.81—92.
Speroff L., Class Robert U., Kase N. Clinical Gynecology, Endocrinology and Infertility: fifth Edition. William and Wilkins, 1995.
Wajchenberg B., Mendonca B., Liberman B. et a/.//Endocr.Rev.— 1994.—Vol. 15,—N 6 — P.752—787.
Этиология и патогенез. Формирование ПТС связано с рядом причин. В тех случаях, когда развитию этого синдрома предшествовала операция на селлярной области (например, удаление краниофарингиомы, аденомы), лу- v чевая или фармакотерапия аденомы гипофиза, принято говорить о вторичном “пустом” турецком седле. Если в анамнезе нет указаний на вмешательства в области гипофиза, то выявленный феномен ПТС расценивается как первичное “пустое” турецкое седло. Уменьшение гипофиза в объеме, какими бы причинами оно ни было вызвано, ведет к расширению супраселлярного субарахноидального пространства в полость седла. Пролабированию арах- ноидальной оболочки в полость турецкого седла способствуют анатомическая неполноценность диафрагмы седла и повышение внутричерепного давления. Анатомическая неполноценность диафрагмы может быть врожденной или приобретенной. По некоторым данным, полное отсутствие диафрагмы седла выявляется у 20 % здоровых лиц. Приобретенная недостаточность диафрагмы седла может быть следствием заместительной гормональной терапии, пероральной контрацепции, беременности, менопаузы, т.е. состояний, сопровождающихся гипертрофией гипофиза и его ножки с последующей инволюцией и уменьшением их объема. Физиологическая инволюция гипофиза наблюдается в основном у женщин, что объясняет значительно большую частоту первичного ПТС у женщин, особенно после 40 лет, по сравнению с мужчинами. К факторам, ведущим к сморщиванию гипофиза и увеличению дефекта диафрагмы седла причисляют спонтанный некроз аденомы гипофиза, сосудистые заболевания головного мозга, тяжелый сахарный диабет (с апоплексией гипофиза), черепно-мозговую травму, менингит. Недостаточность диафрагмы приводит к расширению субарахноидаль- ного пространства в интраселлярную область; возникает возможность непосредственной передачи пульсации ликвора на гипофиз, что обусловливает уплощение последнего с прижиманием ко дну или спинке турецкого седла. Объем гипофизарной ямки в таком случае увеличивается. Таким образом, важным фактором патогенеза ПТС является повышение пульсового давления ликвора (внутричерепная гипертензия, гипертоническая болезнь, гид1 роцефалия, внутричерепные опухоли).
Исследования указывают на возможное участие аутоиммунных механизмов в патогенезе синдрома ПТС. Предполагается роль аутоиммунного гипофизита в генезе атрофии гипофиза. Лимфоцитарный аденогипофизит (J1A) рассматривается как одна из причин последующей атрофии гипофиза с недостаточностью его функции. Впервые J1A был выявлен при аутопсии в 1962 г. у женщины с тиреоидитом Хашимото. Как и при аутоиммунных заболеваниях других желез, при JIA обнаруживается инфильтрация аденогипофиза лимфоцитами, плазматическими клетками, эозинофилами с формированием лимфоидных фолликулов и интерстициального фиброза. Современная методика транссфеноидальной пункционной биопсии гипофиза позволяет идентифицировать ДА при жизни. У большинства таких больных имеются сопутствующие аутоиммунные заболевания: пернициозная анемия, аутоиммунный тереоидит, адреналит, лимфоидная инфильтрация околощи- товидных желез, болезнь Аддисона. Частый спутник J1A — гиперпролактинемия. Некоторые авторы отмечают присутствие у больных с JIA антител (Ат) к поверхностным антигенам (Аг) клеток аденогипофиза. Однако корреляция между наличием таких Ат и гипофизарной недостаточностью отсутствует. Можно заключить, таким образом, что первичное и вторичное “пустое” турецкое седло — полиэтиологический синдром.
Клиническая картина. Основные жалобы: на головные боли, головокружения, прибавку массы тела, подъемы АД, изменения половой функции, слабость, утомляемость, нарушения сна, настроения. Наиболее распространенным симптомом ПТС является головная боль (у 70 % больных). Головная боль, как правило, постоянная, выражена больше в области лба, имеет оболочечный характер, т.е. возникает в результате ликворной гипертензии и натяжения твердой мозговой оболочки. Некоторые исследователи считают, что синдром ПТС следует предполагать у женщин среднего возраста с избытком массы тела и ежедневной головной болью. Половая патология у женщин проявляется олигоаменореей и нарушением репродукции. У большинства больных наблюдается гиперпролактинемия с лактореей или без нее. При динамическом исследовании регистрируются колебания уровня ПРЛ в сыворотке от нормального до умеренно повышенного. У мужчин нарушение гонадотропной функции гипофиза часто проявляется снижением либидо, олигоспермией, бесплодием. Вторичный гипогонадизм связан со снижением секреции гипофизом ЛГ и ФСГ. Одним из клинических признаков синдрома
ПТС является несахарный диабет. Описаны случаи сочетания этого заболевания с гипогонадизмом. У 10 % больных обнаруживается первичный или вторичный гипотиреоз. Клинические проявления гипотиреоза иногда слабо выражены.
У большинства больных с первичным и вторичным ПТС секреция СТГ имеет тенденцию к снижению; это чаще выявляется при пробе с инсулиновой гипогликемией. Клиническими проявлениями могут служить ожирение, потеря костной массы и т. д. Синдром ПТС иногда сочетается с различными врожденными аномалиями, в частности с так называемым ДИДМОАД-синдромом (несахарный диабет, ИЗСД, атрофия зрительных нервов, неврит слуховых нервов).
По нашим наблюдениям, при ПТС почти постоянно отмечается цереб- растенический синдром, проявляющийся преходящими когнитивно-аффективными нарушениями даже у молодых больных (снижение памяти, концентрации внимания и интеллектуальной работоспособности; раздражительность, слабость, обидчивость, плаксивость). Характерны также общее снижение работоспособности, переносимости физических нагрузок, нарушение сна. Церебрастенический синдром при ПТС может быть связан с тем, что повышение внутричерепного давления затрудняет венозный отток и дренаж ликвора, снижает артериальный приток и ухудшает микроциркуляцию мозга. Весьма часто у больных с ПТС имеются жалобы, характерные для вестибулярного синдрома: несистемное головокружение, периодическая неуверенность при ходьбе, шаткость походки. Выраженные статико-координа- торные нарушения обычно отсутствуют. Отмечается пошатывание в усложненной позе Ромберга (ноги стоят одна за другой, ступни в одну линию, руки вытянуты вперед, глаза закрыты), легкий дисдиадохокинез (затруднения синхронизации при быстром вращении кистей вытянутых вперед рук), негрубое промахивание при выполнении пальценосовой пробы. Генез вестибулярного синдрома аналогичен церебрастеническому. В тесной связи с двумя предыдущими находится синдром вегетативной дистонии, характеризующийся перманентно-пароксизмальным течением с частыми эпизодами сердцебиений, неудовлетворенности вдохом, ощущением нехватки воздуха, кома в горле, метеозависимостью, приступообразными головными болями, нарушением сна. Основные неврологические проявления, ведущие к снижению качества жизни пациентов с ПТС, обусловлены наличием арахнои- дальной грыжи в полости турецкого седла, и, видимо, имеют с ней общую причину — повышение внутричерепного давления.
Клиническая картина синдрома ПТС полиморфна. Эндокринная функция гипофиза может оставаться нормальной, снижаться или повышаться, если ПТС развивается на фоне гормонально-активной опухоли гипофиза. В зависимости от степени нарушения функции передней или задней доли гипофиза формируются различные клинические синдромы: несахарный диабет, гипопитуитаризм, пангипопитуитаризм, синдром лактореи-аменореи, болезнь Иценко — Кушинга, акромегалия.
Синдром ПТС имеет хроническое волнообразное течение с длительными периодами ремиссии. Лечение, как правило, улучшает самочувствие больных. Декомпенсация наступает чаще всего в связи с повышением внутричерепного давления после перенесенной черепно-мозговой травмы, гриппа, хронического перенапряжения.
Диагноз и дифференциальный диагноз. Развитие ПТС можно предположить на основании характерных жалоб и анамнеза больных, а визуализи-

Рис. 2.11. MPT-изображение “пустого” турецкого седла.
рующие исследования подтверждают этот диагноз. При рутинной краниографии часто выявляется увеличение размеров турецкого седла, его шаровидная форма, редко асимметрия. Дно седла выпуклое, выступающее, без признаков местной или общей атрофии, которые характерны для гипофизарных аденом. При пневмоэнцефалографии выявляется арахноидальная грыжа в полости турецкого седла. В последнее время чаще используют неинвазивные методы диагностики — КТ и МРТ (рис.2.11).
При КТ головного мозга хорошо визуализируются как костные структуры (бугорок и спинка турецкого седла, передние клиновидные отростки, отграничивающие гипофизарную ямку латерально), так и ликворные пространства и структуры головного мозга (супраселлярная цистерна, другие цистернальные пространства, желудочковая система), а также гипофиз и его стебель. Костные структуры “пустого” турецкого седла чаще всего не имеют признаков атрофии и деформации. На последовательных сканах головного мозга инфражелудочкового уровня визуализируется супраселлярная цистерна, далее появляются костные ориентиры турецкого седла и гипофизарная ямка, заполненная по сравнению с гипофизом менее плотным содержимым. При ширине срезов 4 мм один или два верхних скана через полость турецкого седла имеют плотность, близкую к ликворной. На дальнейших сканах в области дна турецкого седла определяется ткань гипофиза. Срезы головного мозга, полученные при обычной КТ, располагаются параллельно или под определенным углом к орбитомеатальной линии. При МРТ сагиттальная проекция оказывается наиболее наглядной: костные структуры турецкого седла не визуализируются, но ткань гипофиза дает отчетливый “слепок” гипофизарной ямки. При этом хорошо выявляются форма и размеры гипо
физа, контрастно определяется жидкостная плотность цереброспинальной жидкости ликвора, что позволяет судить о характере содержимого турецкого седла. При тотальном ПТС виден тонкий серповидный гипофиз, выстилающий дно и чаще заднюю стенку седла. При частично “пустом” турецком седле, или так называемом формирующемся ПТС, гипофиз имеет более или менее полулунную форму. На фронтальных МР-сканах хиазмально-селляр- ной области в отсутствие костных ориентиров картина ПТС менее наглядна, но в основном аналогична таковой при КТ.
Признаки внутричерепной гипертензии на краниограмме, а также на КТ- и MPT-сканах косвенно указывают на наличие ПТС. В сомнительных случаях для дифференциации ПТС от эндоселлярной кисты и арахноидаль- ной грыжи можно использовать КТ-цистернографию с малотоксичными йодсодержащими препаратами (амипак, омнипак), которые вводятся суб- арахноидально и контрастируют ликворную систему.
Деминерализация турецкого седла встречается как при нормальной, так и при нарушенной функции гипофиза и свидетельствует о повышенном внутричерепном давлении. Длительное его повышение и признаки нарушенной циркуляции цереброспинальной жидкости (ликвора) ведут к увеличению турецкого седла. При ПТС могут наблюдаться и другие симптомы нарушения циркуляции ликвора — блок свода и гидроцефалия. Все это подтверждает роль нарушения ликвороциркуляции в формировании первичного ПТС. Признаки нарушенной циркуляции цереброспинальной жидкости обнаруживаются и у лиц с пангипопитуитаризмом, несмотря на нормальные размеры турецкого седла.
Для синдрома ПТС характерно нарушение зрения — снижение его остроты, изменение полей, отек диска зрительного нерва, одно- или двусторонняя его атрофия. Это может быть обусловлено как повышением внутричерепного давления со сдавлением стволов зрительного нерва, ухудшением микроциркуляции по vasa nervorum и вторичным отеком нервных стволов, так и более редким состоянием — пролабированием перекреста зрительных нервов в полость турецкого седла через отверстие в диафрагме. Офтальмологическое исследование у пациентов с ПТС имеет исключительную важность, так как изменение полей зрения и дисков зрительных нервов может наблюдаться при открытоугольной глаукоме или глаукоме с низким или нормальным внутриглазным давлением, которая иногда сочетается с синдромом ПТС. Ввиду различий в тактике лечения этих заболеваний необходимо исключить глаукому как причину дефектов полей зрения.
В редких случаях единственным проявлением синдрома ПТС является t ликворинорея, возникающая в результате дефекта кости дна турецкого седла под действием пульсации цереброспинальной жидкости. Сообщение между внутриселлярным субарахноидальным пространством и сфеноидальным синусом должно повышать риск менингита.
Как уже отмечалось, при первично “пустом” турецком седле в сыворотке больных могут присутствовать антипитуитарные Аг, которые не выявляются при другой патологии гипофиза — аденомах, несахарном диабете, а также при других аутоиммунных заболеваниях — хроническом аутоиммунном тиреоидите, системной красной волчанке.
Лечение. При гиперпролактинемии при ПТС необходимо назначать препараты типа бромокриптина для нормализации уровня ПРЛ и восстановления репродуктивной функции. При гипогонадотропном гипогонадизме у женщин и мужчин проводят заместительную терапию половыми гормонами, при явлениях гипотиреоза — тиреоидными препаратами. При недостаточности функции надпочечников показаны синтетические глкжокор- тикоиды.
Важно подчеркнуть, что ослабление тропных функций гипофиза при первичном ПТС выражено незначительно и поэтому не всегда требуется заместительная терапия. При вторичном ПТС гиперпролактинемия часто сочетается с гипопитуитаризмом и реже с пангипопитуитаризмом. Комбинированная заместительная терапия, как правило, приводит к компенсации обмена вешеств, восстанавливает работоспособность больных и улучшает качество их жизни. Применяют также препараты, повышающие осмотическое давление плазмы и обеспечивающие мягкую дегидратацию головного мозга и нервных стволов: 50 % глицерин в дозе 100—150 мл в сутки в 3 приема, повторными курсами по 7—10 дней с 10-дневными перерывами; 15 % раствор маннита по 200—400 мл внутривенно капельно (5—7 вливаний).
Среди основных диуретических препаратов, используемых по разным* показаниям, удовлетворительным эффектом в отношении внутричерепной гипертензии обладает фуросемид, назначаемый по традиционной схеме по 40 мг утром 2—3 раза в неделю. Нарушения венозного оттока, лимфатического дренажа, сопровождающие дегенеративные изменения шейного отдела позвоночника, усугубляют внутричерепную гипертензию, ухудшают церебральную микроциркуляцию. В таких случаях применяют препараты, стабилизирующие сосудистую стенку: венорутон — по 0,5 г 2 раза в день или капсулы по 0,3 г 3 раза в день во время еды в течение 2—4 нед, повторными курсами. Назначают также капсулированную форму сулодексида (антитром- ботического гликозаминогликана естественного происхождения), препарат вессел-дуэ-Ф — по 1—2 капсулы 2 раза в день во время еды. Курсы продолжаются 1—6 мес и могут повторяться. Применять сосудистые препараты на фоне внутричерепной гипертензии необходимо с осторожностью, так как увеличение кровенаполнения головного мозга может усугублять симптомы повышенного внутричерепного давления, усиливая головную боль. Тем не менее при наличии церебрастенических и вестибулярных жалоб показаны сосудорасширяющие препараты (пентоксифиллин, кавинтон, циннаризин, ницерголин, винпоцетин, вазобрал и др.) в сочетании с ноотропными (це- ребролизин, пирацетам, пикамилон, энцефабол) средствами.
В комплексе лечебных мероприятий необходимо предусмотреть ЛФК, массаж и самомассаж шейно-воротниковой зоны, а также растирание мазями, улучшающими состояние опорно-двигательного аппарата и местный кровоток (ревмагель, никофлекс, випросал В и др.).
При синдроме ПТС достаточно эффективно симптоматическое лечение: при вестибулярных жалобах — бетагистидина гидрохлорид; при вегетативных кризах, панических атаках — монотерапия клоназепамом, алпразо- ламом, антидепрессантами седативного (леривон) или активизирующего действия (коаксил).
Прогноз синдрома ПТС благоприятный как для жизни, так и для работы. На фоне адекватной терапии удается обеспечивать длительные ремиссии заболевания, предотвращать нарастание симптоматики. Необходимо обучить пациентов оценивать свое состояние без ипохондрической фиксации, своевременно обращаться к невропатологу, эндокринологу, а также проводить регулярные повторные курсы поддерживающей терапии в амбулаторных условиях.
Нервная анорексия — патологическое пищевое поведение, проявляющееся сознательным отказом от еды с целью коррекции внешности и приводящее к выраженным эндокринным и соматическим нарушениям.
Нервная анорексия наиболее распространена в северных европейских странах, где ее частота составляет 4,06 на 100 тыс. населения. Среди молодых девушек этот показатель значительно выше (до 1 % среди лиц в возрасте 16—18 лет). Это патологическое состояние более характерно для лиц женского пола и особенно распространено среди учащихся балетных школ и студентов высших учебных заведений.
Отсутствие морфологических изменений в аденогипофизе при патологоанатомическом исследовании позволило отказаться от представления о нервной анорексии как о варианте болезни Симмондса (гипофизарной кахексии).
При проведении эпидемиологических исследований обнаруживаются изменения частоты и характера заболеваний. Частота заболеваний возросла особенно у мужчин. Наблюдается рост случаев булимической формы нервной анорексии. Больные все чаще прибегают к искусственно вызываемой рвоте и приему слабительных средств после переедания. Подобные эпизоды были названы синдромом пищевого “кутежа”. Получил распространение термин “нервная булимия”.
Этиология и патогенез. Зарубежные авторы часто трактуют возникновение нервной анорексии с позиций фрейдизма как “бессознательное бегство от сексуальной жизни”, “стремление вернуться в детство”, “отказ от беременности”, “фрустрация оральной фазы” и т. д. Однако психоаналитические концепции не полностью объясняют причины заболевания. В формировании нервной анорексии и ее развитии играют роль как изменения психики, так и гуморальные факторы.
Большое значение придается преморбидным особенностям личности, физическому и психическому развитию, воспитанию, микросоциальным факторам. Нервная анорексия возникает в пре-, пост- и собственно пубертатном периоде, т.е. на фоне дисрегуляторных изменений в эндокринной системе, характерных для этого периода. Формирование именно булимической формы нервной анорексии также связывают с преморбидными особенностями функции гипоталамо-гипофизарной системы.
В последние годы активно исследуется роль лептина в патогенезе заболеваний, связанных с нарушением пищевого поведения. Лептин — белок, регулирующий пищевое поведение путем воздействия на центральные нейроэндокринные механизмы. Он вырабатывается и секретируется адипоци- тами. Содержание лептина в сыворотке четко коррелирует с индексом массы тела (ИМТ) и составом тела (процентом жировой ткани). Уровень лептина может дать информацию о запасах жировой ткани в организме, но не может оказать реальной помощи в диагностике или прогнозе нервной анорексии и других болезней, связанных с нарушением правильного пищевого поведения.
Само по себе голодание, приводящее к истощению организма, вызывает вторичные нейроэндокринные и метаболические изменения, которые в свою очередь влияют на функцию структур мозга, изменяя психику больного. Формируется замкнутый крут психобиологических сдвигов.
Одним из диагностических критериев нервной анорексии является аменорея. Именно нарушения менструальной функции часто заставляют больных обращаться к врачу. Согласно распространенной точке зрения, прекращение менструаций происходит вторично из-за потери массы тела. Существует представление о критической массе тела — достаточно индивидуальном ее пороге, при котором наступает аменорея. Однако у многих больных менструации прекращаются в самом начале заболевания, когда масса тела еще не изменена. Более того, при восстановлении последней менструальная функция может долго оставаться нарушенной. У больных с булимией аменорея чаще возникает без выраженного дефицита массы тела. Все это позволяет думать о первичности гипоталамических нарушений. При восстановлении массы тела важно добиться нормализации коэффициента жировая ткань/масса тела, обеспечивающего нормальный метаболизм эстрогенов. ’
При исследовании гонадотропной секреции выявлено снижение циркулирующих гипофизарных и овариальных гормонов. При введении больным ЛРГ (люлиберина) отмечается сниженный по сравнению со здоровыми выброс ЛГ и ФСГ. Восстановление чувствительности к экзогенному ГнРГ на фоне нормализации массы тела подтверждает центральный генез аменореи. У больных нервной анорексией с выраженным дефицитом массы тела секреция гонадотропинов аналогична таковой у девочек пубертатного возраста. При полном восстановлении массы тела суточный ритм секреции этих гормонов налаживается.
Полагают, что звеном, обеспечивающим связь контроля потребления пищи с секрецией ГнРГ, является гипоталамический нейропептид Y. В ответ на пищевую депривацию уровень нейропептида Y в цереброспинальной жидкости возрастает. Клетки, продуцирующие нейропептид Y, располагаются в области аркуатного ядра гипоталамуса. Этот пептид стимулирует пищевое поведение и одновременно регулирует гонадотропную функцию гипофиза (преимущественно за счет подавления импульсной секреции ГнРГ).
При нервной анорексии обнаружены повышение уровня тестостерона и снижение содержания эстрадиола в сыворотке, что связано с изменением функции ферментных систем синтеза и метаболизма этих стероидов в тканях.
Концентрации свободного и общего Т4 в сыворотке больных нормальные, однако уровень тестостерона при выраженном дефиците массы тела снижается, а содержание ТТГ не меняется, что указывает на парадоксальную резистентность гипофиза к снижению уровня Т3. Вместе с тем взаимоотношения между гипоталамусом и гипофизом сохраняются, о чем свидетельствует нормальная реакция ТТГ на экзогенный ТРГ. Снижение концентрации тестостерона связано с изменением периферической конверсии Т4 в тестостероне и расценивается как компенсаторная реакция, способствующая сохранению энергии в условиях истощения.
У больных нервной анорексией содержание кортизола в сыворотке повышено, но реакция АКТГ на КРГ оказывается существенно менее выраженной, чем в норме, хотя базальная концентрация АКТГ в сыворотке остается нормальной. Важно отметить, что изменение ритма секреции кортизола и отсутствие подавления при проведении пробы с дексаметазоном, характерные для нервной анорексии, наблюдаются и при некоторых психических нарушениях, не сопровождающихся дефицитом массы тела.
У больных, отказывающихся от приема пищи, отмечается хроническая гипогликемия. Описано развитие гипогликемической комы у таких больных. Нервная анорексия у больных ИЗСД является причиной необъяснимой лабильности течения сахарного диабета.
При высоком уровне НЬА1с у молодых пациенток с ИЗСД с исключенными другими признаками декомпенсации углеводного обмена необходимо исследование особенностей пищевого поведения для исключения нервной анорексии.
Уровень СТГ при тяжелом состоянии больных и значительном дефиците массы тела повышен. Отмечается его парадоксальная реакция на введение глюкозы.
Выраженная тенденция к хронизации заболевания (более 50 % случаев) и длительный период аменореи обусловливают у больных с нервной анорексией развитие остеопороза. Так, у лиц со средней массой тела 43,6 кг и ИМТ менее 20 кг/м2 обнаружено резкое снижение плотности костной ткани. Остеопороз у таких больных нередко остается невыявленным. На фоне терапии эстрогенами у женщин с хроническим течением нервной анорексии потеря костной массы продолжает прогрессировать. Восстановление массы тела ведет к нормализации плотности костей.
Уже на ранних этапах заболевания меняется состояние ферментных систем печени. Нарушается функция почек: снижаются минутный диурез, клиренс эндогенного креатинина, экскреция электролитов с мочой. Эти сдвиги имеют, по-видимому, адаптивный характер.
У больных с разными формами нервной анорексии отмечаются падение уровня калия в плазме и клетках, внутриклеточный ацидоз (хотя при рвоте может наблюдаться и алкалоз). Внезапную смерть больных нервной анорексией связывают именно с электролитными нарушениями. Объем циркулирующей крови уменьшается, однако при расчете на 1 кг массы тела отмечается гиперволемия, что требует особой осторожности при назначении таким больным внутривенных инфузий. Неадекватная инфузионная терапия может приводить к смертельному исходу.
Клиническая картина. Выделяют несколько периодов заболевания — инициальный, аноректический, кахектический и этап редукции нервной анорексии. Первый период — формирование дисморфомании (недовольство внешностью, стремление к коррекции фигуры). Второй период (аноректический) заканчивается потерей 25—50 % массы тела. В этом периоде отмечается широкая клиническая симптоматика: вторичные соматические нарушения, изменения в эндокринной системе. Больные скрывают свое состояние, утверждают, что у них нет аппетита. Однако при психологическом Обследовании выявляется высокая пищевая потребность. Истинная анорексия отсутствует. Больные сознательно ограничивают прием пищи, используют интенсивные физические нагрузки. Более половины больных не выдерживают чувства голода, но после еды вызывают у себя искусственную рвоту, которая быстро перестает вызывать неприятные вегетативные симптомы. После рвоты или промывания желудка большим количеством воды возникает чувство легкости, удовольствия от “очищенности”. Больные часто прибегают к приему мочегонных и слабительных средств. Практически во всех случаях на этом этапе возникает аменорея, появляются брадикардия и гипотензия. На этом фоне сохраняется высокая физическая активность. Отмечаются гипотермия, зябкость, сухость кожи, алопеция, запоры, отеки.
После потери более 50 % исходной массы тела развивается кахектический этап. Больные полностью утрачивают критическое отношение к своему состоянию: подкожная жировая клетчатка отсутствует, отмечаются гипертрихоз, сухость кожи, отеки, трофические изменения, брадикардия, гипотензия, выраженные нарушения электролитного баланса. Это состояние без терапевтического вмешательства приводит к смерти.
При КТ- и MPT-исследовании выявляются морфологические изменения в ЦНС, которые могут быть обратимыми после восстановления массы тела. При позиционной эмиссионной томографии обнаруживается каудальная гиперактивность. При депрессиях, а также при нервной булимии регистрируется ряд межполушарных асимметрий.
Диагноз нервной анорексии чаще всего устанавливается лишь при выраженном дефиците массы тела, поскольку, как уже отмечалось, больные тщательно скрывают свое состояние. Часто такие больные длительно обследуются терапевтами и гастроэнтерологами и даже подвергаются ненужным оперативным вмешательствам. Обычно устанавливают ошибочный диагноз гипофизарной кахексии и назначают заместительную гормональную терапию. Американской Ассоциацией психиатров предложены критерии анорексий, в том числе нервной (DSM-X). К ним относятся: боязнь “потолстеть” (не уменьшается, несмотря на потерю массы тела); нарушение восприятия своего тела (“чувствую себя толстой” — даже при наличии истощения); отказ сохранять массу теЛа выше минимальной нормальной для своего возраста и роста; аменорея.
Больных, которые только ограничивают прием пищи, причисляют к типу I, а тех, которые, кроме того, еще и “очищаются” (вызывают рвоту, принимают слабительные, диуретики), — к типу II.
Критериями булимии являются повторяющиеся эпизоды переедания (быстрое потребление больших количеств пищи) и по крайней мере два из следующих пунктов:
- потребление высококалорийной, легкоусвояемой пищи во время приступов “обжорства” и длительностью до 3 мес (с частотой не менее
- раз в неделю);
- попытки скрыть свою неумеренность в еде во время приступа;
- прекращение еды вследствие появления болей в животе или сознательными приемами (искусственная рвота);
- повторные попытки похудеть за счет строгих диет, искусственной рвоты или приема мочегонных средств;
- частые “перепады” массы тела на 4 кг и более;
- понимание ненормальности своей страсти к еде и боязнь невозможности добровольного прекращения потребления пищи.
Если одновременно присутствуют критерии нервной анорексии, устанавливают оба диагноза.
Представленные схемы не полностью отражают особенности больных и не учитывают тяжести соматоэндокринных нарушений и характеристик особенностей личности.
Дифференциальный диагноз. После исключения соматической патологии эндокринологу нужно дифференцировать нервную анорексию от болезни Симмондса и надпочечниковой недостаточности. Это состояние приходиться дифференцировать также от невроза, шизофрении с аноректическим синдромом, депрессий.
Лечение, Больные нуждаются в длительном лечении у психиатра. Особое внимание уделяется выведению больного из состояния кахексии. Необходима обязательная госпитализация в психиатрический стационар: наазор за адекватным питанием, изоляция от семьи. Наилучший эффект дает адекватное энтеральное питание элементными смесями. Следующий этап — специфическая терапия психотропными средствами, а затем — психосоциальная адаптация.
По нашим данным, у 30—40 % больных не происходит восстановления менструальной функции после нормализации массы тела и ее стабилизации в течение 5—6 мес на фоне отмены психотропных препаратов. Это требует консультаций гинеколога-эндокринолога. Соответствующую группу составляют больные с поздним появлением менструаций, их высоким “весовым порогом”, началом заболевания в допубертатном периоде и длительным его течением.
Прогноз не вполне удовлетворительный. По данным разных авторов, частота смертельных исходов колеблется от 2—3 до 16—20 %. Среди причин смерти — инфекции, сепсис, некроз кишечника и др.
Описанный в литературе случай субэндокардиального инфаркта миокарда у 20-летней женщины с нервной булимией, которая с суицидальной целью ввела себе 20 г кофеина, подчеркивает широту возможных последствий и медицинских проблем, возникающих при этих состояниях.
При длительном наблюдении за такими больными (в среднем 5—6 лет) установлено, что нервная анорексия или булимия сохраняются в 38—56 % случаев. Выздоровление наблюдается главным образом через 6—12 лет после начала заболевания. Опыт 10-летнего наблюдения за больными нервной анорексией показывает, что смертность составила 6,6 %. Полное излечение наблюдалось лишь у 64 % больных. Более чем в половине случаев развивался булимический вариант пищевого поведения.
Несмотря на большое количество исследований, посвященных этим состояниям, в настоящее время не существует адекватных методов их лечения. Это лишь подчеркивает необходимость раннего распознавания и коррекции психологических проблем на этапе отсутствия выраженных эндокринных и соматических проявлений болезни.
ЛИТЕРАТУРА
Алгоритмы диагностики и лечения болезней эндокринной системы/Под ред.акад. У И.И.Дедова. — М., 1995. — 256 с.
Бсиюболкин М.И. Эндокринология. — М., 1998. — 581 с.
Вакс ВВ., Марова Е.И., Гончаров Н.П. и др. Клинические, морфологические и гормональные особенности “неактивных” аденом гипофиза/Хирургия эндокринных желез. — СПб., 1995. — С. 28—35.
Дедов И.И., Мельниченко ГА. Персистируюшая галакторея-аменорея. — М.: Медицина, 1985. — 253 с.
Диагностика и лечение соматотропной недостаточности у детей (методические ре- комендации)/Под ред.И.И.Дедова. — М., 1995.
Клиническая эндокринология/Под ред.Н.Т.Старковой. — М.: Медицина, 1991. — 512 с.
Марова Е.И. Болезнь Иценко — Кушинга (патогенез, клиника, диагностика, лечение): Дисс. ... д-ра мед. наук. — М., 1992.
Почечная эндокринология: Пер. с англ./Под ред.М.Дж.Данна. — М.: Медицина, 1987. - 672 с.
Эндокринология и метаболизм: Пер. с англ./Под ред.Ф.Фелига, Дж.Д.Бакстера, А.Е.Бродуса, Л.А.Фромена. — М.: Медицина, 1985. — 520 с.
A clinical problem: microprolactinoma. Diagnosis and treatment/ Ed. G.M. Molinatti//Pro- ceedings of an international Workshop.—Saint Vincent, Italy. — 1982. — 22 April.
Asa S.L., Kovacs K. Clinically non-functioning human pituitary adenomas//Can.J. Neurol.Sci. - 1992. - Vol. 14. - Bd 19. -P.228-235.
Bengtsson S. The consequences of growth hormone deficiency in adults//Acta Endocri- nolo.-1993.-Vol. 128 (Suppl.2).-P.2-5.
Bjerre P. The empty sella. A reappraisal of etiology and pathogenesis//Acta-neurol.-scand.— 1990.—Bd 130 (Suppl.).—P.l—25.
Colao A., A di Sarno. Samacchiario Prolactinomas Resistent to Standard Dopamine Agonists Respond to Chronic Cabergoline Treatment//J.clin.Endocr.Metab.— 1997.— Vol.82(3).—P.876—883.
Faglia G., Ambrosi B. Functionless pituitary tumours/Clinical Endocrinology edited $y A. Grossman.—Oxford, 1992.—P. 169—176.
Greenman Y, Melmed S. Diagnosis and management of nonfunctioning pituitary tumors// Ann.Rev.Med.—1996,—Vol.47.-P.95—106.
Harris A. Acromegaly and its management.—USA: Lippincott-Raven Publishers.—1996.— P. 175.
Hartman D. Anorexia nervosa-diagnosis, aetology and treatment Postgrad//Med. S.—1995.— Vol.71.—issue 841.—P.712—716.
Herder W.W., Lamberts S.W.J. Advances in the diagnosis and treatment of Cushing’s// Clin.Endocr.and Metab.-1995.-Vol.9.-N 2.-P.315—336.
Melmed S. Pituitari neoplasia//Amer.J.Endocr.Metab.Clin.North.—1994.—Vol.23(1).— P.81—92.
Speroff L., Class Robert U., Kase N. Clinical Gynecology, Endocrinology and Infertility: fifth Edition. William and Wilkins, 1995.
Wajchenberg B., Mendonca B., Liberman B. et a/.//Endocr.Rev.— 1994.—Vol. 15,—N 6 — P.752—787.
А так же в разделе « 2.10. Синдром “пустого” турецкого седла »
- Гормоны гипоталамуса
- Гормоны передней доли гипофиза
- Нейроамины
- Болезнь Иценко — Кушинга
- Синдром гиперпролактинемии
- Акромегалия и гигантизм
- Гипофизарный нанизм
- J. Антропометрия
- Рентгенологическое исследование
- Гормональная диагностика дефицита СТГ
- Недостаточность СТГ у взрослых
- Несахарный диабет
- 2.7.1. Причины возникновения несахарного диабета центрального генеза
- Гормонально-неактивные опухоли гипофиза
- Пангипопитуитаризм