ГЕМОПОЭЗ
Гемопоэз — процесс кроветворения (образование клеток крови), происходящий в кроветворной ткани. У взрослого человека гемопоэз происходит в костном мозге костей черепа, рёбер, грудины, позвонков, костей таза, эпифизов длинных костей. В пренатальном периоде гемопоэз последовательно происходит в нескольких развивающихся органах.
А. Пренатальный гемопоэз
- Первичная (мезобластическая) стадия. В течение 3-й недели развития во внезародышевой мезодерме желточного мешка формируются скопления мезенхимных клеток — кровяные островки (рис. 6-12, 6-13). Клетки по периферии каждого островка формируют
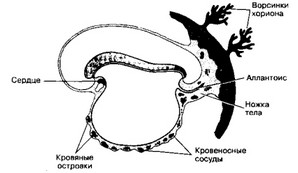
Рис. 6-12. Эмбриональный гемопоэз. 19-дневный эмбрион. В конце 3-й недели кровяные островки присутствуют в стенке желточного мешка, а также во внезародышевой мезодерме ворсинок хориона и ножке тела. Островки дают начало первичным клеткам крови и кровеносным сосудам. В дальнейшем (благодаря объединению сосудов эмбриона и внеэмбриональных сосудов) устанавливается связь зародыша с плацентой [из Sadler TW, 1990]
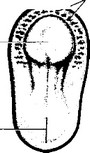 Кровяные островки
Кровяные островки
Рис. 6-13. Эмбриональный гемопоэз. 3-недельный зародыш (вид сверху). В передней части зародышевого диска появляются кровяные островки, видимые сквозь слои эктодермы и соматической мезодермы [из Sadler TW, 1990]
эндотелий первичных кровеносных сосудов. В ходе мегалобластического эритропоэза клетки центральной части островка образуют первые клетки крови — первичные эрит- робласты (рис. 6-14) — крупные клетки, содержащие ядро и эмбриональные Hb (Hb Gower-1, Hb Gower-2, см. главу 4 II Б I г (I) (б)). Лейкоцитов и тромбоцитов на этой стадии нет. На 12-й неделе кроветворение в желточном мешке заканчивается.
- Гепатоспленотимическая стадия. В течение второго месяца развития стволовые клетки крови заселяют печень, селезёнку и тимус, и в этих органах образуются разные типы клеток крови.
а. Печень. В печени кроветворение начинается на 5-6 неделе развития. Здесь образуются гранулоциты, тромбоциты и как дефинитивные эритробласты (ядросодержащие клетки), так и эритроциты (безъядерные клетки). К концу 5-го месяца интенсивность гемопоэза в печени уменьшается, но в небольшой степени продолжается ещё несколько недель после рождения.
б. Селезёнка. Гемопоэз в селезёнке наиболее выражен с 4 по 8 месяц внутриутробного развития. Здесь образуются эритроциты и небольшое количество гранулоцитов и тромбоцитов. Непосредственно перед рождением важнейшей функцией селезёнки становится образование лимфоцитов.
в. Тимус. В вилочковой железе образуются лимфоциты (различные типы Т-клеток).
- Костномозговое кроветворение. В течение 5-го месяца развития гемопоэз начинается в костном мозге, где образуются все типы клеток крови. Дополнительное количество лимфоцитов формируется в лимфоидных органах (тимус, лимфатические узлы, селезёнка). Перед рождением лимфатические узлы могут также продуцировать эритроциты. К моменту рождения, после рождения и у взрослого кроветворение ограничивается костным мозгом и лимфоидной тканью. Когда костный мозг не в состоянии удовлетворить повышенный и длительный запрос на образование клеток крови, гемопоэтическая активность печени, селезёнки и лимфатических узлов может восстановиться (экстра- медуллярный гемопоэз).
Костный мозг. После рождения и до полового созревания количество очагов кроветворения в костном мозге уменьшается, хотя костный мозг полностью сохраняет гемопо- этический потенциал.
- Жёлтый костный мозг. У взрослых большая часть костного мозга становится неактивной; в связи с преобладанием в нём жировых клеток его назвали жёлтым.
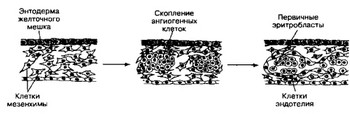
Рис. 6-14. Дифференцировка клеток кровяного островка. Кровяной островок — скопление недифференцированных мезенхимных клеток. Центральные клетки островка дифференцируются в первичные эритробласты. Клетки, расположенные по периферии, дают начало эндотелию первичных кровеносных сосудов. Эндотелиальные клетки пролиферируют и образуют отростки, в результате чего отдельные островки объединяются, и формируются первые мелкие сосуды [из Sadler TW, 1990]
Жёлтый костный мозг, однако, может восстановить свою активность, если необходимо усилить гемопоэз (например, при хронической гипоксии или выраженных кровотечениях).
- Красный костный мозг (рис. 6-15). Здесь преобладают созревающие эритроциты, что придаёт костномозговым очагам гемопоэза красный цвет.
(а) Структура. Строма костного мозга состоит из ретикулярных клеток с длинными отростками, ретикулиновых волокон, синусоидных капилляров (глава 10 А 3 в (3)); здесь же расположены макрофаги и жировые клетки. Ламинин и фибронектин связывают гемопоэтические клетки с элементами стромы. Протеогликаны могут связывать факторы роста и другие модуляторы гемопоэза. (0 Ретикулиновые волокна вместе с отростками ретикулярных клеток формируют трёхмерную сеть и образуют полости, заполненные островками гемопоэ- тических клеток.
- Синусоидные капилляры. Через щели, расположенные между эндотелиальными клетками и в базальной мембране, зрелые клетки крови попадают в кровоток.
- Макрофаги расположены в непосредственной близости от синусоидов и образуют длинные отростки, проникающие между клетками эндотелия в просвет сосудов.
- Жировые клетки составляют почти половину объёма костного мозга.
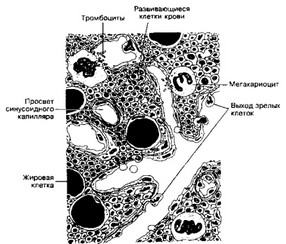
Рис. 6-15. Красный костный мозг. Основу составляют ретикулярные клетки с длинными отростками и ретикулиновые волокна. В пространствах между ними располагаются островки гемопоэтических клеток. Костный мозг пронизан синусоидными капиллярами. К эндотелию капилляров примыкают макрофаги, образующие длинные отростки. В большом количестве присутствуют жировые клетки [из Junqueira LC, Cameiro J, 19911
(б) Функция. Помимо кроветворения, в костном мозге, как в селезёнке и печени, происходит удаление из кровотока старых и дефектных клеток крови. Костный мозг играет центральную роль в иммунной системе, т.к. в нём образуются В-лимфоциты, а также присутствует большое количество плазматических клеток, синтезирующих AT.
Б. Постнатальный гемопоэз. Унитарная теория кроветворения предусматривает, что родоначальница всех форменных элементов крови — стволовая кроветворная клетка. Она медленно размножается и дифференцируется в несколько различных типов коммитированных клеток, дифференцирующихся в отдельные линии — эритроциты, гранулоциты, лимфоциты, моноциты и тромбоциты. Коммитированные клетки интенсивно делятся, и образуются предшественники зрелых клеточных типов. Пролиферативную активность стволовых клеток модулируют колониестимулирующие факторы и интерлейкины (особенно ИЛ-3).
- Дифферон (рис. 6-16). В гемопоэзе участвуют стволовая кроветворная клетка, коммитированные унипотентные клетки и клетки-предшественницы.
а. Стволовая кроветворная клетка — клетка мезенхимного происхождения, способная к повторным делениям и дифференцировке в различные зрелые клетки крови. Такая клетка была названа CFU-S — колониеобразующая единица селезёнки. Часть CFU-S циркулирует в крови и имеет сходство с малыми лимфоцитами. В культуре костного мозга человека выявлена клетка, весьма сходная с CFU-S, названная CFU-blast. Стволовая кроветворная клетка делится редко. Её потомки — полипо- тентные клетки-предшественницы лимфоцитопоэза (CFU-Ly) и миелопоэ- за (CFU-GEMM). В результате деления CFU-Ly и CFU-GEMM их потомки остаются полипотентными или дифференцируются в один из нескольких типов коммитированных унипотентных стволовых клеток, также способных делиться, но дифференцирующихся только в одном направлении.
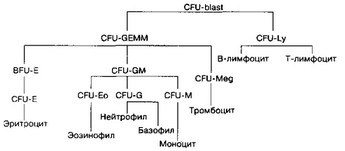
Рис. 6-16. Схема гемопоэза. CFU-blast — стволовая кроветворная клетка; CFU-GEMM — полипо- тентная клетка-предшественница миелопоэза; CFU-Ly — полипотентная клетка-предшественница лимфоцитопоэза; CFU-GM — полипотентная клетка-предшественница гранулоцитов и моноцитов; CFU-G — полипотентная клетка-предшественница нейтрофилов и базофилов. Унипотентные предшественники: BFU-E и CFU-E — эритроцитов; CFU-Eo — эозинофилов; CFU-M — моноцитов; CFU Meg — мегакариоцитов
Свойства. Стволовая кроветворная клетка дифференцируется в различные клеточные типы. Она выходит в кровоток и циркулирует в крови. Для стволовых клеток характерно морфологическое сходство с малыми лимфоцитами и способность к самообновлению.
б. Унипотентные коммитированные клетки имеют ограниченные потенции, комми- тированы к дифференцировке в один клеточный тип, пролиферируют и в присутствии факторов роста дифференцируются в клетки-предшественницы. Унипотентные клетки морфологически не отличаются от стволовых клеток. Программирование клетки на определённый путь дифференцировки (коммитирование), по-видимому, происходит случайным образом.
в. Клетки-предшественницы — клетки одной линии, отличающиеся морфологически и образующиеся последовательно в каждой линии, начинающейся с коммитиро- ванной унипотентной клетки и завершающейся формированием зрелой клетки крови.
- Эритропоэз (рис. 6-17). Начало эритроидного ряда — взрывообразующая единица эритро- поэза (BFU-E), происходящая из CFU-blast’a. Из BFU-E формируется унипотентный предшественник эритроцитов (CFU-E). На дальнейших стадиях эритропоэза дифференцируются проэритробласты, эритробласты, ретикулоциты и эритроциты. Длительность эритропоэза
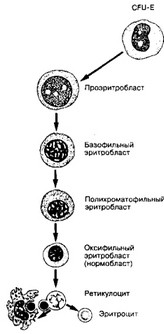

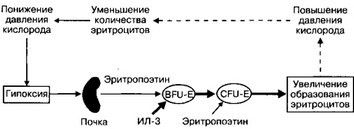
Рис. 6-18. Регуляция эритропоэза. Взрывообразующую единицу эритропоэза (BFU-E) стимулирует ИЛ-3. Из BFU-E образуется CFU-E — унипотентный предшественник эритроцитов, чувствительный к эритропоэтину. Решающий стимул для образования эритроцитов — гипоксия, запускающая синтез эритропоэтина в почке. Эритропоэтин выходит в кровь и поступает в костный мозг, где стимулирует размножение и дифференцировку унипотентного предшественника эритроцитов (CFU-E) и дифферен- цировку клеток эритроидного ряда. В результате количество эритроцитов в крови увеличивается. Соответственно возрастает количество кислорода, поступающего в почку, что тормозит образование эритропоэтина [из Besa ЕС et al, 19921
(от стволовой клетки до эритроцита) — 2 недели. Интенсивность эритропоэза контролирует
эритропоэтин. Основной стимул для выработки эритропоэтина — гипоксия (рис. 6-18).
а. BFU-E и CFU-E. Отличия взрывообразующей единицы эритропоэза (BFU-E) от унипотентного предшественника эритроцитов (CFU-E) состоят в том, что первые реагируют на ИЛ-3, но нечувствительны к эритропоэтину, тогда как пролиферация и дифференцировка CFU-E зависят от эритропоэтина. От клеток в состоянии терминальной дифференцировки BFU-E отделена 12 делениями, а от стадии CFU-E до зрелых клеток проходит 6 или меньше делений.
б. Проэритробласты (рис. 6-17) — первые морфологически опознаваемые предшественники эритроцитов — крупные клетки (диаметр 14-19 мкм) с многочисленными органеллами, но без Hb. Бледное ядро расположено центрально. Объём цитоплазмы невелик и составляет около 20% общего объёма клетки; в ней присутствует довольно много полирибосом, чем обусловлена базофилия клетки. Проэритробласты подвергаются многократным митозам.
в. Эритробласты. На дальнейших стадиях дифференцировки происходят уменьшение размера клетки, конденсация хроматина и уменьшение диаметра ядра, прогрессирующая потеря органелл и РНК, постепенное увеличение содержания Hb1 элиминация ядра. Последовательно различают эритробласты базофильные, полихроматофильные, оксифильные (нормобласты).
- Базофильный эритробласт несколько меньше (диаметр 13-16 мкм) проэрит- робласта, содержит ядро с более плотным хроматином. Цитоплазма более базо- фильна; около ядра часто виден клеточный центр. Клетка сохраняет способность к митозу и активно синтезирует Hb.
- Полихроматофильный эритробласт — клетка диаметром 12-15 мкм, содержит значительное количество Hb. Серый тон цитоплазмы обусловлен базофиль- ным окрашиванием рибосом и оксифильным окрашиванием Hb. Размеры ядра уменьшаются. Клетки продолжают синтезировать Hb и могут делиться.
- Нормобласт (оксифильный эритробласт) имеет небольшие размеры (диаметр 8- 10 мкм) и ацидофильную цитоплазму со следами базофилии. Ядро небольшое, содержит конденсированный хроматин. Ранние нормобласты, по-видимому, ещё могут делиться; на этой стадии эритроидные клетки постепенно утрачивают способность к делению и выталкивают пикнотическое (дегенерирующее) ядро.
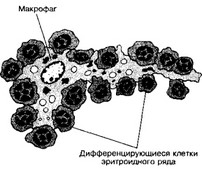
- Островки эритробластов (рис. 6-19). В костном мозге выделяют отдельные структурные единицы эритропоэза — т.н. островки эритробластов. Островок состоит из одного-двух макрофагов, окружённых предшественниками эритроцитов. Макрофаг образует длинные отростки, на поверхности которых расположены делящиеся эритроидные клетки. По мере дифференцировки эритроидная клетка мигрирует к концу отростка макрофага, а следом за ней перемещаются менее дифференцированные клетки. Далее эритробласт вступает в контакт с эндотелием ближайшего синуса, проходит через его стенку и попадает в общий кровоток. Ядро при этом выталкивается и фагоцитируется макрофагами.
г. Ретикулоциты содержат остатки рибосом и РНК, формирующие сетеподобные структуры голубого цвета при суправитальном окрашивании. Ретикулоциты выходят в кровоток и составляют до 1% общего числа циркулирующих эритроцитов. После выхода в кровоток в течение первых 24-48 часов ретикулоцит завершает созревание и становится эритроцитом. При этом клетка приобретает форму двояковогнутого диска, а последние сохранившиеся органеллы разрушаются ферментами.
-
 Гранулоцитопоэз (рис. 6-20). Гранулоциты образуются в костном мозге. Нейтрофилы и базофилы происходят из полипотентной клетки-предшественницы нейтрофилов и базофилов (CFU-G), а эозинофилы — из унипотентного предшественника эозинофилов (CFU-Eo). CFU-G и CFU-Eo — потомки полипотентной клетки-предшественницы гранулоцитов и моноцитов (CFU-GM). По мере дифференцировки размеры клеток уменьшаются, хроматин конденсируется, изменяется форма ядра, в цитоплазме накапливаются гранулы. При развитии гранулоцита можно выделить 6 морфологически различимых стадий: миелоб- ласт, промиелоцит, миелоцит, метамиелоцит, палочкоядерный и сегментоядерный гранулоциты. Специфические гранулы появляются на стадии миелоцитов; с этого момента клетки называют в соответствии с типом образующихся из них зрелых гранулоцитов. Клеточные деления прекращаются на стадии метамиелоцита.
Гранулоцитопоэз (рис. 6-20). Гранулоциты образуются в костном мозге. Нейтрофилы и базофилы происходят из полипотентной клетки-предшественницы нейтрофилов и базофилов (CFU-G), а эозинофилы — из унипотентного предшественника эозинофилов (CFU-Eo). CFU-G и CFU-Eo — потомки полипотентной клетки-предшественницы гранулоцитов и моноцитов (CFU-GM). По мере дифференцировки размеры клеток уменьшаются, хроматин конденсируется, изменяется форма ядра, в цитоплазме накапливаются гранулы. При развитии гранулоцита можно выделить 6 морфологически различимых стадий: миелоб- ласт, промиелоцит, миелоцит, метамиелоцит, палочкоядерный и сегментоядерный гранулоциты. Специфические гранулы появляются на стадии миелоцитов; с этого момента клетки называют в соответствии с типом образующихся из них зрелых гранулоцитов. Клеточные деления прекращаются на стадии метамиелоцита.
Рис. 6-19. Эритробластный островок в костном мозге. Островок образован макрофагом и прилежащими к нему дифференцирующимися эритроидными клетками. Последние располагаются между отростками макрофага [из Bessis U et al, 1978]
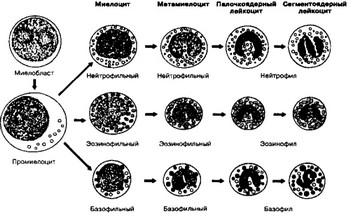
Рис. 6-20. Гранулоцитопоэз. В ходе дифференцировки предшественников гранулоцитов выделяют: миелобласт, промиелоцит, миелоцит, метамиелоцит, палочкоядерный и сегментоядерный гранулоци- ты. По мере дифференцировки уменьшаются размеры клетки, появляются гранулы в цитоплазме, уплотняется ядро и изменяется его форма (от округлой к сегментированной) (из Gartner LP, 1993]
а. Миелобласт образуется на самой ранней стадии гранулоцитопоэза. Это малодифференцированная клетка диаметром около 15 мкм. Миелобласты содержат крупное округлое ядро и 1-3 ядрышка. Цитоплазма лишена гранул и более базофильна, чем у их колониеобразующих единиц.
б. Промиелоцит. Миелобласты дают начало промиелоцитам — крупным клеткам (15-24 мкм), содержащим более конденсированный хроматин. Округлое ядро расположено эксцентрично. Цитоплазма базофильнее и содержит азурофильные гранулы. По мере деления и созревания клеток количество азурофильных гранул уменьшается.
в. Миелоцит. Размеры клетки меньше (10-16 мкм), появляется значительное количество специфических гранул, что позволяет различить 3 типа миелоцитов: нейтрофиль- ный, эозинофильный и базофильный. Образование и накопление гранул продолжаются в течение последующих трёх клеточных делений. Ядро постепенно приобретает бобовидную форму, хроматин становится конденсированнее.
г. Метамиелоцит. В результате делений миелоцитов образуются нейтрофильный, эозинофильный и базофильный метамиелоциты. Размеры этих клеток ещё меньше (10-12 мкм); содержание специфических гранул больше, чем на предыдущей стадии. В ядре появляются глубокие вырезки, хроматин ещё более конденсирован. Способность к митозу утрачивается.
д. Палочкоядерный гранулоцит. Метамиелоциты дифференцируются в палочкоядерные гранулоциты — клетки, непосредственно предшествующие зрелым формам. Их размер составляет 10-12 мкм, ядро имеет подковообразную форму. Эти клетки уже могут выходить в кровоток и составляют 3-5% общего количества циркулирующих лейкоцитов.
е. Сегментоядерный гранулоцит. Палочкоядерные гранулоциты дифференцируются в зрелые формы — сегментоядерные. По мере дифференцировки ядро сегментируется и содержит плотный хроматин.
- Моноцитопоэз. Моноциты и гранулоциты имеют общую клетку-предшественницу — колониеобразующую единицу гранулоцитов и моноцитов (CFU-GM), образующуюся из полипо- тентной клетки-предшественницы миелопоэза (CFU-GEMM). При развитии моноцитов выделяют две стадии — монобласт и промоноцит. До достижения стадии зрелого моноцита клетки проходят три деления. Постепенно уменьшается размер клеток, и появляется углубление в ядре. Все зрелые моноциты покидают костный мозг вскоре после формирования. Примерно двое суток моноциты находятся в кровотоке, а затем мигрируют в ткани.
- Тромбецитопоэз. Тромбоцитам дают начало самые крупные (30-100 мкм) клетки костного мозга — мегакариоциты.
 а. Мегакариобласт — предшественник мегакариоцита. Эта клетка — потомок унипотент- ной клетки-предшественницы мегакариоцитов (CFU-Meg), берущей начало от полипотен- тной клетки-предшественницы миелопоэза (CFU-GEMM).
а. Мегакариобласт — предшественник мегакариоцита. Эта клетка — потомок унипотент- ной клетки-предшественницы мегакариоцитов (CFU-Meg), берущей начало от полипотен- тной клетки-предшественницы миелопоэза (CFU-GEMM).
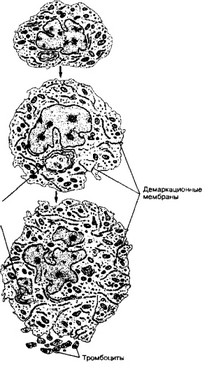
б. Мегакариоцит (рис. 6-21). Из ме- гакариобласта образуется очень крупная клетка с полиплоидным
Рис. 6-21. Дифференцировка мегакариоцита. По мере созревания мегакариоцит увеличивается в размерах, ядро становится дольчатым. Образуется развитая система демаркационных мембран, по которым происходит отделение тромбоцитов [из Hees Н, Sinowatz F, 1992]
и дольчатым ядром — мегакариоцит. В цитоплазме мегакариоцита появляются небольшие базофильные гранулы. В дальнейшем формируются везикулы и демаркационные мембраны; количество свободных рибосом и выраженность гранулярной эндоплазматической сети уменьшаются. В цитоплазме зрелого мегакариоцита различают три зоны: перинуклеарную, промежуточную и наружную. Тромбоциты формируются путём фрагментации цитоплазмы мегакариоцита. В костном мозге мегакариоцит образует протромбоцитарную псевдоподию, проникающую через стенку синуса в его просвет (рис. 6-22).
- Перинуклеарная зона содержит комплекс Гольджи, гладкую и гранулярную эндоплазматическую сеть, гранулы, центриоли и трубочки. Эта зона остаётся связанной с ядром после отделения тромбоцитов.
- Промежуточная зона содержит развитую систему взаимосвязанных пузырьков и трубочек (демаркационная мембранная система), переходящую в клеточную мембрану и выполняющую разграничительную функцию при формировании тромбоцитарных полей.
- Наружная (краевая) зона содержит элементы цитоскелета и пересекается мембранами, связанными с системой демаркационных мембран.
- Лимфоцитопоэз Из стволовой кроветворной клетки (CFU-blast) происходит полипотентная клетка-предшественница лимфоцитопоэза (CFU-Ly). В-лимфоциты образуются в костном мозге, созревание Т-лимфоцитов происходит в тимусе. При образовании лимфоцитов выделяют две стадии — лимфобласт и пролимфоцит. Лимфобласт намного крупнее зрелого лимфоцита. Главная особенность лимфоцитопоэза — постепенное и значительное уменьшение клеточного объёма. Однако, многие циркулирующие лимфоциты реагируют на антигенную стимуляцию увеличением объёма клетки, приобретая морфологию лимфобласта. В отличие от других клеток крови, лимфоциты могут пролифериро-
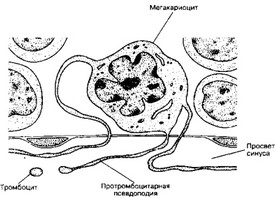
Рис. 6-22. Образование тромбоцитов. Находящийся в костном мозге мегакариоцит образует протромбоцитарную псевдоподию. Последняя проникает сквозь стенку синуса в его просвет. От псевдоподии отделяются тромбоциты и поступают в кровоток [из Kessel RG, Kardon RH, 1979]
зать и вне костного мозга. Это происходит в тканях иммунной системы в ответ на стимуляцию.
В. Факторы гемопоэза. Образование клеток крови стимулируют гемопоэтические факторы роста. На кроветворение влияют фолиевая кислота и витамин B12. Дифференци- ровку кроветворных клеток контролируют факторы транскрипции.
- Гемопоэтические факторы роста (рис. 6-23) — фактор стволовых клеток (SCF)1 колониестимулирующие факторы (CSF)1 интерлейкины, эритропоэтин, тромбоцитопоэ- тин. Колониестимулирующий фактор гранулоцитов и макрофагов (GM-CSF), колониестимулирующий фактор гранулоцитов (G-CSF) и колониестимулирующий фактор макрофагов (M-CSF) стимулируют пролиферацию предшественников фагоцитов в костном мозге, а также значительно усиливают бактерицидные и цитотоксические функции зрелых потомков этих клеток. GM-CSF усиливает практически все реакции нейтрофилов (адгезия, фагоцитоз, дегрануляция и т.д.) на такие хемоаттрактанты, как f-Met-Leu-Phe, компонент С5а комплемента, лейкотриен LTB4.
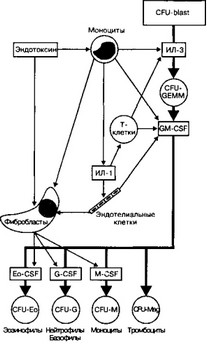

а. Стволовых клеток фактор (SCF) в ходе эмбрионального гемопоэза способствует выживанию, пролиферации и миграции ранних потомков стволовых кроветворных клеток.
б. Колониестимулирующий фактор гранулоцитов и макрофагов (GM-CSF). На образование и пролиферацию фагоцитов (гранулоцитов и моноцитов) влияет по крайней мере 14 цитокинов. Разные CSF, индуцирующие образование фагоцитов, вырабатываются разными клетками мезенхимного происхождения. Наиболее значим GM-CSF, способствующий образованию моноцитов и гранулоцитов. GM-CSF продуцируют моноциты, Т-лимфоциты, фибробласты, клетки эндотелия. GM-CSF влияет на ранние стадии гемопоэза, стимулируя пролиферацию практически всех классов ранних клеток- предшественниц гранулоцитов и макрофагов.
в. Колониестимулирующий фактор гранулоцитов (G-CSF) влияет на полипотен- тную клетку-предшественницу нейтрофилов и базофилов (CFU-G), стимулируя её дифференцировку в унипотентные клетки-предшественницы нейтрофилов и базофилов. G-CSF синтезируют макрофаги и фибробласты.
г. Колониестимулирующий фактор макрофагов (M-CSF) стимулирует полипо- тентную клетку-предшественницу гранулоцитов и моноцитов (CFU-GM) и унипотен- тный предшественник моноцитов (CFU-M) к дифференцировке в моноциты и далее в макрофаги. Оказывает противоопухолевое действие. M-CSF вырабатывают макрофаги и фибробласты.
д. Интерлейкин-3 действует на стволовую кроветворную клетку и полипотентную клетку-предшественницу миелопоэза (CFU-GEMM), на большинство клеток-предшес- твенниц миелоидного ряда, стимулируя формирование эритроцитов, гранулоцитов, моноцитов, тромбоцитов. Вырабатывается Т-лимфоцитами и клетками стромы костного мозга. ИЛ-3 поддерживает размножение практически всех классов ранних клеток- предшественниц.
е. Интерлейкин-5 (наряду с ИЛ-3 и GM-CSF) стимулирует образование эозинофилов.
ж. Интерлейкин-7 способствует образованию T- и В-лимфоцитов, воздействуя на их клетки-предшественницы. Продуцируется клетками стромы костного мозга.
з. Эритропоэтин регулирует эритропоэз, стимулируя пролиферацию и дифференцировку унипотентных предшественников эритроцитов (CFU-E); синтезируется в почке и печени (в антенатальном периоде); интенсивность синтеза зависит от р02 в этих органах.
и. Тромбопоэтин — белковый фактор пролиферации предшественников мегакариоци- тов, их созревания и увеличения количества тромбоцитов; синтезируется главным образом в печени.
- Факторы транскрипции — связывающиеся с ДНК белки различных семейств, функционирующие с ранних стадий развития и регулирующие экспрессию генов кроветворных
клеток.
а. SCL — фактор транскрипции в стволовых кроветворных клетках, предшественниках эритроцитов, мегакариоцитов.
б. NF-E2 — эритроидный фактор транскрипции, активирует транскрипцию а- и р-глоби- нов, ферментов синтеза гема (порфобилиноген дезаминаза и феррохелатаза).
в. Факторы транскрипции GATA — связывающиеся с ДНК белки, узнающие последовательность GATA.
- GATAl поддерживает нормальный эмбриональный и постнатальный гемопоэз, экспрессируется в эритроидных клетках и мегакариоцитах.
- GATA2 экспрессируется кроветворными клетками и играет ключевую роль в регуляции экспрессии гемопоэтических факторов, контролирующих эмбриональный гемопоэз в желточном мешке и печени.
- GATA3 экспрессируют Т-клетки.
г. EKLF влияет на эритропоэз, стимулируя экспрессию гена р-глобина; возможный
переключатель эритропоэза на дефинитивный тип (переключение синтеза с у- на
Р-глобин).
- Фолиевая кислота и витамин В|2. При массовом образовании новых клеток крови
активно синтезируется ДНК. Для этого необходимы витамин B12 и фолиевая кислота.
Фолаты и витамин B12 поступают с пищей и всасываются в тонкой кишке.
а. Витамин B12
- Внутренний фактор. Для всасывания витамина B12 в кишечнике необходим (внутренний) фактор Касла, синтезируемый париетальными клетками желудка. Фактор связывает витамин B12 и защищает его от разрушения ферментами. Комплекс внутреннего фактора с витамином B12 в присутствии ионов Ca2+ взаимодействует с рецепторами эпителиальной клетки дистального отдела подвздошной кишки. При этом витамин B12 поступает в клетку, а внутренний фактор высвобождается. Отсутствие внутреннего фактора приводит к развитию анемии.
- Транспорт витамина B12. Из эпителия кишечника витамин B12 с помощью транскобаламина II переносится в костный мозг (витамин B12 деметилирует фолаты, предотвращая их выход из клеток; участвует в синтезе ДНК) и в печень (для запасания). Транскобаламин II вырабатывают эпителиальные клетки кишечника.
- Дефицит витамина B12. Алиментарный дефицит витамина B12 в развитых странах встречается редко; исключение составляют грудные дети матерей — строгих вегетарианок. Обычная причина дефицита — нарушение процессов всасывания; одна из причин — дифиллоботриоз (гельминтоз, вызванный Diphyllobothrium Iatum [Лентец широкий], эндемичен для некоторых районов России).
б. Фолиевая кислота. Фолаты в качестве кофермента участвуют в синтезе пуриновых
и пиримидиновых оснований.
- Алиментарный дефицит фолиевой кислоты — редкое явление; может развить
ся у грудного ребёнка, вскармливаемого кипячёным или козьим молоком, а также у детей с тяжёлой анорексией.
- Нарушение всасывания фолатов наблюдают при синдроме мальабсорбции (болезнь Крона, целиакия), характеризующемся поражением тонкой кишки.
- Повышенная потребность в фолатах развивается при состояниях, сопровождающихся усилением метаболических процессов (беременность, хронический гемолиз, злокачественные новообразования).
- Нарушения метаболизма фолатов могут вызвать некоторые противосудо- рожные препараты (фенитоин и фенобарбитал).
Источник: Под ред. Э.Г. Улумбекова, Ю.А. Челышева, «Гистология (введение в патологию)» 1997