КЛЕТКИ
Форменные элементы крови — эритроциты, лейкоциты и тромбоциты.
А. Эритроцит — безъядерная клетка. Диаметр 7-8 мкм. Количество эритроцитов: у женщин — 3,9—4,9х1012 в I л, у мужчин — 4,0—5,2х1012/л. Более высокое содержание эритроцитов у мужчин связано со стимулирующим эритропоэз влиянием андрогенов. Продолжительность циркуляции в крови — 120 дней.
- Форма, размеры, включения. Обычно эритроцит имеет форму двояковогнутого диска диаметром 7-8 мкм. Считают, что именно такая конфигурация обеспечивает наибольшую площадь поверхности по отношению к объёму, что важно для газообмена. Разброс
размеров эритроцитов — анизоцитоз, клетки диаметром gt;9 мкм — макроциты, lt;6 мкм — микроциты. При ряде заболеваний крови изменяются размеры и форма эритроцитов.
а. Анизоцитоз — появление эритроцитов аномальных размеров. Причины — дефекты некоторых ферментов в эритроцитах (например, аденозиндезаминазы и 4-гидроксифе- нилпируватгидроксилазы). ,
- Макроцитоз в сочетании с анемией и появлением мегалобластов наблюдают при дефиците фолата и витамина B12, применении некоторых лекарственных средств и при наследственных заболеваниях (например, оротовая ацидурия, синдром Jleiua- Найена). Макроцитоз без появления мегалобластов — признак заболевания печени, наблюдают, например, при злоупотреблении алкоголем, гипотиреоидизме. Лекарственные средства. К появлению макроцитов и развитию мегалобласт-
ной анемии могут привести препараты, применяемые при болезнях злокачественного роста (метотрексат), бактериальных (триметоприм) и паразитарных (пириметамин) инфекциях.
- Микроцитоз. Эритроциты диаметром lt;6 мкм наблюдают при гемоглобинопатиях и талассемии.
б. Пойкилоцитоз
- Сфероцитоз (эллиптоцитоз, овалоцитоз) — присутствие в крови эритроцитов сферической или эллиптической (овальной) формы — сфероцитов. Чаще всего это макроциты. Одна из причин — дефектный спектрин с нарушенной способностью связываться с белком полосы 4.1.
- Стоматоцитоз (см. главу 18, эритроциты патологические).
- Акантоцитоз. Большинство эритроцитов имеет множественные шиповидные выросты. Акантоцитоз возникает, например, при экспрессии дефектного трансмембранного гликопротеина полосы 3.
- Пиропойкилоцитоз. При повышении температуры тела в периферической крови могут появиться эритроциты аномальной формы (при этом найдена, в частности, точечная мутация гена спектрина).
в. Типы патологических эритроцитов (см. главу 18 и табл. 6-3).
г. Патологические включения. Базофильные включения в эритроцитах, тельца Жодй и кольца Кэбота находят в эритроцитах при анемиях (табл. 6-3).
- Плазмолемма и примембранный цитоскелет. Клеточная мембрана эритроцита довольно пластична, что позволяет клетке деформироваться и легко проходить по узким капиллярам (диаметр 3-4 мкм). Главный трансмембранный белок эритроцита — полоса 3. Другой тип интегральных гликопротеинов — гликофорины. Белки цитоскелета обеспечивают поддержание формы эритроцита (двояковогнутый диск), частично конфигурация эритроцита зависит от содержания воды в клетке. Основной белок примембранного цитоскелета — спектрин. С ним соединяется актин, в результате чего формируется сетеподобная структура (рис. 6-2). С комплексом спектрин-актин связан белок полосы 4.1. Анкирин, соединяясь со спектрин-актиновым комплексом, прикрепляет его к мембране через белок полосы 3.
а. Полоса 3 — полифункциональный мембранный гликопротеин, участвует в транспорте анионов Cl" и HCO3' через фосфолипидный бислой, служит главным транспортёром глюкозы. Состоит из двух доменов — трансмембранного с СООН-конца молекулы (контролирует транспорт анионов) и цитоплазматического. Цитоплазматический домен имеет участки связывания со спектрином, Hb и несколькими гликолитически- ми ферментами.
б. Полоса 4.1 взаимодействует со спектрин-актиновым комплексом, стабилизируя его.
в. Спектрин — длинные (около 110 нм) и гибкие нити примембранного цитоскелета, образуют тетрамеры.
Таблица 6-3. Патологические эритроциты в мазке крови (По: Hematology Besa ES et al Eds, Philadelphia, Harwal Publishing, 1992, с.7)
|
Форма |
Характеристика |
Состояние |
|
Акантоциты |
Несколько больших шиповидных выростов |
Абеталипопротеинемия, уремия, ГУС |
|
Эхиноциты (клетки-репьи) |
Много крошечных шиповидных выростов |
Абеталипопротеинемия, цирроз, уремия, ГУС |
|
Кодоциты |
Форма мишени |
HbC или HbE, болезни печени, механическая |
|
(мишеневидные клетки) |
|
желтуха, талассемия, спленэктомия |
|
Дакроциты |
Каплевидная форма |
Миелофиброз, анемия с тельцами Хайнца, талассемия, гемолитическая анемия, миелофтиз |
|
Дрепаноциты |
Серповидная форма |
Серповидно-клеточная анемия, другие гемоглобинопатии |
|
Шизоциты (шистоциты, клетки-шпоры) |
Шлемообразная форма |
ДВС, ТТП, протезы сосудов и клапанов сердца |
|
Сферостоматоциты (сфероциты) |
Сферическая форма |
Наследственный или приобретённый гемолиз |
|
Стоматоциты |
Щелевидный просвет в центре |
Наследственный или приобретённый гемолиз |
|
|
Агрегаты |
|
|
Монетные столбики |
Эритроциты |
Миеломная болезнь, макроглобулинемия |
|
|
располагаются в виде столбика монет |
Вальденстрёма |
|
|
Включения |
|
|
Ядерные эритроциты |
Сморщенное ядро |
Острое кровотечение, тяжёлый гемолиз, миелофиброз, лейкоз, миелофтиз, аспления |
|
Базофильная зернистость |
Ядро в виде |
Отравление свинцом, сидеробластная анемия, |
|
|
пунктирных базофильных точек |
тяжелый гемолиз |
|
Тельца Хауэлла-Жоли |
Небольшие округлые |
Мегалобластная анемия, аспления, |
|
|
включения |
тяжелый гемолиз |
|
Кольца Кэбота |
Включения кольцевидные или в форме цифры 8 |
Тяжёлый гемолиз |
Примечания. ГУС — гемолитнко-уремический синдром, ДВС — диссеминированное внутрисосудистое свёртывание, ТТП — тромботическая тромбоцитопеническая пурпура; синонимы заключены в скобки
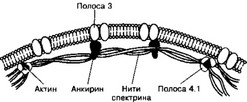
Рис. 6-2. Клеточная мембрана и цитоскелет эритроцита. Полоса 3 — главный трансмембранный белок. Спектрин — основной белок примембранного цитоскелета. С тетрамерами молекул спек- трина соединяются молекулы актина, в итоге формируется сетеподобная структура. С комплексом спешрин-актин, стабилизируя его, связан белок полосы 4.1. Анкирин, соединяясь со спектрин-акти- новым комплексом, связывает его с клеточной мембраной через белок полосы 3 [из Gartner LP, 1993]
г. Анкирин — посредник между трансмембранным белком полосы 3 и тетрамерами спектрина. Удерживает спектрин-актиновый комплекс непосредственно под мембраной.
д. Актин. В составе примембранного цитоскелета прикрепляется к спектрину и связывает его тетрамеры в единую сеть.
е. Гликофорины — мембранные гликопротеины, их полисахаридные цепи содержат Аг-детерминанты (агглютиногены А и В системы групп крови АВО). Аллели гена ABO (9q34) кодируют три полипептида (А, В, 0), два из них (гликозилтрансферазы А и В) модифицируют полисахаридные цепи гликофоринов. AT к агглютиногенам (гемагглю- тинины аи|3) образуются к третьему месяцу жизни.
- Гемоглобин. Практически весь объём полностью лишённой органелл цитоплазмы эритроцита заполнен Hb. Молекула Hb — тетрамер, состоящий из 4 полипептидных цепей глобина, каждая из которых ковалентно связана с одной молекулой гема. Основная функция Hb — перенос O2. Существует несколько типов Hb1 образующихся на разных сроках развития и различающихся строением цепей глобина.
а. Типы гемоглобина (см. также главу 4 II Б I г (I) (б)).
- Эмбриональные Hb появляются у 19-дневного эмбриона, присутствуют в эрит- роидных клетках в первые 3-6 месяцев беременности.
- Фетальный Hb. HbF (а2у2) появляется на 8-36 неделях беременности и составляет 90-95% всего Hb плода. После рождения его количество постепенно снижается и к 8 месяцам составляет 1%.
- Дефинитивные Hb. HbA1 (Ct2JJ2) составляет 96-98% всего Hb. 1,5-3% приходится на HbA2 (а252) и 0,5-1% — на HbF.
б. Формы гемоглобина
- Оксигемоглобин. В лёгких при повышенном р02 Hb присоединяет O2, образуя оксигемоглобин. Для присоединения и отделения O2 необходимо, чтобы атом железа гема был в восстановленном состоянии (Fe2+). При включении в гем трёхвалентного железа образуется метгемоглобин.
- Метгемоглобин — Hb с Fe3*, прочно связывает O2, так что отделение последнего затруднено. Это приводит к нарушениям газообмена в тканях (метгемоглоби- немйя). Образование метгемоглобина в эритроцитах может быть наследственным или приобретённым. В последнем случае это результат воздействия на эритроциты сильных окислителей. К ним относят нитраты и неорганические нитриты, лекарственные препараты (сульфаниламиды) и местные анестетики (лидокаин).
- Карбоксигемоглобин. Hb легче, чем с O2, связывается с окисью углерода CO (угарный газ), образуя карбоксигемоглобин.
- Гликозилированный Hb (см. главу 18).
в. Глобины. Синтез a-цепей глобина кодируют гены хромосомы 16, р-цепей — хромосомы 11. При мутациях (см. главу 4 II Б I г (2) (б)) этих генов нарушается или полностью блокируется образование одной или нескольких цепей глобина, что приводит к развитию анемии.
г. Гем построен из четырёх молекул пиррола, образующих порфириновое кольцо, в центре которого находится атом железа.
- Функции. Гем связывает кислород и высвобождает электроны для ферментов, катализирующих окислительно-восстановительные реакции.
- Патология. Недостаточность ферментов, необходимых для синтеза гема, — причина снижения количества Hb и развития гипохромной анемии. 5-Аминолевулинат дегидратаза. Недостаточность фермента приводит к развитию врождённой порфирии и сидеробластической анемии. При отравлении
свинцом значительно снижается активность этого фермента и развивается порфирия (плюмбопорфирия).
д. Обмен железа. Основное количество железа в организме входит в состав гема (НЬ, миоглобин, цитохромы). Часть железа запасается в виде ферритина (в гепатоцитах, макрофагах костного мозга и селезёнки) и гемосидерина (в клетках фон Купффера и макрофагах костного мозга). Некоторое количество находится в лабильном состоянии в связи с трансферрином. Большая часть железа, необходимого для синтеза гема, извлекается из разрушенных эритроцитов. Только 5% железа для эритропоэза поставляется извне с пищей.
- Источники железа. Железо поступает к клеткам эритроидного ряда из различных источников.
(а) Железо, поступающее с пищей, накапливается в эпителиальных клетках слизистой оболочки тонкой кишки. Отсюда трансферрин переносит железо в красный костный мозг и в печень. Железо поступает в эритробласты, а свободный трансферрин возвращается в плазму.
(б) Железо погибших эритроцитов. При разрушении эритроцитов в селезёнке, печени и костном мозге высвобождаемое из гема железо трансферрин транспортирует в костный мозг, часть железа включается в состав ферритина и гемосидерина.
- Железодефицитная анемия развивается при недостаточном поступлении железа извне. Избыточное накопление железа (ферритина и гемосидерина) в макрофагах, гепатоцитах, кардиомиоцитах, поджелудочной железе (гемохрома- тоз) может вызвать повреждение этих структур.
- Ферменты. Цитоплазма эритроцита содержит ферменты, обеспечивающие выполнение различных функций.
а. Сохранение структуры клеточной мембраны и дисковидной формы клетки.
б. Транспорт электролитов через цитолемму и обеспечение их оптимальной внутриклеточной концентрации.
в. Поддержание в восстановленной форме Fe2+ в молекуле Hb.
г. Сохранение Hb в растворённом состоянии.
- Гибель и разрушение эритроцитов. В сутки из кровотока удаляется 0,5-1,5% общей массы эритроцитов (40-50 тыс/мкл). Эритроциты, закончившие жизненный цикл, разрушаются в селезёнке, печени и костном мозге. Hb разделяется на гем и цепи глобина, расщепляющиеся до аминокислот.
а. Причины. Гибель эритроцита опосредуют клеточные факторы и микроокружение.
- Клеточные факторы. Поскольку синтез ферментов в эритроците невозможен, со временем в нём снижается обмен веществ, нарушается форма, происходит деградация белков, появляются новые Ar. Такие стареющие клетки распознаются макрофагами и фагоцитируются.
Антиген стареющих клеток появляется на поверхности плазматической мембраны клеток и служит меткой для их идентификации и устранения. В эритроцитах этот Ar появляется в результате деградации белка полосы 3. Этот механизм элиминации эритроцитов работает не только в норме, но и при гемолитических анемиях и малярии (дефектные формы эритроцитов).
- Микроокружение
(а) Пирексия.
(б) Токсины: неорганические (медь, мышьяк) и органические (бактериальные эндотоксины).
(в) Механические повреждения клетки (например, при прохождении через мелкие сосуды, в которых накапливаются нити фибрина — микроангиопатическая гемолитическая анемия).
(г) Присутствующие в плазме AT, реагирующие с Ar эритроцита, а также белки комплемента.
б. Продукты разрушения тема. При разрушении гема образуются:
- ионы железа,
- окись углерода (CO), выделяемая лёгкими;
- вердоглобин, из которого образуется биливердин, восстанавливающийся в билирубин. Билирубин в комплексе с альбумином транспортируется в печень, откуда в составе жёлчи поступает в кишечник.
в. Гемолиз — разрушение эритроцитов вследствие как внутренних дефектов клетки (например, при наследственном сфероцитозе), так и под влиянием разных факторов микроокружения. При этом содержимое клетки выходит в плазму. Гемолиз приводит к снижению общего количества циркулирующих эритроцитов (гемолитическая анемия).
- Эритропоэз см. IV Б 2
- Ретикулоциты — незрелые эритроциты, поступающие в кровоток из костного мозга. Они содержат рибосомы, митохондрии и комплекс Гольджи. Окончательная дифференцировка в эритроциты происходит в течение 24-48 часов после выхода в кровоток. Количество поступающих в кровоток ретикулоцитов равно количеству повреждённых эритроцитов, гибнущих в печени, селезёнке и костном мозге. Ретикулоциты составляют около 1% всех циркулирующих эритроцитов. Повышение содержания ретикулоцитов (ретикулоцитоз) свидетельствует о недостаточности транспорта кислорода, что может быть связано со снижением количества эритроцитов (после кровотечения, гемолиза и т.п.). Выявление ретикулоцитов. Краситель: бриллиантовый крезиловый синий. Результат: в ретикулоцитах видны сетчатые структуры ярко-синего цвета. Эритроциты имеют голубую окраску.
- Характеристики красной крови Гематокрит — 0,35-0,55
Hb в одном эритроците — 27-33 пг Диаметр эритроцита — 6,5-8,5 мкм
Концентрация Hb в эритроците — 31-37%, не может быть более 38%
Объём эритроцита — 80-95 фл
Осмотическая резистентность эритроцитов (мин.) — 0,44-0,48% раствор NaCl1 макс. —
- 28-0,36% раствор NaCl.
Продолжительность жизни эритроцита — 100-120 дней Ретикулоциты — 0,6-0,8%
Суточный эритропоэз (0,05—0,08)х 1012/л
Сферический индекс — 3-4, менее 2,4 — сфероцитоз, более 4,2 — планоцитоз Толщина эритроцита — 1,8-2,5 мкм Цветной показатель — 0,8-1,0
- Гематолосические красители (см. главу 18).
- Цитохимические методы исследования мазков крови приведены в главе 18.
Б. Лейкоциты
- Общая характеристика. Лейкоциты — ядерные клетки шаровидной формы. В I л крови взрослого здорового человека содержится 3,8—9,8х109 лейкоцитов. В цитоплазме лейкоцитов находятся гранулы: специфические (вторичные) и азурофильные (лизосомы).
а. Гранулы. В зависимости от типа гранул лейкоциты делят на гранулоциты (зернистые) и агранулоциты (незернистые).
- Гранулоциты (нейтрофилы, эозинофилы, базофилы) содержат специфические и азурофильные гранулы.
- Агранулоциты (моноциты, лимфоциты) содержат только азурофильные гранулы.
б. Ядро. Гранулоциты содержат дольчатое ядро разнообразной формы, в связи с чем их называют полиморфноядерными лейкоцитами. Лимфоциты и моноциты имеют недольчатое ядро, их называют мононуклеарными лейкоцитами.
в. Подвижность. Лейкоциты используют кровоток как средство пассивного транспорта. Лейкоциты имеют сократительные белки (актин, миозин) и способны к активному перемещению, что позволяет им выходить из кровеносных сосудов, проникая между эндотелиальными клетками (диапедез) и разрушая секретируемыми ими ферментами базальную мембрану эндотелия. Направленную миграцию лейкоцитов (хемокинез, хемотаксис) контролируют различные вещества (в т.н. хемоаттрактанты).
г. Функции. Лейкоциты участвуют в защитных реакциях, уничтожая микроорганизмы, захватывая инородные частицы и продукты распада тканей, осуществляя реакции гуморального и клеточного иммунитета.
д. Число лейкоцитов в крови. Изменяющаяся потребность в отдельных типах лейкоцитов отражается в увеличении (цитозы, иногда филии) или уменьшение (пении) их числа в циркулирующей крови. Например, при острых бактериальных инфекциях в крови увеличивается число нейтрофилов (нейтрофильный лейкоцитоз). При вирусных и хронических инфекциях происходит увеличение числа лимфоцитов (лимфоци- тоз), при паразитарных инфекциях — эозинофилия.
- Нейтрофилы — наиболее многочисленный тип лейкоцитов (рис. 6-3). Они составляют 40-75% общего количества лейкоцитов. Размеры нейтрофила: в мазке крови — 12 мкм; диаметр нейтрофила, мигрирующего в тканях, увеличивается почти до 20 мкм. Нейтрофилы образуются в костном мозге в течение 7 суток, через 4 суток выходят в кровоток и находятся в нём 8-12 часов. Продолжительность жизни — около 8 суток. Старые клетки фагоцитируются макрофагами. Нейтрофил содержит несколько митохондрий и большое количество гликогена. Клетка получает энергию путём гликолиза, что позволяет ей существовать в бедных кислородом повреждённых тканях. Количество органелл, необходимых для синтеза белка, минимально; поэтому нейтрофил не способен к продолжительному функционированию и погибает после единственной вспышки активности. Такие нейтрофилы составляют основной компонент гноя (гнойные клетки). В состав гноя также входят погибшие макрофаги, бактерии, тканевая жидкость.
а. Пулы нейтрофилов. Выделяют три пула нейтрофилов: циркулирующий, пограничный и резервный.
- Циркулирующий. Пассивно переносимые кровью клетки. При инфицировании организма их количество возрастает в течение 24-48 часов в несколько (до 10) раз за счёт пограничного пула, а также за счёт ускоренного выхода резервных клеток из костного мозга.
- Пограничный пул состоит из нейтрофилов, связанных с эндотелиальными клетками мелких сосудов многих органов, особенно лёгких и селезёнки. Циркулирующий и пограничный пулы находятся в динамическом равновесии.
- Резервный пул — зрелые нейтрофилы костного мозга.
б. Ядро. В зависимости от степени дифференцировки различают палочкоядерные и сегментоядерные нейтрофилы. В нейтрофилах у женщин один из сегментов ядра содержит вырост в форме барабанной палочки — тельце Барра. Тельце Барра заметно у 3% нейтрофилов в мазке крови женщин.
- Палочкоядерные нейтрофилы — незрелые формы клеток с подковообразным ядром.
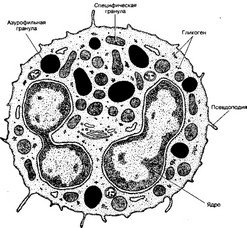
Рис. 6-3. Нейтрофил. Ядро состоит из 3-5 сегментов, соединённых тонкими перемычками. В цитоплазме — минимальное количество органелл, но много гранул гликогена. Нейтрофил содержит небольшое количество азурофильных гранул (специализированных лизосом) и многочисленные более мелкие специфические гранулы [из Lentz TL, 1971]
Сдвиг влево — увеличение относительного содержания палочкоядерных форм; возникает при выбросе в кровь незрелых форм нейтрофилов.
- Сегментоядерные нейтрофилы — зрелые клетки с ядром, состоящим из 3-5 сегментов, соединённых тонкими перемычками. Хроматин сильно конденсирован,
в. Гранулы
- Азурофильные гранулы — специализированные лизосомы нейтрофилов, содержащие не менее 10 белков, уничтожающих микроорганизмы.
(а) Сериновые протеазы (серпроцедины)
- Катепсин G. При нейтральном pH убивает грамположительные и грамотри- цательные бактерии. Дефицит катепсина G и связанное с ним нарушение бактерицидной активности нейтрофилов обнаружены при синдроме Шедьяка-Хигаши.
- Эластаза нейтрофилов расщепляет коллаген и эластин при физиологических pH. Вне клетки может разрушать нормальную ткань.
(iii) Протеиназа 3 (миелобластин) обладает способностью расщеплять эластин. При гранулёматозе Вегенера в организме появляются аутоантитела против протеиназы 3.
(б) Азуроцидин — антибактериальный белок с Mr 29 кД.
(в) Миелопероксидаза составляет 2-4% массы полиморфноядерного лейкоцита, катализирует образование хлорноватистой кислоты и других токсических агентов, значительно усиливающих бактерицидную активность ней- трофилов.
Недостаточность миелопероксидазы — причина снижения или отсутствия сопротивляемости организма бактериальной и грибковой инфекциям.
(г) Бактерицидный белок BPI повышает проницаемость мембран, характеризуется антибактериальной активностью в отношении грамположительных микроорганизмов.
(д) Дефензины оказывают прямое антимикробное действие в нейтральной и щелочной среде.
(е) Катепсины A, D, Е.
(ж) Катионные белки.
(з) Лизоцим. Разрушает стенку бактерий (лизис).
(и) Арилсульфатаза.
- Специфические гранулы значительно мельче азурофильных, но вдвое многочисленнее. Гранулы содержат лактоферрин, лизоцим, витамин В12-связывающие белки; гликопротеины, усиливающие фагоцитоз; коллагеназу, щелочную фосфа- тазу, катионные белки.
(а) Лактоферрин имеет выраженные бактериостатические свойства за счёт связывания металлосодержащих факторов роста микроорганизмов; связывает также свободные радикалы, продуцируемые нейтрофилами и повреждающие как сами клетки, так и окружающие ткани.
(б) Витамин В|2-связывающие белки. Пример подобных белков в составе специфических гранул — транскобаламин I, возможно ингибирующий кобальт- зависимые реакции свободных радикалов.
(в) Коллагеназа нейтрофилов переваривает коллаген I типа.
(г) Лизоцим разрушает (лизирует) стенку бактерий.
г. Рецепторы. В плазмолемму нейтрофилов встроены рецепторы молекул адгезии, цито- кинов, колониестимулирующих факторов (CSF), опсонинов, медиаторов воспаления и бактериальных продуктов.
- Рецептор CSF-G экспрессируют не только предшественники нейтрофилов, но и дифференцированные клетки.
Синдром Костманна развивается при точечной мутации гена рецептора CSF-G.
- Рецепторы опсонинов связывают Fc-фрагменты IgG, белки комплемента СЗа, СЗЬ, C3bi, С4Ь, С5а.
- Рецепторы медиаторов воспаления, например лейкотриена B4, фактора активации тромбоцитов, С5а.
- Рецепторы хемоаттрактантов, например f-Met-Leu-Phe (табл. 6-4).
д. Активация. Биологически активные соединения различного происхождения {например, содержимое гранул тромбоцитов, метаболиты арахидоновой кислоты [липидные медиаторы]), воздействуя на нейтрофилы, стимулируют их активность. Многие из этих веществ в то же время — хемоаттрактанты, по градиенту концентрации которых происходит миграция нейтрофилов (табл. 6-4).
Таблица 6-4. Факторы хемотаксиса нейтрофилов
|
Вещество |
Источник |
|
N-формил-метионил пептиды |
Продукт распада бактериальных белков |
|
(например, (-Met-Leu-Phe) |
и белков митохондрий |
|
С5а, C5a-des-Arg* |
Продукты метаболизма компонентов комплемента |
|
Фактор 4 тромбоцитов |
Тромбоциты |
|
Тромбоцитарный фактор роста (PDGF) |
Тромбоциты |
|
Фактор активации тромбоцитов (PAF) |
Тромбоциты, моноциты, макрофаги |
|
Метаболиты арахидоновой кислоты (например, LTB4) |
Активированные нейтрофилы и др. клетки крови |
|
Фактор хемотаксиса эозинофилов (ECF) |
Тучные клетки |
|
Фактор хемотаксиса нейтрофилов (NCF) |
Тучные клетки |
|
Лимфокины |
Стимулированные Ar или митогенами Т-лимфоциты |
* C5a-des-Arg — белок комплемента С5а без концевого аргинина
е. Липидные медиаторы продуцируют активированные нейтрофилы, а также базофи- лы и тучные клетки, эозинофилы, моноциты и макрофаги, тромбоциты. В активированной клетке из мембранных фосфолипидов освобождается арахидоновая кислота, из которой образуются простагландины, тромбоксаны, лейкотриены и ряд других биологически активных веществ.
ж. Респираторный взрыв. Нейтрофилы в течение первых секунд после стимуляции резко увеличивают поглощение кислорода и быстро расходуют значительное его количество. Это явление известно как респираторный (кислородный) взрыв. При этом образуются токсичные для микроорганизмов H2O2, супероксид O2 и гидроксильный радикал ОН'.
з. Хемотаксис. Нейтрофилы мигрируют в очаг инфекции по градиенту концентрации многих химических факторов (табл. 6-4). Важное значение среди них имеют N-фор- милметионилпептиды.
- N-формилметионилпептиды (например, хемоаттрактант f-Met-Leu-Phe) образуются при расщеплении бактериальных белков или белков митохондрий (при повреждении клеток).
- Рецепторы N-формилметионилпептидов. Связывание с этими рецепторами их лигандов приводит к активации нейтрофилов (выход из сосудистого русла, миграция в очаг воспаления, дегрануляция нейтрофилов, образование супероксидов).
- Йова синдром в виде дефекта хемотаксиса нейтрофилов сопровождается постоянными стафилококковыми инфекциями, кандидозом кожи и слизистых оболочек.
- Ленивых лейкоцитов синдром — дефект направленной миграции нейтрофилов.
и. Адгезия. Активированный нейтрофил прикрепляется к эндотелию сосуда в участке, ближайшем к месту воспаления. Адгезию к эндотелию стимулируют многие агенты: анафилатоксины, ИЛ-I, тромбин, фактор активации тромбоцитов, лейкотриены LTC4 и LTB4, фактор некроза опухоли а и др.
к. Миграция. После прикрепления к эндотелию и выхода из сосуда нейтрофилы увеличиваются в размерах, удлиняются и становятся поляризованными, образуя широкий головной конец (ламеллоподия) и суженную заднюю часть. Нейтрофил, продвигая вперёд ламеллоподию, мигрирует к источнику хемоаттрактанта. При этом гранулы перемещаются к головному концу, их мембраны сливаются с плазмолеммой и происходит выброс содержимого гранул (в т.ч. протеаз) из клетки — дегрануляция. Побочное эффекты. Миграция нейтрофилов в очаги воспаления может привести к обширным локальным повоеждениям вследствие выхода токсичного для тканей содержимого гранул нейтрофилов.
л. Фагоцитоз. Нейтрофилы обладают выраженной фагоцитарной активностью и участвуют в острой воспалительной реакции. Главная их функция — разрушение и захват тканевых обломков и микроорганизмов. Фагоцитоз и последующее переваривание материала происходят параллельно с образованием метаболитов арахидоновой кислоты (липидные медиаторы) и респираторным взрывом.
- Этапы
(а) Распознавание. Специфическое распознавание подлежащего фагоцитозу материала осуществляется при помощи рецепторов к опсонинам (Fc-фрагмен- ты AT и белки комплемента, связавшиеся с бактериями). Опсонизация резко усиливает фагоцитарную активность нейтрофилов. Неопсонизированные микроорганизмы устойчивы к фагоцитозу и поэтому весьма патогенны.
(б) Инвагинация мембраны нейтрофила вокруг частицы.
(в) Образование фагосомы.
(г) Образование фаголизосомы. В результате слияния фагосомы с лизосома- ми образуется фаголизосома.
(д) Уничтожение бактерий и разрушение захваченного материала. Для
этого в фаголизосому поступают:
(О лизоцим, катепсин G, эластаза, лактоферрин, дефензины, катионные белки;
- миелопероксидаза;
- супероксид O2- и гидроксильный радикал ОН', образующиеся (наряду с H2Oj) при респираторном взрыве.
- Наследственные дефекты (см. табл. 6-5, 6-6).
- Эозинофилы (рис. 6-4) составляют 1-5% лейкоцитов, циркулирующих в крови. Их количество изменяется в течение суток и максимально утром. Эозинофилы в течение нескольких дней после образования остаются в костном мозге, затем циркулируют в крови 3-8 часов, большинство из них выходит из кровотока. Эозинофилы мигрируют в ткани, контактирующие с внешней средой (слизистые оболочки дыхательных и мочеполовых путей, кишечника). Размер эозинофила в крови gt;12 мкм, увеличивается после выхода в соединительную ткань до 20 мкм. Продолжительность жизни — предположительно 8-14 дней. Цитоплазма содержит хорошо развитую гранулярную эндоплазма- тическую сеть, небольшое количество цистерн гладкой эндоплазматической сети, скопления рибосом, отдельные митохондрии и много гликогена. Эозинофилы после
Таблица 6-5. Расстройства фагоцитарной функции (Из: Терапия, М.: ГЭОТАР, 1996)
|
Патология и тип наследования |
Признаки |
Клиника |
Диагностика |
|
Хронические гранулёматозы (обычно К; также X и р) |
Недостаточность НАДФ-оксндазы (невозможность респираторного взрыва) |
Гранулёмы, гепатоспленоме- галия, лимфаденит, афтозный стоматит, себорейный дерматит |
Тест с нитросиним тетразолием |
|
Синдром Шедьяка-Хигаси (р) |
Нарушения хемотаксиса, миграции нейтрофилов и внутриклеточного бактериолиза |
Частые вирусные и кишечные бактериальные инфекции, частичный альбинизм кожи и радужки, нейтропения |
Гигантские лизосомы |
|
Дефекты молекул адгезии (р) |
Снижение хемотаксиса, миграции нейтрофилов и поглощения объектов фагоцитоза |
Замедленное отделение пуповины и омфалит: холодные кожные абсцессы, некротизиру- ющие абсцессы мягких тканей |
Длительный гранулоцитоз |
|
Синдром Нова (р) |
Редуцированный хемотаксис |
Стафилококковые инфекции, холодные абсцессы кожи, кандидоз |
Эозинофилия, выраженное увеличение IgE |
дегрануляции или в отсутствие эозинофильных факторов (например, ИЛ-5) подвергаются апоптозу.
а. Ядро. Палочкоядерные эозинофилы — незрелые формы с подковообразным ядром. Сегментоядерные эозинофилы — зрелые клетки с ядром, состоящим из двух крупных сегментов, соединённых тонкой перемычкой.
Таблица 6-6 Функциональные и морфологические дефекты нейтрофилов (По: Hematology Besa ES et al Eds, Philadelphia, Harwal Publishing, 1992, с. 165)
|
Заболевание |
Характеристика |
Клиника |
|
Синдром Шедьяка-Штайнбринка-Хигаси |
Большие цитоплазматические гранулы в нейтрофилах, лимфоцитах и моноцитах |
Рецидивирующие инфекции |
|
Хроническая гранулёматозная болезнь |
Дефектное образование пероксидов; каталаза+-микроорганизмы фагоцитируются, но не уничтожаются |
Рецидивирующие инфекции |
|
Недостаточность адгезии лейкоцитов |
Дефекты фагоцитоза и хемотаксиса нейтрофилов |
Рецидивирующие инфекции |
|
Недостаточность миелопероксидазы |
Снижена эффективность функции лизосом |
Грибковые инфекции |
|
Недостаточность других ферментов |
Недостаток глутатион-редуктазы, каталазы |
Нет |
|
Аномалия Мая-Хегглина |
Тельца Деле в гранулоцитах и моноцитах; гигантские тромбоциты |
Иногда тромбоцитопения |
|
Аномалия Пёлъгера-Хюэта |
Двудольные или однодольные гранулоциты |
При миелолимфодисплазии — цитопения, инфекции |
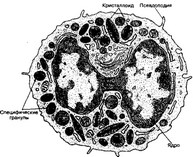
Рис. 6-4. Эозинофил. Ядро эозинофила обычно образует два крупных сегмента, соединённых тонкой перемычкой. Содержит умеренное количество типичных органелл, гликоген. Крупные гранулы овоид- ной формы содержат электроноплотный материал — кристаллоид. Клетка образует цитоплазматические выросты, при помощи которых мигрирует в тканях [из Lentz TL, 1971]
б. Специфические гранулы. В цитоплазме эозинофила присутствуют крупные и мелкие гранулы.
- Крупные гранулы размером 0,5-1,5 мкм имеют овоидную форму и содержат удлинённый кристаллоид. Между мембраной гранулы и кристаллоидом находится ам
Источник: Под ред. Э.Г. Улумбекова, Ю.А. Челышева, «Гистология (введение в патологию)» 1997