Соединительные ткани
Соединительные ткани — широко распространённые ткани мезенхимного генеза, обеспечивают поддержание целостности других тканей и органов, формируют строму последних, содержат кровеносные и лимфатические сосуды, участвуют в трофическом обеспечении всех тканей и органов. Среди соединительных тканей выделяют волокнистые ткани и ткани со специальными свойствами. Общие черты организации как волокнистых соединительных тканей, так и всех типов системы тканей внутренней среды изложены в разделе «Общая характеристика» в начале главы в.
А. Обзор функций. Разные соединительные ткани различаются по физическим свойствами. В большинстве органов и между ними рыхлая соединительная ткань выступает в качестве биологической упаковки паренхимы, организуя ложе для её гистологических элементов (строма органов). Для многих клеточных типов, органов и тканей соединительнотканное окружение не только играет пассивно поддерживающую роль, но и имеет организующее и информационное значение. Плотные соединительные ткани обеспечивают прочность кожи, образуют капсулы органов и позволяют выдерживать значительные механические нагрузки при помощи связок и сухожилий. Хрящ и кость (твёрдые формы соединительной ткани) — главные скелетные ткани (см. главу 6.3). Соединительная ткань имеет важное метаболическое значение не только потому, что содержит кровеносные сосуды. Так, белая жировая ткань запасает жир как источник энергии, а бурая жировая ткань участвует в регуляции температуры тела новорождённых. Ряду клеток соединительной ткани принадлежит функция защиты от патогенных микроорганизмов. Соединительная ткань — плацдарм воспалительных и иммунных реакций, где воюют как собственные клетки реактивного очага, так и иммигранты.
Б. Строение. В состав всех волокнистых соединительных тканей входят клетки и значительный объём межклеточного вещества. Химический состав, структура и объём внеклеточного матрикса определяют физические свойства каждого типа соединительной ткани. Внеклеточный матрикс состоит из основного вещества и погружённых в него волокон различного типа.
I. Внеклеточный матрикс
а. Основное вещество — аморфный и относительно прозрачный материал со свойствами геля. Тканевая жидкость связывается с компонентами основного вещества, формируя среду для прохождения молекул через соединительную ткань и для обмена веществ с кровью. Основное вещество включает гликозаминогликаны, протеогликаны и гликопротеины. Молекулы этих веществ прочно связаны с волокнами внеклеточного матрикса. С молекулами основного вещества взаимодействуют также различные клетки.
(I) Гликозаминогликаны — полисахариды, построенные из повторяющихся дисаха- ридных единиц, одна из которых — обычно уроновая кислота, а другая — амино- сахар (УУ-ацетилгликозамин, УУ-ацетилгалактозамин).
(а) Свойства. Гликозаминогликаны — кислые (отрицательно заряженные) соединения, т.к. в их дисахаридных единицах много гидроксильных, карбоксильных и сульфатных групп. Молекулы гликозаминогликанов гидрофильны, связывают большое количество молекул воды и ионов (в частности, Na+), входящих во внеклеточную жидкость. Связанные между собой крупные молекулы гликозаминогликанов образуют гель, через который диффундируют метаболиты.
(б) Типы. Различают 5 разновидностей гликозаминогликанов.
- Гиалуроновая кислота (Mr * 1000 кД,) преобладает в рыхлой соединительной ткани, стекловидном теле, хряще и коже; содержит многочисленные
повторяющиеся дисахариды, состоящие из УУ-ацетилглюкозамина и ?)-глюку- роновой кислоты. Молекула не содержит (в отличие от других гликозаминог- ликанов) боковых сульфатных групп и ковалентно не связана с белками.
- Хондроитинсульфат — сильно сульфатированное соединение, состоит из повторяющихся дисахаридов А'-ацетилгалактозамина и ,D-глюкуроновой кислоты. Приблизительно 60 повторяющихся единиц ковалентно объединяются в молекулу с Mr около 30 кД. В большом количестве присутствует в хряще, кости, коже и роговице.
- Дерматансульфат (Mr « 30 кД) состоит из повторяющихся единиц УУ-аце- тилгалактозамин-4-сульфата и I-идуроновой кислоты. Присутствует в коже, стенке кровеносных сосудов, сухожилиях, соединительной ткани лёгких.
- Кератансульфат содержит А'-ацетилглюкозамин-б-сульфат и галактозу, может содержать галактозамин. Степень сульфатирования сильно варьирует; не содержит уроновой кислоты.
- Гепарансульфат и родственный ему гепарин (гепаринсульфат) содержат УУ-ацетилглюкозамин и/или /)-глюкуроновую кислоту, реже — идуроновую кислоту. Гепарансульфат присутствует на поверхности многих клеток и входит в состав базальных мембран. Гепарин — мощный антикоагулянт.
- Протеогликан — белковая волокнистоподобная матрица с ковалентно присоединёнными гликозаминогликанами. Так образуются крупные макромолекулы, содержащие 90-95% углеводов. Протеогликаны могут нековалентно связываться с цепями гиалуроновой кислоты, формируя ещё более крупные комплексы (например протеогликаны хряща [глава 6.3 А I б (I) (б)]).
- Гликопротеины состоят из полипептидных цепей, соединённых с разветвлёнными полисахаридами, и связывают клетки с внеклеточным матриксом. Различают гликопротеины, формирующие фибриллярные структуры (фибронектин и фибриллин), а также ряд неволокнистых белков (ламинин, тенасцин и энтактин).
(а) Фибронектин
- Локализация. Фибронектин найден в базальной мембране, вокруг коллагеновых волокон и клеток. Большое количество фибронектина находится в плазме крови.
- Функции. Фибронектин участвует в адгезии клеток, контролирует их морфологию и архитектуру поверхности, а также формирует фибриллы внеклеточного матрикса. Фибронектин связывает клетки с компонентами внеклеточного матрикса, в частности с коллагеном и гликозаминогликанами. При заживлении ран фибронектин образует пути для миграции клеток.
- Рецептор фибронектина — интегрин, встроенный в клеточную мембрану [глава 4 III А 3 (4)]. Внутри клетки интегрин взаимодействует с актиновыми микрофиламентами примембранного цитоскелета, а снаружи соединяется с фибро- нектином. В свою очередь фибронектин образует связи с коллагеном и гликозами- ногликаном (гепарансульфат). Так устанавливается структурная непрерывность между цитоскелетом и внеклеточным матриксом (рис. 6-24).
(б) Фибриллин формирует микрофибриллы диаметром 8-12 мкм, усиливающие
связи между внеклеточными компонентами (например, в мезангии почки).
Фибриллин входит в состав эластических структур, обеспечивая их упорядоченное строение.
Мутация гена фибриллина найдена при синдроме Марфана [си. главу I E 3 а (4)].
(в) Ламинин (см. Б I в (2) (а)).
(г) Энтактин (см. главу 18).
(д) Тенасцин (см. главу 18).
б. Волокна. Различают коллагеновые, эластические и ретикулиновые волокна.
- Коллагеновые волокна — главный компонент, присутствующий в большинстве соединительных тканей. Коллаген — наиболее распространённый белок.
Коллагеновые волокна придают тканям прочность.
(а) Строение. Молекула коллагена — спираль из трёх про-а-цепей. Длина подобной спирали — 300 нм, диаметр — 1,5 нм. Все типы коллагена содержат области с повторяющейся последовательностью из трёх аминокислот с глицином в третьем положении. Первая аминокислота в такой последовательности может быть любой, вторая — пролин, гидроксипролин или лизин.
Гены коллагенов локализованы в разных хромосомах. Стандартное название гена Iнапример, COL1A2) состоит из названия гена COL (от collagen, коллаген), типа коллагена (I, II и т.д.), идентификатора полипептидной цепи (А2, где А, В и т.д. — аббревиатура от alpha, beta и т.д., I, 2 и т.д. — порядковый номер цепи).
(б) Типы. Описано не менее 13 типов коллагена. Наиболее распространены коллагены первых пяти типов. Остальные встречаются сравнительно редко и в небольших количествах.
- Тип I — один из наиболее распространённых, образует видимые под микроскопом фибриллы с периодичностью 67 нм. Сходная периодичность характерна также для коллагенов II и III типа. Синтезируется фибробластами, остеобластами, ГМК, некоторыми эпителиями.
- Тип II синтезируется хондробластами, хондроцитами, нервными клетками сетчатки.
- Тип III входит в состав ретикулиновых волокон, образующих нежную поддерживающую сеть в некоторых органах и тканях (например, в печени, костном мозге, лимфоидных органах). Синтезируется фибробластами и ГМК.
- Тип IV образует сетеподобные структуры базальных мембран [глава 5 IА 5 а].
- Тип V присутствует в кровеносных сосудах, вокруг ГМК и в костном матриксе. Синтезируется ГМК и остеобластами.
(в) Локализация. По распределению в тканях типы коллагена можно разделить на несколько групп (табл. 6-10).
- Большинство соединительных тканей содержит коллагены I, Ш, V, VI типов.
Цитоплазма Актин
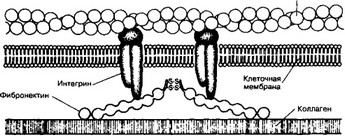
Рис. 6-24. Опосредованная фибронектином связь клетки с коллагеновыми волокнами.
Цитоплазматический домен интегрина взаимодействует с примембранными микрофиламентами (актин), а внеклеточный домен — с фибронектином, связанным в свою очередь с коллагеновыми волокнами. В молекуле фибронектина имеются также домены для связывания с гепарином и фибрином [из Johnson XE, 1991]
Таблица 6-10. Распределение коллагена в тканях и органах
|
Тип |
Ткани и органы |
|
I |
Кожа, сухожилия, кости, роговица, плацента, артерии, печень, дентин, опухоли |
|
II |
Хрящи, межпозвонковые диски, хондросаркома, стекловидное тело, роговица |
|
III |
Хориоамнион, кожа плода, лёгкие, артерии, матка, ретикулиновые волокна в печени и органах кроветворения |
|
IV |
Базальные мембраны |
|
V |
Хориоамнион, плацента, кожа, рабдомиосаркома |
|
VI |
Кровеносные сосуды, связки, кожа, матка, лёгкие, почки |
|
VII |
Амнион, кожа, пищевод, роговица |
|
VIII |
Культуральная среда эндотелия, астроцитомы и других нормальных и трансформированных клеток |
|
IX |
Хрящи, межпозвонковые диски, стекловидное тело |
|
X |
Хрящи |
|
XI |
Хрящи, межпозвонковые днски, стекловидное тело |
- Хрящ содержит коллагены II, IX, X, XI типов.
- Отдельные структуры. Коллаген VII типа входит в состав якорных волокон кожи, тип IV присутствует в базальных мембранах, коллаген VIII типа вырабатывают эндотелиальные клетки.
(г) Патология
- Фиброзы. При фиброзах содержание коллагена значительно возрастает. Так, синтез и содержание коллагена I типа увеличиваются при прогрессирующем системном склерозе, при образовании келоидов. Фиброзная ткань, грануляционная ткань, соединительнотканный рубец, келоидный рубец, келоид фактически состоят из коллагенов.
- Воспаление и регенерация. При воспалении и регенерации происходит активная перестройка коллагена. Коллагеназы фибробластов, макрофагов и нейтрофилов разрушают коллаген, далее механоциты (синтезирующие коллаген клетки системы тканей внутренней среды) синтезируют коллагены, и происходит восстановление волокон.
- Мутации генов. Обнаружено множество мутаций коллагенов, приводящих к развитию различных болезней.
- Несовершенный остеогенез разных типов. He менее 50 разных мутаций гена COL1A1, около 30 — гена COL1A2.
- Ахондрогенезы и ахондроплазии, приводящие к разным формам карликовости (мутации генов COL2A1 и COLlA]).
[Ill] Элерса-Данлд синдром развивается вследствие мутаций генов COL3A1 (не менее 30), COL1A1, COL1A2.
(д) Образование коллагеновых волокон (рис. 6-25). Коллаген синтезируют фибро-, хондро- и остеобласты, ГМК (реже некоторые другие клетки) в виде про-а-цепей, последовательно подвергающихся гидроксилированию, а затем гликозилированию. Три про-а-цепи объединяются и образуют молекулу проколлагена, выделяющуюся из клетки. На этом заканчивается внутриклеточный этап образования коллагена. На внеклеточном этапе происходит ряд последовательных событий: отщепление концевых фрагментов от молекулы проколлагена и образование тропоколлагена, сборка фибрилл из молекул тропокол- лагена и фиксация структуры при помощи ковалентных связей.
- Внутриклеточный этап
- Трансляция происходит в гранулярной эндоплазматической сети.
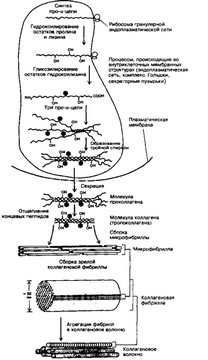 Рис. 6-25. Образование коллагена и коллагенового волокна. Сборка полипептид- ных a-цепей, их гндроксили- рование и гликозилирование, а также образование спирали из трех a-цепей происходят в гранулярной эндоплазматической сети и комплексе Гольджи. Образующиеся молекулы проколлагена накапливаются в секреторных пузырьках, а далее выделяются во внеклеточное пространство. Вне клетки путём отщепления концевых пептидов образуется тропокол- лаген, из молекул которого формируются фибриллы [из Альбертеа Б и др, 1994)
Рис. 6-25. Образование коллагена и коллагенового волокна. Сборка полипептид- ных a-цепей, их гндроксили- рование и гликозилирование, а также образование спирали из трех a-цепей происходят в гранулярной эндоплазматической сети и комплексе Гольджи. Образующиеся молекулы проколлагена накапливаются в секреторных пузырьках, а далее выделяются во внеклеточное пространство. Вне клетки путём отщепления концевых пептидов образуется тропокол- лаген, из молекул которого формируются фибриллы [из Альбертеа Б и др, 1994)
- Посттрансляционная модификация. В цистернах комплекса Гольджи осуществляются гидроксилирование и гликозилирование полипептидов, в результате образуются спирали из трёх про-а-цепей (проколлаген). При этом концевые участки про-а-цепей соединяются дисульфидными, а сами цепи — водородными связями. Для образования поперечных связей между полипептидными цепями необходимы некоторые кофакторы (например, витамин С).
- Секреция проколлагена. Молекулы проколлагена накапливаются в секреторных гранулах и выделяются во внеклеточное пространство.
- Дефицит витамина С приводит к формированию слабо гидроксилированных про-а-цепей, не способных формировать тройные спирали и коллагеновые фибриллы. В результате возникают дефекты костей, зубов, нарушения заживления повреждений и переломов костей.
- Внеклеточный этап
[I] Тропоколлаген. Концевые участки молекулы проколлагена отщепляются при помощи проколлагеновой пептидазы, и образуется тропоколлаген. Это отщепление не происходит у коллагенов типов IV и V, чем и объясняется отсутствие фибрилл, построенных из коллагенов этих типов.
- Сборка фибрилл (рис. 6-26). Молекулы тропоколлагена имеют хвостовой и головной концы и спонтанно объединяются в параллельно расположенные цепи, выстраиваясь последовательно конец в конец и сторона к стороне. При этом между головными и хвостовыми концами остаются зазоры шириной 35 нм. Каждая молекула в цепи смещена относительно молекулы в соседней цепи на четверть её длины, что и служит причиной чередования тёмных и светлых полос с периодичностью 65 нм. При ЭМ светлые полосы видны в области перекрывания всех цепей из тропоколлагена. Тёмные полосы соответствуют зазорам между концами молекул. Более толстые фибриллы образуются путём присоединения новых молекул тропоколлагена. Взаимодействие коллагена с гликозаминогликанами и фибронектином регулирует сборку фибрилл.
- Дефекты фибрилл. Чрезмерное удлинение фаланг (арахнодактилия) и их эластичность, повышенная растяжимость кожи, частые сосудистые аневризмы при синдроме Марфана обусловлены нарушением образования поперечных связей при формировании коллагеновых фибрилл.
- Коллагеновое волокно формируется из многих параллельно связанных гликопротеинами коллагеновых фибрилл.
- Пучки коллагеновых волокон — погружённая в межклеточный матрикс совокупность коллагеновых волокон.
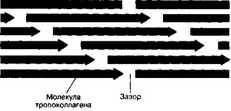
Рис. 6-26. Упаковка поляризованных молекул тропоколлагена при образовании коллагенового волокна. При последовательном объединении молекул тропоколлагена в цепь между хвостовым и головным концом соседних молекул сохраняется зазор шириной 35 нм. Каждая молекула одной цепи смещена относительно молекулы соседней цепи на четверть её длины. Так формируется фибрилла, имеющая поперечную исчерчекность с периодичностью 65 нм [из Johnson KE, 199!]
(е) Взаимодействие коллагена с клетками (табл. 6-11). Коллагеновые структуры окружают многие клетки. Некоторые клетки (например, гепатоциты и ГМК) имеют в плазмолемме рецепторы коллагена и прямо связываются с ним. Другие клетки связываются с коллагеном через специальные связующие белки- посредники (чаще фибронектин, реже хондронектин и ламинин).
- Эластические структуры (волокна и мембраны). Главный их компонент — эластин, полипептид внеклеточного матрикса с выраженными эластическими свойствами. В образовании эластических структур также принимают участие фибрил- лины. Эластические волокна присутствуют в эластическом хряще, коже, лёгких, кровеносных сосудах. Окончатые эластические мембраны характерны для крупных артерий. Эластические элементы позволяют структурам принимать исходную форму после её изменения в результате воздействия деформирующей силы.
(а) Эластин — гликопротеин с Mr 70 кД. Как и коллаген, содержит много глицина и пролина. Эластин в большом количестве содержит две уникальные аминокислоты — десмозин и изодесмозин.
(б) Фибриллины формируют микрофибриллярный каркас, необходимый для образования эластических структур из аморфного эластина.
Марфана синдром развивается при дефектах (известно не менее 30 мутаций) гена FBN1, кодирующего фибриллин I.
(в) Эластическое волокно (ветвящаяся нить диаметром 0,2-1,0 мкм) состоит из двух компонентов: аморфного эластина и образующего микрофибриллы фибриллина.
- Синтез. Фибробласты и ГМК синтезируют эластин и фибриллин в цистернах гранулярной эндоплазматической сети. В комплексе Гольджи происходит упаковка полипептидов в секреторные гранулы, выделяемые во внеклеточную среду.
- Лизилоксидаза при образовании молекулы эластина формирует поперечные связи путём окислительного дезаминирования е-аминогруппы в остатках лизина. Дефект гена лизилоксидазы проявляется при ряде синдромов: синдроме вялой кожи
(cutis Iaxa), синдроме Элерса-Данло, синдроме Мёнкеса (болезнь курчавых волос).
- Сборка эластина. Молекулы эластина существуют как хаотично расположенные кольца. В результате образования межмолекулярных связей между полипептидами эластина формируется упругая резиноподобная сеть молекул, способная после деформации восстанавливать исходную форму. Эта сеть и составляет основу эластических структур.
- Микрофибриллы межклеточного вещества образуются ещё до сборки эластина. После формирования каркаса из фибриллинов эластин организуется в волокно, так что микрофибриллы оказываются как внутри, так и снаружи волокна.
- Ретикулиновые волокна — тонкие нити диаметром 0,5-2,0 мкм, состоящие из коллагена III типа, связанного с гликопротеинами и протеогликанами. Компоненты ретикулинового волокна синтезируют ретикулярные клетки и ГМК. Эмрса-Дтю-Русакова синдром. При дефектах транскрипции или трансляции мРНК,
кодирующих цепи коллагена III типа, нарушается формирование ретикулиновых
Таблица 6-11. Связующие молекулы между коллагеном и различными типами клеток
|
Тип коллагена |
Связующая молекула |
Клеточный тип |
|
I |
Фибронектин |
Разные типы |
|
II |
Хондронектин |
Хондроциты |
|
III |
Фибронектин |
Ретикулярные клетки, ГМК |
|
IV |
Ламинин |
Эпителиальные клетки |
волокон, что приводит к появлению разрывов в стенке кишки или/и крупных артерий, где ретикулиновые волокна образуют оболочку вокруг ГМК. в. Базальная мембрана — особый вид внеклеточного матрикса, имеет вид листа или пластинки толщиной 20-200 нм (см. рис. 16-2) и состоит из специальных белков, служащих для соединения клеток различного типа (эпителиальных, мышечных, шван- новских) с окружающей соединительной тканью.
- Строение. Базальная мембрана состоит из двух слоёв.
(а) Lamina Iucida (светлый слой) толщиной 10-50 нм примыкает к цитолемме клеток.
(б) Lamina densa (электроноплотный). Толщина этого слоя варьирует.
- Химический состав. В базальную мембрану входят коллаген IV типа (см. Б I б
- (б)), ламинин, гепарансульфат (см. Б I а (I) (б) (v)), энтактин, остеонектин (см. главу 6.3 Б I б (2) (а)). Основа lamina Iucida и lamina densa — трёхмерная сеть, состоящая из волокон коллагена IV типа, с которыми связаны ламинин, энтактин и гепарансульфат.
(а) Ламинин — крупномолекулярный белок базальной мембраны, связывает коллаген IV типа с другими компонентами базальной мембраны и с клетками. В плазматическую мембрану клеток, связывающихся с ламинином, встроены рецепторы ламинина [интегрины, см. главу 4 III А 3 а (4)]. Молекула ламинина имеет уникальную крестообразную форму и содержит специальные участки для связывания с клетками (через интегрин), гепарансульфатом, коллагеном IV типа и энтактином.
(б) Энтактин (нидоген) — белковый компонент всех базальных мембран, образует комплекс с ламинином и соединяет его с коллагеном IV типа в lamina densa. Метастазирование. В эмбриогенезе, а также при метастазировании злокачественных опухолей происходят перестройка и/или разрушение базальных мембран. iV-терминальная глобулярная часть молекулы энтактина имеет участки, чувствительные к протеазам. Эти участки — мишени протеаз, образующихся в эмбриональных или опухолевых клетках.
- Якорные волокна. Большинство базальных мембран прочно соединено с рыхлой соединительной тканью. Молекулярная природа этих связей в большинстве случаев неизвестна, за исключением базальной мембраны многослойного эпителия кожи, пищевода, роговицы и амниона. Эти базальные мембраны короткими якорными волокнами связаны с якорными пластинками в подлежащей соединительной ткани. Якорные волокна состоят в основном из коллагена VII типа, якорные пластинки содержат коллаген IV типа. Якорные волокна также соединяют между собой якорные пластинки в строме. В итоге образуется плотная сеть переплетённых волокон, стабилизирующая базальную мембрану в тканях, подверженных значительным воздействиям на сдвиг.
- Другие компоненты базальных мембран. В составе базальных мембран идентифицированы И другие белки: фибронектин, амилоид Р, ацетилхолинэстера- за, некоторые компоненты комплемента, мерозин, агрин, фактор фон Вймебранда, тромбоспондин. Однако эти вещества имеют ограниченное распределение и выполняют специальные функции в соответствии с их локализацией.
(а) Агрин способствует агрегации рецепторов постсинаптической мембраны.
(б) Фактор фон Вймебранда обнаружен в гранулах тромбоцитов, в плазме крови, но присутствует также в базальной мембране эндотелия кровеносных сосудов. Этот фактор способствует адгезии тромбоцитов к стенке повреждённого сосуда.
(в) Тромбоспондин найден в базальной мембране железистого эпителия кожи и лёгких.
- Функции
(а) Контроль фенотипа. Базальная мембрана поддерживает фенотип клеток и влияет на разные виды клеточной активности: адгезию, дифференцировку, поляризацию, миграцию.
(б) Барьерная функция предупреждает рост эпителиальных клеток в подлежащую соединительную ткань. При раковых опухолях нарушение этой функции приводит к прорастанию опухолей и образованию метастазов.
(в) Контроль проницаемости. Базальная мембрана фильтрует макромолекулы. Так, в почке lamina densa базальной мембраны фильтрационного барьера, содержащая коллаген IV типа, задерживает макромолекулы с Mr более 69 кД.
(г) Поддержание структуры ткани. Базальная мембрана объединяет клетки, способствует организации пластов клеток (глава 5 I А 5).
- Клетки соединительных тканей — фибробласты, макрофаги, тучные, лейкоциты, плазматические, перициты, адипоциты.
а. Классификации
- Резиденты и иммигранты
(а) Резиденты — фибробласты и фиброциты (волокнистая соединительная ткань), хондробласты и хондроциты (хрящевая ткань), остеобласты и остеоциты (костная ткань), тучные клетки, адипоциты, макрофаги, плазматические клетки.
(б) Клетки-иммигранты — лейкоциты (нейтрофилы, эозинофилы, базофилы, моноциты). При возникновении очагов воспаления эти клетки выходят из кровотока в соединительную ткань. Лимфоциты, осуществляющие иммунологический надзор, постоянно циркулируют между кровью, соединительными тканями, лимфой.
- Функциональные группы. Клетки соединительной ткани (в зависимости от выполняемой функции) можно разделить на три основные группы.
(а) Клетки, ответственные за синтез молекул внеклеточного вещества и поддержание структурной целостности ткани. В соединительных тканях это фибробласты.
Механоциты — общее наименование таких клеток соединительных и скелетных тканей. К ним относят, помимо фибробластов и фиброцитов, хондробласты и хондроциты, остеобласты и остеоциты, одонтобласты, ретикулярные клетки.
(б) Клетки, ответственные за накопление и метаболизм жира, — адипоциты; эти клетки образуют жировую ткань.
(в) Клетки с защитными функциями (в т.ч. иммунологическими): тучные, макрофаги и все типы лейкоцитов.
б. Фибробласт (рис. 6-27) — наиболее распространённый тип клеток соединительной' ткани; секретирует компоненты внеклеточного матрикса, участвует в заживлении ран, способен к пролиферации и миграции.
- Строение. Форма фибробластов разнообразна (от веретеновидной до звездообразной). Так, в плотной оформленной соединительной ткани фибробласт (точнее, фиброцит) имеет веретеновидную форму. В рыхлой соединительной ткани фибробласты располагаются свободно и образуют отростки. Размер клетки изменчив. Ядро содержит несколько ядрышек. Клетка интенсивно синтезирует белок, что отражается на её строении. Цитоплазма содержит в большом количестве цистерны гранулярной эндоплазматической сети, хорошо выраженный комплекс Гольджи,
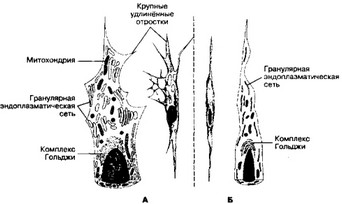
Рис. в-27. Строение фибробласта (А) и фиброцита (Б). Фибробласт (активная форма клетки) содержит хорошо выраженные органеллы: гранулярную эндоплазматическую сеть, комплекс Гольджи, митохондрии. Фибробласт образует крупные удлинённые отростки. В фиброците тех же органелл значительно меньше, клетка имеет веретеновидную форму; отростков нет [из Junqueira LC, Cameiro J, 1991]
много митохондрий. Имеются лнзосомы и секреторные гранулы, гликоген, многочисленные микрофиламенты и микротрубочки.
- Функция
(а) Синтез и секреция молекул внеклеточного матрикса. Фибробласты синтезируют коллаген (проколлаген), эластин, фибронектин, гликозаминогликаны, протеогликаны и другие компоненты внеклеточного матрикса.
(б) Продукция цитокинов. Фибробласты вырабатывают колониестимулирующий фактор гранулоцитов и макрофагов (GM-CSF), колониестимулирующий фактор гранулоцитов (G-CSF) и колониестимулирующий фактор макрофагов (M-CSF). Фибробласты костного мозга секретируют ИЛ-3 и ИЛ-7.
(в) Заживление ран и воспаление. При заживлении ран и воспалении фибробласты активируются макрофагами, секретирующими bFGF и PDGF. Фибробласты активно пролиферируют и мигрируют к месту повреждения, связываясь с фибриллярными структурами через фибронектин. Одновременно они активно синтезируют вещества внеклеточного матрикса. Фибробласты содержат коллагеназы — ферменты, разрушающие коллаген. Существует несколько типов коллагеназ, разрушающих определённый тип коллагена. Разрушая коллаген и синтезируя новый, фибробласт способствует его перестройке и образованию рубцов в месте повреждения (воспаления).
- Фиброциты
(а) Строение. Фиброцит сдавлен параллельно идущими волокнами внеклеточного матрикса и имеет веретенообразную форму. Уплотнённое ядро вытянуто и расположено вдоль клетки. Имеются рассеянные цистерны гранулярной эндоплазматической сети, небольшое количество митохондрий. Комплекс Гольджи развит слабо. Клетка содержит сравнительно немного секреторных гранул.
(б) Функции. Главная функция — поддержание тканевой структуры путём непрерывного, хотя и медленного обновления компонентов внеклеточного матрикса. При заживлении ран фиброцит может быть стимулирован к синтетической активности. Активированный фиброцит приобретает черты фибробласта: ядро округляется, увеличивается количество цистерн эндоплазматической сети, митохондрий; комплекс Гольджи становится более выраженным.
- Перикриптальные фибробласты. В слизистой оболочке кишечника присутствуют перикриптальные фибробласты — клетки стромы, проявляющие морфологические черты ГМК. Полагают, что они регулируют рост и дифференцировку эпителиальных клеток. Эти фибробласты экспрессируют гладкомышечный актин.
- Миофибробласты — сократительные клетки, имеющие общие черты с ГМК (см. главу 7 III).
в. Макрофаги — дифференцированная форма моноцитов. Макрофаги — профессиональные фагоциты, найдены во всех тканях и органах. Очень мобильная популяция клеток, способная быстро перемещаться. Продолжительность жизни — месяцы. Тканевые макрофаги сохраняют некоторую способность к делению (например, альвеолярные макрофаги при хронических воспалительных процессах).
- Типы. Макрофаги подразделяют на резидентные и подвижные.
(а) Резидентные макрофаги находятся в тканях в норме, в отсутствие воспаления. Среди них различают свободные, имеющие округлую форму, и фиксированные макрофаги. Последние имеют звездообразную форму и своими отростками прикрепляются к внеклеточному матриксу или другим клеткам.
(б) Подвижные макрофаги. Популяция переселяющихся (вызванных) макрофагов дифференцируется из моноцитов.
- Система мононуклеарных фагоцитов. Макрофаги соединительной ткани — часть системы мононуклеарных фагоцитов.
(а) Критерии. Клетки системы мононуклеарных фагоцитов отличаются от других фагоцитирующих клеток по трём критериям:
- имеют морфологию макрофагов,
- происходят из костного мозга,
- их фагоцитарную активность модулируют Ig и компоненты комплемента.
(б) Примеры
- Макрофаги
- перитонеальные
- альвеолярные
- Остеокласты (глава 6.3 IV Б 2 г)
- Клетки фон Купффера (глава 12 XI В 3 г)
- Клетки Лангерханса (глава 16 Б 2 в)
- Клетки Хофбауэра (глава 3 IX Б 2)
- Гигантские клетки инородных тел (глава 4 I Б 2 в)
- Возможно, клетки микроглии ЦНС (глава 8.11 А 3 д)
- Гигантские клетки. Конечная стадия дифференцировки моноцита и макрофага, хотя и далеко не всегда происходящая, — многоядерная гигантская клетка, формирующаяся в очаге воспаления в результате слияния нескольких макрофагов. Гигантские клетки играют заметную роль в образовании гранулём.
- Строение (рис. 6-28) макрофага зависит от его активности и локализации. Диаметр клетки — около 20 мкм. Ядро неправильной формы, с углублениями. В цитоплазме присутствуют митохондрии, свободные рибосомы, хорошо выраженный комплекс Гольджи, мультивезикулярные тельца, гранулярная эндоплазматическая
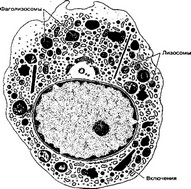
Рис. 6-28. Макрофаг. Ядро неправильной формы, с выемками. В цитоплазме присутствуют рибосомы, митохондрии, мультивезикулярные тельца. Хорошо развиты комплекс Гольджи и гранулярная эндо- плазматическая сеть. Имеются многочисленные лизосомы. Характерно наличие фагосом, фаголизо- сом, остаточных телец. Клетка образует цитоплазматические отростки, участвующие в миграции и
фагоцитозе [из Lentz TL. 1971]
сеть, лизосомы. В активированных макрофагах выраженность эндоплазматической сети и количество лизосом увеличены.
(а) Примембранное пространство. Под плазмолеммой в большом количестве присутствуют актиновые микрофиламенты, микротрубочки, промежуточные филаменты, необходимые для миграции и фагоцитоза. Фагоцитирующие, клетки образуют цитоплазматические псевдоподии неправильной формы, участвующие в амебоидном движении и фагоцитозе.
(б) Структуры внутриклеточного переваривания — фагосомы (глава 21В 3 б), лизосомы, фаголизосомы и остаточные тельца (глава 2 III А 8 в). Остаточный материал может выделяться из макрофага путём экзоцитоза. В лизосомах присутствуют бактерицидные агенты: миелопероксидаза, лизоцим, протеина- зы, кислые гидролазы, катионные белки, лактоферрин, супероксид дисмутаза — фермент, способствующий образованию H2O2, ОН', O2".
- Метаболическая активность. Активированный макрофаг секретирует более
60 факторов.
(а) Содержимое лизосом. При фагоцитозе происходит секреция содержимого лизосом с образованием H2O2, ОН", O2", обладающих высокой антибактериальной активностью.
(б) Медиаторы воспаления. В активированных макрофагах происходит окисление арахидоновой кислоты с образованием липидных медиаторов — простаг- ландина PGE2, лейкотриенов LTC4, LTD4, LTE4, фактора активации тромбоцитов.
(в) а-Интерферон, блокирующий репликацию вируса.
(г) Цитокины
- ИЛ-1, активирующий Т-лимфоциты и в меньшей степени — В-лимфоциты. ИЛ-1 совместно с липидными медиаторами вызывает симптомы острого воспаления, такие как лихорадка (пирексия) и лейкоцитоз со сдвигом влево.
- Фактор некроза опухоли (TNF) имеет сходный с ИЛ-1 эффект, в т.н. стимулирует образование миелоидных клеток.
(д) Ферменты, разрушающие внеклеточный матрикс: эластаза, гиалуронидаза, коллагеназа.
(е) Факторы роста, необходимые для пролиферации, миграции и дифференцировки клеток.
- Тромбоцитарный фактор роста (PDGF).
- Трансформирующие факторы роста a (TGFa) и р (TGFp).
- Роста фибробластов щелочной фактор (bFGF).
- Колониестимулирующие факторы M-CSF и G-CSF.
- Хемотаксис. Макрофаги мигрируют по градиенту концентрации некоторых факторов, вырабатываемых другими клетками.
(а) Фактор хемотаксиса макрофагов, секретируют активированные Т-лимфоциты.
(б) Факторы хемотаксиса для моноцитов/макрофагов, вырабатывают мигрировавшие в очаг воспаления нейтрофилы.
(в) Компоненты комплемента С5а, СЗ и лейкотриен LTB4.
(г) Факторы, выделяемые бактериями.
(д) Лимфокины, выделяемые активированными лимфоцитами.
(е) Фрагменты фибронектина.
- Факторы удержания макрофага в очаге в
Источник: Под ред. Э.Г. Улумбекова, Ю.А. Челышева, «Гистология (введение в патологию)» 1997