Надпочечники (рис. 9-19) — парные органы, расположенные ретроперитонеально у верхних полюсов почки на уровне Th12 и L1; масса надпочечника — примерно по 4 г. Фактически это две железы: кора (на долю коры приходится около 80% массы железы) и мозговая часть. Кора надпочечников синтезирует стероидные гормоны (минералокортикоиды, глюкокортикои- ды и андрогены), хромаффинная ткань мозговой части — катехоловые амины.
 А. Развитие. На 6-й неделе внутриутробного развития крупные мезодермальные клетки целомического эпителия образуют скопление на краниальном конце мезонефроса (см. главу 14 А 2). Вскоре формируется сосудистый полюс — место проникновения в центральную часть железы мигрирующих из нервного гребня будущих хромаффинных клеток мозгового вещества. На 8-й неделе мезодермальные клетки начинают интенсивно размножаться, и формируется две зоны коры: наружная — дефинитивная и эмбриональная (фетальная), расположенная на границе с мозговым веществом.
А. Развитие. На 6-й неделе внутриутробного развития крупные мезодермальные клетки целомического эпителия образуют скопление на краниальном конце мезонефроса (см. главу 14 А 2). Вскоре формируется сосудистый полюс — место проникновения в центральную часть железы мигрирующих из нервного гребня будущих хромаффинных клеток мозгового вещества. На 8-й неделе мезодермальные клетки начинают интенсивно размножаться, и формируется две зоны коры: наружная — дефинитивная и эмбриональная (фетальная), расположенная на границе с мозговым веществом.
- Фетальная кора. Клетки фетальной зоны коры надпочечника у плода крупные, с ацидофильной цитоплазмой и большим бледным ядром. На 10-20-й неделе фетальная кора быстро растёт, к 30-й неделе объём этой зоны увеличивается вдвое. В плодном периоде на долю фетальной зоны приходится большая часть коры надпочечника. Незадолго до рождения начинается дегенерация этой зоны, и к концу первого года жизни фетальная кора полностью исчезает.
Функция. Фетальная кора синтезирует преимущественно глюкокортикоид кортизол и дегид- роэпиандростерон, преобразуемый в печени плода в 16а-производные, из которых в плаценте образуется большая часть эстрогенов материнского организма (эстриол, эстрадиол и эстрон).
- Дефинитивная кора. Клетки дефинитивной зоны мелкие, имеют базофильную цитоплазму и плотное ядро. К 30-й неделе объём дефинитивной зоны значительно увеличивается. В течение первого года жизни в дефинитивной коре различимы клубочковая, пучковая и сетчатая зоны, дифференцировка
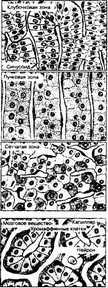
Рис. 9-19. Надпочечник. Непосредственно под капсулой в составе корковой части находится клубочковая зона. Она состоит из узких и более мелких по сравнению с другими зонами клеток. Крупные многоугольные клетки образуют параллельные тяжи пучковой зоны. Правильный ход тяжей нарушается в сетчатой зоне корковой части надпочечника. Мозговая часть представлена переплетающимися тяжами крупных хромаффинных клеток. К тяжам прилегают синусоидные кровеносные капилляры с широким просветом [из Jun- queira LC. Cameiro J, 1991)
корковой части надпочечника завершается к третьему году жизни. В дальнейшем кора продолжает увеличиваться в объёме (особенно мощно при половом созревании), достигая окончательных размеров к 20 годам.
- Мозговая часть. К 30-й неделе объём мозгового вещества увеличивается в 4 раза. В дальнейшем число хромаффинных клеток возрастает вплоть до завершения полового развития.
Функция. В плодном периоде хромаффинные клетки весьма чувствительны к малейшим изменениям гомеостаза (например, к изменениям р02), отвечая на них выбросом катехоловых аминов. При этом выброс адреналина возрастает в 2 раза, а норадреналина — в 3 раза.
Б. Регенерация. Полагают, что клетки коры и мозговой части железы способны поддерживать свою численность как путём их пролиферации, так и за счёт камбиального резерва.
- Кора. Считают, что непосредственно под капсулой органа находятся эпителиальные камбиальные клетки, постоянно дифференцирующиеся в эндокринные клетки коры. АКТГ стимулирует пролиферацию камбиального резерва. При хроническом избытке АКТГ развивается гиперплазия коры надпочечников с избыточной секрецией её стероидных гормонов.
- Мозговая часть. Вероятно, часть мигрировавших сюда клеток нервного гребня сохраняется в виде камбиального резерва.
Феохромоцитома. Эти малодифференцированные клетки — источник развития опухолей, продуцирующих избыточные количества катехоловых аминов.
В. Кровоснабжение железы осуществляется из трёх источников: верхней надпочечниковой артерии (ветвь нижней диафрагмальной артерии), средней надпочечниковой артерии (отходит от аорты), нижней надпочечниковой артерии (ветвь почечной артерии). Кровоснабжение органа весьма значительно.
Венозный дренаж коры происходит через синусоиды мозговой части. Это обстоятельство объясняет сочетанное вовлечение органа в развитие стрессовых ситуаций (адаптационный синдром, по Селье), т.к. глюкокортикоиды коры стимулируют секрецию адреналина из хромаффинных клеток.
Г. Иннервация. Мозговая часть органа имеет множество преганглионарных нервных волокон симпатического отдела нервной системы, хромаффинные клетки расценивают как пос- тганглионарное звено двигательной вегетативной иннервации.
Д. Кора надпочечника
- Строение (рис. 9-19). Железа окружена капсулой из плотной волокнистой соединительной ткани, от которой в толщу органа местами отходят соединительнотканные перегородки.
а. Строма состоит из поддерживающей эндокринные клетки рыхлой волокнистой соединительной ткани, содержащей огромное количество кровеносных капилляров с фенестрированным эндотелием.
б. Паренхима — совокупность эпителиальных тяжей, имеющих различную ориентацию на разном расстоянии от капсулы надпочечника. Это обстоятельство, а также характер гормонального стероидогенеза позволяют выделить в коре клубочковую, пучковую и сетчатую зоны.
- Пучковая зона (75% толщины коры). Тяжи эндокринных клеток и находящиеся между ними кровеносные капилляры расположены параллельно друг другу (в виде пучков). Здесь синтезируются глюкокортикоиды (преимущественно кортизол и кортизон [дегидрокортикостерон]), а также андрогены. Синтез глюкокортикоидов регулирует тропный гормон аденогипофиза — АКТГ. Клетки выглядят как вакуолизированные (рис. 9-20 А), поэтому их называют спонгиоциты; содержат округлые митохондрии с кристами в виде трубочек и пузырьков, разветвлённую гладкую эндоплазматическую сеть, элементы гранулярной эндоплазматической сети, лизосомы, многочисленные липидные включения и пигментные гранулы, содержащие липофусцин.
Вакуолизация клеток на гистологических препаратах отражает присутствие в цитоплазме спонгиоцитов значительного числа липидных капель (содержат преимущественно эфиры холестерина), вымываемых при подготовке препарата.
- Клубочковая зона (15% толщины коры). Пучки эндокринных клеток подворачиваются под капсулу и на срезе имеют вид клубочков. Здесь синтезируются минералокортикоиды (главным образом, альдостерон). Стимулятор синтеза альдостерона — ангиотензин II и в незначительной степени — АКТГ. Клетки (рис. 9-20 Б) имеют плотное округлое ядро с одним или двумя ядрышками, развитую гладкую эндоплазматическую сеть, некрупные митохондрии с пластинчатыми кристами, рибосомы, хорошо развитый комплекс Гольджи и небольшое количество мелких липидных включений.
Минералокортикоды синтезируются только в клубочковой зоне.
- Сетчатая зона (10% толщины коры). В наиболее глубоких частях коры тяжи эндокринных клеток переплетаются, образуя подобие сети. В сетчатой зоне синтезируются глюкокортикоиды и стероидные гормоны типа андрогенов (дегид- роэпиандростерон и андростендион). Тропный гормон — АКТГ. Гонадотропные гормоны гипофиза не влияют на секрецию гормонов в сетчатой зоне. В отличие от спонгиоцитов, клетки этой зоны содержат меньше липидных включений, но имеют крупные липофусциновые гранулы. Ядра некоторых клеток пикнотизированы. Липофусциновые гранулы содержат лизосомальную кислую фосфатазу и рассматриваются как деградирующие лизосомы.
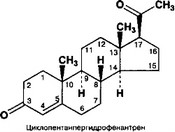
- Стероидогенез гормонов коры надпочечника, а также стероидных гормонов половой сферы — сложный процесс (из железы выделено не менее 50 стероидов), по-разному происходящий в отдельных зонах коры. Стероидные гормоны, их промежуточные продукты, а также фармакологические аналоги гормонов синтезируются на базе холестерина. Процессы стероидогенеза обеспечивают ферменты, локализованные в митохондриях и гладкой эндоплазматической сети. Все стероидные гормоны построены на основе 17- углеродной структуры — циклопентанпергидрофенантрена.
а. Циклопентанпергидрофенантрен (рис. 9-21) содержит 4 кольца (А, В, С, D).
- Нумерация углеродных атомов указана на рисунке 9-21.
- Дополнительные атомы углерода присоединяются по положениям 10 (C19), 13 (C18) и 17 (C20 и C21).
- Асимметричные атомы углерода — 3, 5, 8-10, 13, 14, 17 — определяют возможность стереоизомерии.
- Угловые метильные группы С-18 и С-19 расположены над плоскостью колец, их используют для определения ориентации стереоизомеров.
(а) цис и р —¦ замещения в плоскости колец.
(б) транс и а — замещения, расположенные сзади плоскости колец.
- Двойные связи указывают по номеру предшествующего атома углерода (например, A31 А4).
- Названия стероидов определяют по количеству угловых метильных групп.
(а) Эстран — одна угловая группа, 18 атомов углерода.
(б) Андростан — две группы, 19 атомов углерода.
(в) Прегнан — две группы + боковая цепь при С-17, 21 атом углерода.
- Дополняющие название гормона приставки и суффиксы
(а) Префиксы
- гидрокси и дигидрокси. Указывает на спирты.
- оксо (кето). Указывает на кетоны.
(iii) дезокси. Отсутствие гидроксила.
- изо или эпи. Изомерия по связям С—С, С—ОН, С—Н.
- дегидро. Указывает на утрату двух атомов водорода с образованием двойной связи.
- дигидро. По месту двойной связи присоединено два атома водорода.
- алло. 7/гакс-конфигурация колец А и В.
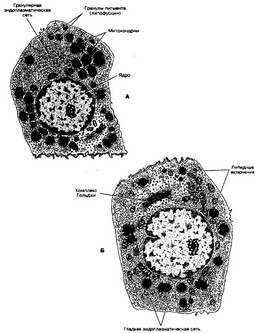
Рис. 9-20. Эндокринные клетки коры надпочечника. А — клетка пучковой зоны, вырабатывающая глюкокортикоиды и андрогены. Клетку называют спонгиоцитом, т.к. она имеет пенистый вид из-за множества липидных капель в цитоплазме; содержит округлые митохондрии с кристами в виде трубочек и пузырьков, разветвлённую гладкую эндоплазматическую сеть. Б — клетка клубочковой зоны, вырабатывающая альдостерон. Присутствуют развитая гладкая эндоплазматическая сеть, некрупные митохондрии с пластинчатыми кристами и небольшое количество мелких липидных включений [из Lentz TL, 1974]
- Суффиксы
(О ол, диол. Указывает на спирты.
- он. Указывает на кетон.
б. Холестерол [холестерин, (3|})-холест-5-ен-3-ол, C27H46O1 мол. масса 386,66 (рис. 9-21)] поступает в эндокринные клетки из крови и аккумулируется в виде его эфиров в липидных каплях. При стимуляции АКТГ эстераза отщепляет эфирную группировку, и холестерол поступает в митохондрии, где цитохром Р-450 (20,22-десмолаза), отщепляя боковую цепь, превращает его в прегненолон.
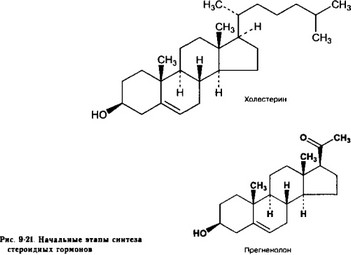
в. Прегненолон — Зр-гидрокси-5-прегнен-20-он (рис. 9-21). Это соединение — ключевое для синтеза всех стероидных гормонов (рис. 9-22, 9-23, 9-24). Из прегненолона образуются 17-гидроксипрегненолон (реакцию катализирует 17а-гидроксилаза) и далее — дегидро- эпиандростерон (реакцию катализирует С^.^-лиаза [17,20-десмолаза]), а также прогестерон (реакции катализируют система 3(5-гидроксистероид дегидрогеназы и А5 4-изомераза).
- 17а-Гидроксилаза локализована в гладкой эндоплазматической сети. Недостаточность 17а-гидроксилазы приводит к гиперсекреции дезоксикор-
тикостерона с последующей гипертензией. Поскольку фермент необходим и для синтеза половых стероидных гормонов, наряду с дефицитом эстрогенов наблюдается и дефицит андрогенов. Такие нарушения вызывают развитие гермафродитоподобных гениталий у мальчиков и первичную аменорею у женщин.
- С17_20-лназа (17,20-десмолаза) — митохондриальный фермент.
- ЗрТидроксистероид дегидрогеназа и Дм-изомераза локализованы в гладкой эндоплазматической сети.
г. Дегидроэпиандростерон (Зр-гидрокси-5-андростен-17-он) — предшественник андрогенов, его синтез происходит в пучковой и сетчатой зонах. В дальнейшем из дегидроэпиан- дростерона в клетках Лёйдига яичка образуются андростендион и тестостерон.
д. Прогестерон (4-прегнен-3,20-дион) в надпочечнике — практически полностью промежуточный продукт. Гидроксилирование прогестерона и образующегося из него
- гидроксипрогестерона (реакцию катализирует 21-гидроксилаза и далее lip-гид- роксилаза) приводит к образованию кортизола и кортикостерона. Из 17-гидроксипрогестерона формируется слабый андроген андростендион (4-андростен-3,17-дион).
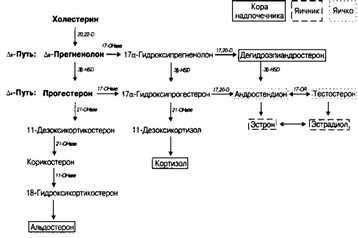
Рис. 9-22. Упрощённая схема стероидогенеза в коре надпочечника, яичнике и яичках.
20,22-D — 20,22-десмолаза, 17,20-D — 17,20-десмолаза, 17-OHase — 17-гидроксилаза, 21-OHase — 21-гидроксилаза, Il-OHase — 11-гидроксилаза, 30-HSD — система Зр-гидроксистероид дегидрогеназа/ Д5*-изомераза, 17-0R — 17-оксидоредуктаза (по Педиатрия, М.: ГЭОТАР, 1996)
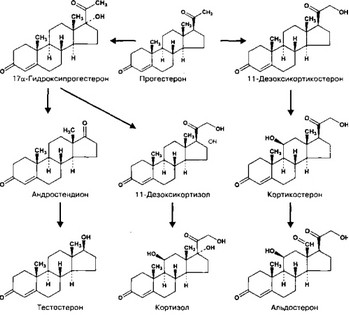
Рис. 9-23. Пути синтеза стероидных гормонов надпочечника
- 21-Гидроксилаза локализована в гладкой эндоплазматической сети.
Врождённая гиперплазия коры надпочечника. Наиболее частая её причина (gt;90%) — недостаточность 21-гидроксилазы (все формы — р). Дефицит кортизола стимулирует выработку АКТГ, что приводит к гиперплазии коры надпочечников и избыточной продукции андрогенов. Подобные нарушения при развитии плода часто вызывают изменения гениталий у девочек. При избытке андрогенов в постнатальном периоде происходит вирилизация в препубертатном возрасте и у молодых женщин. У младенцев мужского пола следствие избытка андрогенов во время развития плода — макрогенитосомия. В постнатальном периоде наступает преждевременное половое созревание. При тяжёлой (натрий-дефицитной) форме недостаточности — наряду с уменьшением синтеза кортизола — снижена продукция альдостерона; дефицит минералокортикоидов приводит к гипонатрие- мии, гиперкалиемии, дегидратации и гипотензии.
- НрТидроксилаза — фермент митохондрий. При недостаточности фермента развивается гиперплазия коры надпочечника (5% случаев).
е. Кортикостерон (11р,21-дигидрокси-4-прегнен-3,20-дион, соединение В [по Кёндаму]) — субстрат для синтеза альдостерона (присутствующие только в клетках клубочковой
зоны 18-гидроксилаза и 18-гидроксистероид-дегидрогеназа катализируют превращения кортикостерона).
Врождённые дефекты митохондриальной 18-гидроксилазы приводят к развитию недостаточности альдостерона (р).
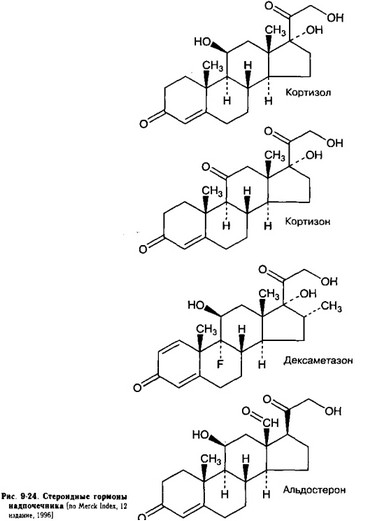
- Гормоны (рис. 9-24).
а. Глюкокортикоиды
- Основной глюкокортикоид, секретируемый надпочечниками, — кортизол; на его долю приходится 80%. Остальные 20% — кортизон, кортикостерон, 11-дезокси- кортизол и 11-дезоксикортикостерон.
(а) Кортизол (17-гидрокортизон, гидрокортизон) — 11р,17а,21-тригидрокси-4-прегнен- 3,20-дион, соединение F, C21H30O5, мол. масса 362,47 (рис. 9-24).
(б) Кортизон — 17а,21-дигидрокси-4-прегнен-3,11,20-трион, соединение E (рис. 9-24) — имеет крайне слабую активность.
(в) 11-Дезоксикортизол — 17,21-дигидрокси4-прегнен-3,20-дион, соединение S (рис. 9-23).
(г) 11-Дезоксикортикостерон — 21-гидрокси-4-прегнен-3,20-дион, соединение В (рис. 9-23) — преобладают минерапокортикоидные эффекты.
(д) Кортикостерон (см. VI Д 2 е, рис. 9-23).
(е) Дексаметазон — 11р,16а)-9-фтор-11,17,21-тригидрокси-16-метилпрегна-1,4-диен-3,20- дион, C22H29FO5, мол. масса 392,47, как и преднизон, преднизолон, метилпреднизолон, синтетический препарат (рис. 9-24).
- АКТГ — основной регулятор синтеза глюкокортикоидов. Для синтеза и секреции кортиколиберина, АКТГ и кортизола характерна выраженная суточная периодичность. При нормальном ритме сна увеличение секреции кортизола наступает после засыпания и достигает максимума при пробуждении.
- Метаболизм
(а) Связанные и свободные глюкокортикоиды. Глюкокортикоиды находятся в крови в виде восстановленных ди- и тетрагидро- производных. Более 90% глюкокортикоидов циркулирует в крови в связи с белками — альбумином и связывающим кортикоиды глобулином (транскортин, ген CBG, 122500,14q32.l). Около 8% кортизола плазмы — активная фракция.
(б) Время циркуляции определяется прочностью связывания с транскортином (время полужизни кортизола — до 2 часов, кортикостерона — менее I часа).
(в) Водорастворимые формы. Модификация липофильного кортизола осуществляется преимущественно в печени, формируются конъюгаты с глюкурони- дом и сульфатом. Модифицированные глюкокортикоиды — водорастворимые соединения, способные к экскреции.
(г) Экскреция. Конъюгированные формы глюкокортикоидов секретируются с жёлчью в ЖКТ, из них 20% теряется с калом, 80% всасывается в кишечнике. Из крови 70% глюкокортикоидов экскретируется с мочой.
- Функции глюкокортикоидов разнообразны — от регуляции метаболизма до модификации иммунного и воспалительного ответов.
(а) Глюконеогенез. Глюкокортикоиды стимулируют образование глюкозы в печени путём увеличения скорости глюконеогенеза (синтез ключевых ферментов) и стимуляции освобождения аминокислот (субстратов глюконеогенеза) в мышцах.
(б) Синтез гликогена усиливается за счёт активации гликогенсинтетазы.
(в) Липидный обмен
- Липолиз усиливается в конечностях.
- Липогенез усиливается в других частях тела (туловище и лицо).
- Эти дифференциальные эффекты придают больным (например, при синдроме Кушинга) характерный внешний вид.
(г) Белки и нуклеиновые кислоты
- Анаболический эффект в печени.
- Катаболический эффект в других органах.
(д) Иммунная система. В высоких дозах глюкокортикоиды выступают как иммунодепрессанты (применяют для предупреждения отторжения трансплантированных органов, при myasthenia gravis).
(е) Воспаление. Глюкокортикоиды имеют выраженный противовоспалительный эффект.
(ж) Синтез коллагена. Глюкокортикоиды при длительном применении ингибируют синтетическую активность фибробластов и остеобластов, в результате развиваются истончение кожи и остеопороз.
(з) Скелетные мышцы. Длительное применение глюкокортикоидов поддерживает катаболизм мышц, что приводит к их атрофии и мышечной слабости.
(и) Воздухоносные пути. Введение глюкокортикоидов может уменьшить отёк слизистой оболочки.
- Гиперкортицизм (синдром Кушинга) возникает в результате значительного повышения содержания глюкокортикоидов в крови.
(а) Причины
(О Двусторонняя гиперплазия коры надпочечников (болезнь Иценко- Кушинга) — наиболее частая причина развития синдрома.
(ii) Эктопический синтез АКТГ опухолями (например, овсяно-клеточная карцинома лёгкого, карцинома поджелудочной железы) также вызывает гиперплазию надпочечников и синдром Кушинга.
- Ятрогенный синдром Кушинга обычно развивается у больных, длительное время получающих глюкокортикоиды по поводу бронхиальной астмы, артрита и других заболеваний.
(б) Клиника
- Ожирение обусловлено влиянием избыточной секреции кортизола на распределение жира. Жир накапливается на лице, шее и туловище, в то время как конечности остаются тонкими.
- Кушингоид. Лунообразное лицо, бизоний горб (жировая подушка в области шеи) и надключичные жировые подушки придают больным характерную кушингоидную внешность.
- Гипертензия возникает в результате сосудистых и других эффектов кортизола, включая задержку натрия.
- Симптомы избытка андрогенов (например, олигоменорея, гирсутизм и акне).
- Пурпурные полосы живота (тонкая дряблая кожа растягивается подлежащим жиром).
- Атрофии и слабость мышц возникают из-за катаболических эффектов кортизола на мышечные белки.
- Остеопороз обусловлен повышенным метаболизмом кости и ингибирующим влиянием кортизола на синтез коллагена и всасывание кальция.
- Предрасположенность к возникновению синяков связывают с повышенной ломкостью капилляров.
- Психозы (особенно депрессия) — частый результат избытка кортизола.
- У детей возможна выраженная задержка роста.
- Гипокортицизм. Пониженная секреция адренокортикоидов может быть вызвана первичной надпочечниковой недостаточностью (болезнь Аддисона) или отсутствием стимуляции коры надпочечников АКТГ (вторичная надпочечниковая недостаточность).
Аддисонова болезнь — первичная недостаточность надпочечников. Атрофия коры надпочечников, обусловленная аутоиммунным процессом, — наиболее частая причина.
- Рецептор глюкокортикоидов (ген GCCR, 138040, 5q31-q32) — фактор транскрипции, полипептид с Mr 94 кД из семейства онкогенов erb-A. По аутосомно- доминантному типу наследуется несколько мутаций, приводящих к развитию нечувствительности мишеней к глюкокортикоидам.
б. Минералокортикоиды
- Альдостерон (11р,21-дигидрокси-3,20-диоксо-4-прегнен-18-аль, мол. масса 360,45) — основной минералокортикоид (рис. 9-24).
- Другие стероиды надпочечника, расцениваемые как глюкокортикоиды, имеют и минералокортикоидную активность, хотя — сравнительно с альдостероном — их суммарный вклад мал.
(а) Кортизол (рис. 9-24).
(б) 11-Дезоксикортизол (рис. 9-23).
(в) 11-Дезоксикортикостерон (рис. 9-23).
(г) Кортикостерон (см. VI Д 2 е, рис. 9-23).
- Регуляторы синтеза
(а) Ангиотензин II — компонент системы «ренин-ангиотензины» — главный регулятор синтеза и секреции альдостерона. Этот пептид стимулирует выброс альдостерона.
(б) Натриуретические факторы (см. главу 10 Б 2 б (3)) ингибируют синтез альдостерона.
(в) Na*. Эффекты гипо- и гипернатриемии реализуются через систему «ренин- ангиотензины».
(г) K+. Эффекты ионов калия не зависят от содержания в крови Na* и ангиотензина II.
- Гиперкалиемия стимулирует секрецию альдостерона.
- Гипокалиемия тормозит секрецию минералокортикоидов.
(д) Простагландины
- E1 и E1 стимулируют синтез альдостерона.
- Fta и Fja тормозят секрецию минералокортикоидов.
(е) Травмы и стрессовые состояния увеличивают секрецию альдостерона.
- Метаболизм. Альдостерон практически не связывается с белками плазмы крови, по этой причине время его циркуляции в крови (время полужизни) не превышает 15 минут. Альдостерон из крови удаляется печенью, где он трансформируется в экскретируемый почками тетрагидроальдостерон-3-глюкуронид.
- Функция минералокортикоидов — поддержание баланса электролитов жидкостей организма, осуществляется посредством влияния на реабсорбцию ионов в почечных канальцах.
(а) Na+. Альдостерон увеличивает реабсорбцию ионов натрия.
Задержка натрия приводит к увеличению содержания воды в организме и повышению АД.
(б) K+. Альдостерон увеличивает экскрецию ионов калия.
Потеря калия вызывает гипокалиемию.
(в) Cl', HCO3', H+. Альдостерон увеличивает реабсорбцию хлора, бикарбоната и почечную экскрецию ионов водорода.
- Рецептор альдостерона (ген MCR, 264350,4q31.1) — внутриклеточный полипептид с Mr 107 кД, связывает альдостерон (также глюкокортикоиды) и активирует
транскрипцию генов. Дефекты рецептора ведут к развитию псевдогипоальдосте- ронизма (задержка калия, потеря натрия, гипертензия при нормальной или даже повышенной секреции альдостерона).
- Альдостеронизм (гиперальдостеронизм) — гиперсекреция альдостерона.
(а) Причины: аденома или двусторонняя гиперплазия коры надпочечников, сердечная недостаточность, нефроз, вызванное диуретиками снижение объёма циркулирующей крови.
(б) Задержка натрия вызывает повышение АД.
(в) Потеря калия вызывает гипокалиемию, мышечную слабость, парестезии и тетанию (в тяжёлых случаях).
- Гипоальдостеронизм — пониженная секреция альдостерона.
(а) Потеря натрия приводит к гиповолемии, снижению сердечного выброса и кровотока в почках, слабости, гипотензии.
(б) Задержка калия ведёт к гиперкалиемии и нарушениям сердечного ритма,
в. Андрогены. В коре надпочечников синтезируются дегидроэпиандростерон (см. VIД 2 в,
рис. 15-1) и в меньшей степени андростендион (см. VI Д 2 д, рис. 9-23). Недостаточность ферментов стероидогенеза (11-, 17- и 21-гидроксилазы) приводит к вирилизации, преждевременному половому созреванию мальчиков \см. Vl Д 2 в (I), см. VIД 2 д (I)]. Е. Мозговая часть надпочечника. Эндокринную функцию выполняют происходящие из нервного гребня хромаффинные клетки. При активации симпатической нервной системы надпочечники выбрасывают в кровь катехоловые амины (адреналин и норадреналин). Катехоламины имеют широкий спектр эффектов (воздействие на гликогенолиз, липолиз, глюконеогенез, существенно влияние на сердечно-сосудистую систему). Вазоконстрикция, параметры сокращения сердечной мышцы и другие эффекты катехоловых аминов реализуются через а- и p-адренергические рецепторы на поверхности клеток-мишеней (ГМК, секреторные клетки, кардиомиоциты). Серьёзные клинические проблемы возникают при опухолях эндокринных клеток и их предшественников (нейробластома, феохромоцитома).
- Строма. В нежном поддерживающем каркасе, состоящем из рыхлой волокнистой соединительной ткани, расположены многочисленные сосудистые полости — венозные синусы — вариант капилляров типа синусоидов. Их отличительная особенность — значительный диаметр просвета, достигающий десятков и сотен микрон.
- Хромаффинные клетки (рис. 9-25) содержат гранулы с электроноплотным содержимым, которое с бихроматом калия даёт хромаффинную реакцию.
а. Локализация. Хромаффинные клетки — основной клеточный элемент мозговой части надпочечников и т.н. параганглиев, расположенных по ходу крупных артериальных стволов (например, каротидное тело). Мелкие скопления и одиночные хромаффинные клетки находят также в сердце, почках, симпатических ганглиях.
б. Цитология. Хромаффинные клетки содержат многочисленные митохондрии, выраженный комплекс Гольджи, элементы гранулярной эндоплазматической сети, многочисленные электроноплотные гранулы, содержащие преимущественно норадреналин и/или адреналин (по этому признаку хромаффинные клетки подразделяют на две субпопуляции), а также АТФ, энкефалины и хромогранины.
- Адреналин-содержащие гранулы гомогенны.
- Норадреналин-содержащие гранулы характеризуются повышенной плотностью содержимого в центральной части и наличием светлого ободка по периферии под мембраной гранулы.
- Гранулы, дополнительно содержащие дофамин, появляются при культивировании хромаффинных клеток in vitro.
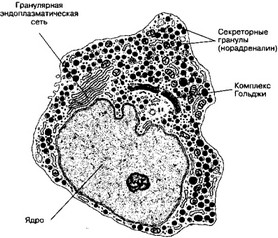
Рис. 9-25. Хромаффинная клетка. Характерны многочисленные электроноплотные гранулы с катехоламинами. Значительный объём клетки занимает крупное ядро. Клетка содержит митохондрии, выраженный комплекс Гольджи, элементы гранулярной эндоплазматической сети [из Lentz TL, 1974)
в. Секреция гормонов из хромаффинных клеток происходит в результате стимулирующего влияния со стороны преганглионарных симпатических волокон.
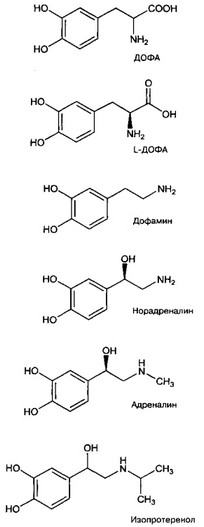
- Катехоловые амины синтезируются из тирозина по цепочке: тирозин (превращение тирозина катализирует тирозин гидроксилаза) -gt; ДОФА (ДОФА-декарбоксилаза) —gt; дофамин (дофамин-р-гидроксилаза) -gt; норадреналин (фенилэтаноламин-Лг-метилтрансфе- раза) —gt; адреналин.
а. Тирозин {см. рис. 9-15).
Тирозин гидроксилаза (ген TH, 191290, 11р15.5, КФ 1.14.16.2).
б. ДОФА (рис. 9-26). Эта аминокислота выделена из Vicia faba L, активна, и применяется как антипаркинсоническое средство её L-форма — леводопа (L-ДОФА, леводофа, 3-гидрокси-/,-тирозин, L-дигидроксифенилаланин).
ДОФА-декарбоксилаза (ген DDC, 107930, 7р11, КФ 4.1.1.28) участвует в синтезе дофамина, а также серотонина (из 5-гидрокситриптофана).
в. Дофамин — 4-(2-аминоэтил)пирокатехол (рис. 9-26).
Дофамин-|3-гидроксилаза (ген DBH, 223360, 9q34, КФ 1.14.17.1) секретируется из хромаффинных клеток и норадренергических терминалей вместе с норадреналином, её определение в крови предложено для оценки симпатической активности.
г. Норадреналин — деметилированный предшественник адреналина (2-амино-1-(3,4-ди- гидроксифенил)этанол (рис. 9-26).
Фенилэтаноламин-^У-метилтрансфераза (ген PNMT, 171190, 17q21-q22, КФ 2.1.1.28).
д. Адреналин — /-1-(3,4-дигидроксифенил)-2-(метиламино)этанол — только гуморальный фактор, в синаптической передаче не участвует.
е. Деградация адреналина и других биогенных аминов происходит под влиянием моно- аминооксидаз и катехол-О-метилтрансферазы. В результате образуются экскретируе- мые с мочой метанефрины и ванилилминдальная кислота — маркёры феохромоцитомы.
- Моноаминооксидазы (ген МАО, Xp11.23, 309850 и 309850, КФ 1.4.3.4) — митохондриальные ферменты.
(а) Тип А — изоформа, присутствующая преимущественно в нервной ткани.
(б) Тип В — изоформа различных внутренних органов.
- Катехол-о-метилтрансфераза (ген СОМТ, 22q 11.2, 116790, КФ 2.1.1.6) катализирует перенос метальной группы от S-аденозилметионина на катехоламины, а также на лекарственные препараты, применяемые при лечении гипертензии, бронхиальной астмы, болезни Паркинсона.
ж. Мутации генов вышеперечисленных ферментов приводят к блокированию синтеза соответствующих продуктов и накоплению субстратов.
Недостаточность катехоламинов мозговой части надпочечников редко приводит к развитию серьёзной патологии, но чрезмерная продукция адреналина (например, при феохро- моцитоме) гарантирует развитие гипертензии.
- Рецепторы катехоловых аминов — адренергические, дофамина — дофаминергические.
а. Адренорецепторы клеток-мишеней (включая синаптические) связывают норадреналин, адреналин и другие адренергические препараты, как активирующие (агонисты, адреномиметики), так и блокирующие (антагонисты, адреноблокаторы). Адренергические рецепторы подразделяют на а- и p-подтипы. Среди а- и p-адренорецепторов различают: а,- (например, постсинаптические в симпатическом отделе вегетативной нервной системы), а2- (например, пресинаптические в симпатическом отделе вегетативной нервной системы и постсинаптические в головном мозге), P1- (например, кардиомиоциты) и Р2-адренорецепторы.
Эффекты, опосредуемые разными адренергическими рецепторами. а.
Гликогенолиз. Усиление.
ГМК сосудов и мочеполовой системы. Сокращение.
ai
ГМК ЖКТ. Расслабление.
Липолиз. Подавление.
Инсулин, ренин. Подавление секреции.
P1
Кардиомиоциты. Увеличение силы сокращения.
Липолиз. Усиление.
Р,
Инсулин, глюкагон, ренин. Усиление секреции.
ГМК бронхов, ЖКТ, кровеносных сосудов, мочеполовой системы. Расслабление. Печень. Усиление гликогенолиза и глюконеогенеза.
Мышцы. Усиление гликогенолиза.
б. Дофаминовые рецепторы, как и адренергические, относят к мембранным рецепторам, связанным с G-белком (активируют либо ингибируют аденилатциклазу).
- Феохромоцитома — опухоль, состоящая из хромаффинных клеток, синтезирующих катехоламины. Феохромоцитому обнаруживают примерно у 0,5% больных гипертензией. Большая часть феохромоцитом — одиночные опухоли надпочечников, 10-20% расположено вне надпочечников, 1-3% — в грудной клетке или в области шеи. Около 20% опухолей множественные, 10% — злокачественные.
а. Семейный (поли)эндокринный аденоматоз (СПЭА) типа II и III. При этих синдромах развивается, наряду с опухолями других эндокринных желёз, и феохромоцитома.
б. Маркёры. Определение катехоловых аминов, продуцируемых большинством опухолей, полезно для установления диагноза, контроля эффективности лечения и диагностики рецидивов. Особенно информативно определение суточной экскреции вани- лилминдальной и гомованилиновой кислот.
- Нейробластома — злокачественное новообразование, возникающее из клеток нервного гребня и их малодифференцированных клеточных потомков в составе ганглиев симпатического отдела нервной системы, мозгового вещества надпочечников и параганглиев. Маркёры. Повышение содержания в крови нейроно-специфической енолазы и амплификация протоонкогена N-myc в опухолевых клетках ассоциированы с неблагоприятным прогнозом.
