Клинико-лабораторная характеристика наблюдавшихся больных
За период с 1985 по 2001 г. в отделении детской хирургии МОНИКИ находилось на лечении 470 детей с осложненными формами ОГДП. Торакальные хирурги в 60—70-х годах изменили термин "стафилококковая деструкция легких" у взрослых больных на "бактериальные деструкции легких" благодаря более частому обнаружению полиморфной бактериальной обсе- мененности и различных бактериальных ассоциаций в посевах из очагов деструкции.
ОГДП, являясь осложнением вирусно-бактериальной пневмонии, сама способна приводить к различным хирургическим осложнениям, к которым мы относим эмпиему плевры, пиоп- невмоторакс, бронхиальные свищи, длительно незаживающие внутрилегочные полости и сепсис.
Наибольшая заболеваемость наблюдалась с 1985 по 1990 г. (около 50 человек в год). Возраст детей составил от 1 мес до
- лет. Средний возраст больных — 3 года 1 мес. На долю больных до 3 лет приходилось 70,9 %; 40,3 % составили дети до 1 года. Это может быть объяснено несовершенством иммунной системы у детей младшей возрастной группы. За последние 5 лет количество детей до 1 года сократилось до 15 %, пик заболеваемости приходится на возраст от 1 года до 2 лет. Не отмечено какой-либо зависимости частоты легочной деструкции от половой принадлежности: количество мальчиков и девочек оказалось почти одинаковым— 177 (51,1 %) и 162 (47,9 %).
У 32,5 % детей заболевание начиналось с ОРВИ, с симптомов энтероколита — у 10 % детей. Изначально страдали такими заболеваниями, как ангина и отит, 12,5 % детей. Абдоминальный синдром встречался у 5 % детей, причем 2 ребенка были госпитализированы в хирургические стационары, где им была произведена диагностическая лапаротомия.
У всех заболевших грудных детей выявлен отягощенный преморбидный фон. По поводу перинатальной энцефалопатии наблюдались более 2/з детей, низкая масса тела при рождении отмечалась у 20 %, 2 детей были из двойни. По поводу гипер- тензионно-гидроцефального синдрома наблюдались 62 % детей, у 54 % имелась анемия. Патологическая беременность и осложненные роды встречались в 47 % случаев. На искусственном вскармливании с рождения находились 2/з детей. У 67,5 % матерей, чьи дети получали грудное молоко, выявлен стафилококк.
Госпитализация детей в районные стационары производилась в среднем через 7,4±4,0 дня после начала заболевания. Почти у половины больных (48,4 %), несмотря на адекватно проводимую в районных больницах терапию, отмечалось прогрессирование тяжести состояния, что проявлялось в ухудшении самочувствия, отрицательной рентгенологической картине. Наблюдалось возникновение таких осложнений, как пневмоторакс, эмпиема плевры, бронхолегочные свищи. У 50 % пациентов было произведено дренирование плевральной полости, у 32,3 % проводилась плевральная пункция.
Все дети поступали из районных стационаров на 16,8±6,8-е сутки от начала заболевания в тяжелом и очень тяжелом состоянии в связи с выраженной легочно-сердечной недостаточностью и интоксикацией. Фебрильная температура тела, тахикардия, одышка, кашель наблюдались почти у 90 % больных. Увеличение печени, связанное с правожелудочковой сердечной недостаточностью и токсическим гепатитом, отмечалось у 50 % детей. У 23 % поступивших потребовалась интенсивная терапия в условиях реанимационного отделения.
Наиболее часто процесс локализовался справа (69,3 %), левостороннее поражение наблюдалось у 21 % детей. Двусторонняя деструктивная пневмония встречалась в 9,7 % случаев, пиопневмоторакс — в 42,9 %, пиоторакс — в 27,4 %. Внутриле- гочные абсцессы наблюдались у У5 заболевших (21 %), напряженные буллы — в 8,1%. Гемоторакс имел место у одного ребенка с сахарным диабетом. Бронхолегочные свищи отягощали течение пневмонии в 38,7 % (131 наблюдение). За последние 5 лет двусторонние свищи отмечались у 4 больных. Срок возникновения легочно-плевральных осложнений от момента заболевания составил в среднем 23,36+10,8 дней. У Уб детей с ОГДП патологические бронхолегочные свищи образовывались через 11,76±4,9 дня после поступления в хирургические отделения. К этому времени присоединялись госпитальные штаммы инфекции.
Для углубленного изучения проанализированы результаты обследования и лечения 200 детей с ОГДП, имевших осложнения, у которых результаты клинических и лабораторных исследований были более полными.
Полученные данные свидетельствуют о том, что в начале заболевания ведущая роль в этиологии ОГДП принадлежит стафилококку (47,0 % в монокультуре и ассоциациях). С течением болезни частота высеваемости стафилококка в монокультуре снижается. Количество ассоциаций стафилококка с синегнойной палочкой, наоборот, возрастает. В разгар болезни и реконвалесценции увеличивается удельный вес синегнойной палочки в монокультуре и ассоциациях (49,5 и 61,5 %). К се-
Клинико-микробиологическая схема развития гнойно-воспалительных изменений в легких
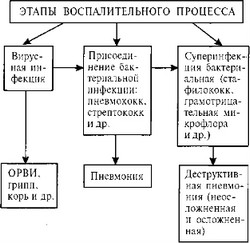


редине заболевания увеличивается частота идентификации прочей грамотрицательной микрофлоры (клебсиелла, Exoli, протей). Эти бактерии чаще встречаются в ассоциациях с другими микроорганизмами. Значение стрептококка в этиологии ОГДП относительно невелико (6,5 % в начале заболевания с последующим снижением до 1,0 %). Отсутствие роста в посевах клинического материала отмечено в 15,5 % случаев в начале заболевания. Это может быть связано с действием антибактериальных препаратов, наличием анаэробных микроорганизмов или с бактерицидным действием накапливающегося гноя.
Следует отметить, что если в начале заболевания подавляющее число микроорганизмов высевается в монокультуре, то в последующие периоды болезни пропорционально увеличивается число микробных ассоциаций.
По-видимому, этиологическая структура ОГДП не является величиной постоянной. Она имеет тенденцию к изменению вследствие смены лидирующей флоры, присоединения других микроорганизмов или их ассоциаций.
Вероятно, такая динамика этиологической структуры может быть результатом лечебных мероприятий, изменений иммунобиологической реактивности организма, контаминации гос-
Р питальной микрофлоры, дисбактериоза, ятрогенных воздейст- (!' вий.
Л ¦, Некую упрощенную, усредненную микробиологическую схе-
$: му развития воспалительного процесса в легких можно пред- 4lt; ставить следующим образом (схема 7.1).
;;¦ На схеме 7.1 видно, что гнойно-воспалительные изменения | в легких развиваются в результате последовательных суперин- %. фекций.
Й Согласно данной схеме, каждая суперинфекция должна определенным образом оказывать влияние на течение воспали- | тельного процесса. Чтобы определить зависимость течения ¦у воспалительного процесса от суперинфекции, мы исследовали ;¦ некоторые факторы АИР и гемограмму в двух группах детей с , . ОГДП с различной динамикой микрофлоры в содержимом I плевральной полости. Все дети были раннего возраста (в сред, нем 1,7±0,3 года).
ft .Первую группу (20 детей) составили больные, из плевральной полости которых выделены микроорганизмы в монокуль- , туре. В динамике состав микрофлоры у них не изменялся. В
- случаях это был стафилококк, а в 9 — синегнойная палочка. Во вторую группу вошли дети (60 больных), у которых моно- f культура (стафилококка — 31, синегнойной палочки — 12, /; ¦ I стрептококка — 10) в процессе заболевания сменилась другой ;'. микрофлорой или к ней присоединились другие микроорга- i- низмы (синегнойная палочка, E.coli, энтерококки, клебсиелла, $ протей и др.). Динамика исследованных показателей представ-
Ч лена на рис. 7.1.
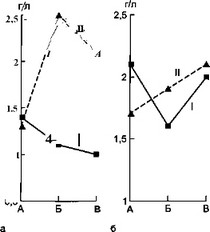
Обращает на себя внимание выраженная реакция IgM в ”... ответ на присоединение или смену микрофлоры. При этом ' какой-либо реакции со стороны IgG и IgA не обнаружено.
Очевидно, значительный подъем IgM в момент присоединения ' новой микрофлоры вполне закономерен. Являясь иммуноглобулином первичного иммунного ответа, IgM всегда первым
- Г реагирует на новый антигенный стимул, с переключением в ‘. последующих стадиях иммунного ответа на синтез IgG [Bep- шигора А.Е., 1980; Сохнин А.А., Черненко Е.Ф., 1984].
: Исследование нейтрофильного фагоцитоза показало, что на
; . всех стадиях заболевания ФА у больных с моноинфекцией ; . (первая группа) значительно превосходит ее у детей второй группы. Достоверного различия в показателе ФИ в обеих груп- ", пах больных не обнаружено.
у' Вероятно, присоединение новой микрофлоры происходит - чаще у детей с низкими показателями ФА. При этом очень ,, низкое количество фагоцитирующих нейтрофилов сохраняется .'.¦••У таких больных в течение всего заболевания, вплоть до кли-
amp; нического выздоровления.
: ¦ - Каких-либо различий в уровне гемолитического компле- ¦: мента в сравниваемых группах больных не обнаружено.
 мм/ч
мм/ч
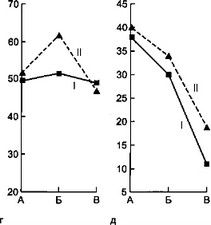 Рис. 7.1. Динамика некоторых показателей системы АИР при суперинфекции у детей с острой гнойной деструктивной пневмонией.
Рис. 7.1. Динамика некоторых показателей системы АИР при суперинфекции у детей с острой гнойной деструктивной пневмонией.
а — влияние суперинфекции на синтез IgM; б — влияние суперинфекции на синтез IgA; в — динамика лейкоцитоза при суперинфекции; г — влияние суперинфекции на количество сегментоядерных нейтрофилов; д — динамика СОЭ под влиянием суперинфекции: I — первая группа, II — вторая группа, А — начало болезни, Б — суперинфекция, В — выздоровление.
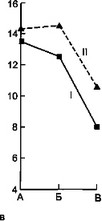
Параллельные исследования динамики лейкограммы у этих больных (рис. 7.2) выявило отчетливое повышение количества сегментоядерных нейтрофилов в момент смены или присоединения другой микрофлоры. Это сопровождается относительно низким количеством моноцитов во второй половине заболевания у больных второй группы. Кроме того, у этих больных наблюдается более низкий прирост количества эозинофилов в периферической крови.
Смена микрофлоры или присоединение других микроорганизмов, как правило, в той или иной степени влияет на клиническое течение заболевания. Так, у 48 % больных наблюдалась температурная реакция, совпадающая по времени с вышеуказанными изменениями лабораторных параметров. В 72 % случаев присоединились некоторые клинические признаки нарастания токсикоза: вялость, отсутствие аппетита, тахикардия, бледность кожных покровов. При этом в 15 % из них проявления токсикоза носили более острый характер и сопровождались значительным ухудшением состояния, подъемом температуры тела выше 38—39 °С, нарушением центральной и периферической гемодинамики, нарастанием легочно-сердечной недостаточности. У 12 % детей имела место отрицательная динамика рентгенологической картины легких, выражающаяся в нарастании инфильтративных изменений. В 18 % случаев наблюдалось изменение характера гнойного отделяемого из плевральной полости: изменялся цвет гноя, присоединялся геморрагический компонент. У 6 % больных увеличилось или появилось впервые продувание по дренажной системе.
Следует отметить, что в 28 % случаев каких-либо клинических признаков ухудшения состояния в момент суперинфекции не обнаружено, что может быть объяснено и без того тяжелым состоянием больных в этот период болезни.
Таким образом, смена этиологического фактора или присоединение какой-либо микрофлоры у детей с ОГДП сопровождается более или менее выраженным ухудшением общего состояния больных вследствие усиления воспалительной реакции.
Реакция системы АИР на новую контаминацию происходит по типу первичного иммунного ответа, о чем свидетельствует (и может быть критерием) значительное повышение продукции сывороточного IgM. Увеличение количества сегментоядерных нейтрофилов, снижение прироста эозинофилов в периферической крови является результатом активации воспалительного процесса в момент суперинфекции.
Вероятность суперинфекции значительно возрастает при снижении активности нейтрофильного фагоцитоза.
Следует подчеркнуть, что повышение уровня IgM в любой период заболевания можно рассматривать как довольно точный критерий суперинфекции, даже при отсутствии каких-
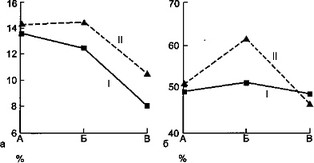
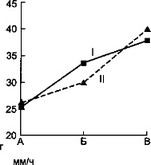
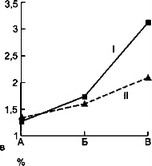
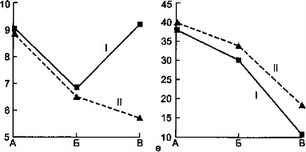
Рис. 7.2. Динамика показателей лейкограммы и СОЭ под влиянием суперинфекции у детей с острой гнойной деструктивной пневмонией, а — динамика лейкоцитоза при супенинфекции; б — влияние суперинфекции
либо клинических проявлений (или доклинических признаков).
Представленные выше данные имеют определенный практический интерес. Во-первых, свидетельствуя о непостоянстве этиологического фактора, они указывают на необходимость микробиологического контроля не реже 1 раза в 5—
- дней.
Во-вторых, контроль смены контаминации (микробиологический и иммунологический) необходим для своевременной коррекции лечения: замена или усиление антибактериальной терапии, проведение соответствующей иммунотерапии, детоксикации.
В-третьих, для профилактики суперинфекции следует своевременно проводить коррекцию системы АИР, обращая особое внимание на фагоцитарную функцию нейтрофилов.
Значительные трудности в лечении затяжных форм ОГДП побудили нас исследовать особенности течения воспалительного процесса у таких больных с целью его прогнозирования и коррекции.
Средняя продолжительность заболевания при ОГДП, по нашим данным, составила 41±0,5 сут (включая амбулаторный период и стационарное лечение по месту жительства). Однако у Уз Детей продолжительность болезни была более 60 дней. Эти случаи мы отнесли к понятию "затяжное течение" (63 наблюдения).
Следует отметить, что затяжное течение воспалительного процесса при ОГДП не всегда находится в прямой зависимости от степени тяжести острого периода болезни или от уровня эндотоксикоза. У 38 детей деструктивный процесс в легких сопровождался не столь резким токсикозом и легочно-сердечной недостаточностью по сравнению с другими 25 детьми. У 63 больных с затяжным течением ОГДП (первая группа) были изучены в динамике некоторые факторы системы АИР, гемограмма, микрофлора гнойного очага и ряд клинических параметров. Контрольную группу (вторая группа) составили 100 детей с продолжительностью болезни менее 60 дней. Результаты микробиологических исследований представлены на рис. 7.3.
У детей первой группы наибольший удельный вес в отделяемом из плевральной полости составила синегнойная палоч- пка в процессе всего заболевания, причем отмечался относительный рост этого микроорганизма к середине и концу бо-
на количество сегментоядерных нейтрофилов; в — влияние суперинфекции на количество эозинофилов; г — влияние суперинфекции на количество лимфоцитов; д — влияние суперинфекции на количество моноцитов; е — динамика СОЭ под влиянием суперинфекции: I — первая группа, II — вторая группа, ,; А— начало болезни, Б — суперинфекция, В — выздоровление.
%
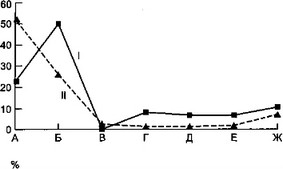
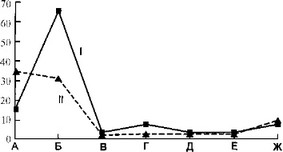
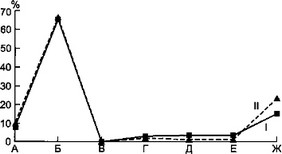
Рис. 7.3. Состав микрофлоры содержимого плевральной полости динамике у детей с острой гнойной деструктивной пневмонией.
лезни. Стафилококк имел меньший удельный вес с тенденцией к его сокращению к концу заболевания. У больных второй группы в начале болезни преобладал стафилококк, но в разгар заболевания частота идентификации стафилококка и синегнойной палочки была приблизительно одинаковой. К концу болезни отмечалось лидерство синегнойной палочки.
Динамика другой микрофлоры из плевральной полости не отличалась какой-либо закономерностью. Количество отрицательных результатов микробиологических исследований значительно больше у детей второй группы. У ряда больных первой группы (12 наблюдений) отмечалось нарастание абсолютного количества микроорганизмов в гнойном очаге.
Таким образом, у детей с затяжным течением ОГДП в течение всего заболевания в гнойном очаге доминирует синегнойная палочка, в то время как у больных группы сравнения в остром периоде болезни наибольший удельный вес принадлежит стафилококку.
Следовательно, идентификация синегнойнойпалочки из гной - ного очага в начале заболевания указывает на большую вероят - ностьразвития затяжного течения гнойно-воспалительного процесса в легких и плевре. К середине болезни этот критерий имеет значительно меньшую информативность.
Следует отметить, что у 29 детей первой группы наблюдалась смена микрофлоры гнойного очага или присоединение других микроорганизмов в процессе заболевания. Подобное изменение контаминации у детей второй группы отмечено только в 5 % случаев.
Результаты исследований уровней сывороточных IgG, IgM и IgA представлены в табл. 7.1.
Обращают на себя внимание относительно низкие значения IgG в начале болезни у детей первой группы (9,8±0,3 г/л), в то время как у больных второй группы в этот период заболевания уровень IgG был значительно выше (15,6±0,7 г/л). У детей первой группы наблюдался подъем уровня IgM в разгар болезни относительно исходных значений, чего не отмечено во второй группе (соответственно 1,7±0,1 и 1,4±0,1 г/л; t=2,l). Содержание сывороточного IgA у детей первой группы в начале и середине заболевания достоверно ниже, чем у больных второй группы (соответственно 1,5±0,07; 1,7±0,1 и 1,7±0,09; 2,1±0,2 г/л).
У детей первой группы существенно снижен уровень гемолитического комплемента (СН5о) на протяжении всего заболевания по сравнению с больными группы сравнения.
Л
а — в начале болезни; б — в разгар болезни; в — в конце болезни: I — первая группа, II — вторая группа, А — стафилококк, Б — синегнойная палочка, В — стрептококк, Г — протей, Д — клебсиелла, Е — энтерококк, Ж — роста нет.
Динамика уровней иммуноглобулинов классов G, М, А у детей с затяжным течением острой гнойной деструктивной пневмонии (первая группа) и группы сравнения (вторая группа)
|
Группа |
][gG, г/л |
|
IgM, г/л |
|
|
IgA, г/л1 |
|||
|
детей |
начало болезни |
раз гар болез ни |
вы- здо- ровле- ние |
начало болезни |
раз гар болез ни |
вы- здо ров- ление |
нача ло бо лезни |
раз гар болез ни |
вы- здо- ровле- ние |
|
Первая |
9,8± |
16,9± |
16,3± |
1,5± |
1,7± |
i,6± |
1,5± |
1,7± |
1,35± |
|
(п=63) |
±0,3 |
±1,2 |
±0,6 |
±0,08 |
±0,1 |
±0,1 |
±0,07 |
±0,1 |
±0,09 |
|
Вторая |
15,6± |
19,0± |
13,7± |
1,5± |
1,4+ |
1,5+ |
1,7± |
2,1± |
1,4± |
|
(п=30) |
±0,7 |
±1,6 |
±0,5 |
±0,1 |
±0,1 |
±0,2 |
+0,09 |
±0,2 |
±0,15 |
|
Достоверность различий (t) |
7,6 |
1,05 |
з,з |
0 |
2,1 |
0,5 |
2,0 |
2,0 |
0,3 |
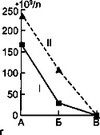
Результаты исследования фагоцитарной функции нейтрофилов представлены на рис. 7.4.
В начале заболевания и в разгар его у детей первой группы резко выражен дефицит ФА, причем прирост ФА в процессе заболевания у них происходил медленнее по сравнению с больными второй группы. В конце болезни у детей первой группы ФА оставался достоверно ниже. Следует отметить, что
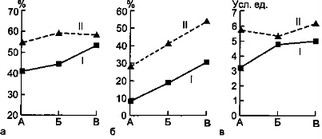
Рис. 7.4. Динамика некоторых показателей системы АИР у детей с острой гнойной деструктивной пневмонией.
а — динамика гемолитического комплемента; б — динамика фагоцитарной активности нейтрофилов; в — динамика фагоцитарного индекса нейтрофилов: I — первая группа, II — вторая группа, А — начало болезни, Б — разгар болезни, В — выздоровление.
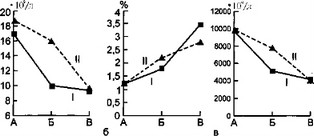
Рис. 7.5. Динамика лейкограммы у детей с затяжным течением острой гнойной деструктивной пневмонии, а — динамика лейкоцитоза; б — динамика количества эозинофилов; в — динамика количества сегментоядерных нейтрофилов; г —динамика количества юных нейтрофилов: I — первая группа, II — вторая группа, А — начало болезни, Б — разгар болезни, В — выздоровление.
 такая динамика показателей ФА происходит на фоне снижения общего количества нейтрофилов.
такая динамика показателей ФА происходит на фоне снижения общего количества нейтрофилов.
Значения ФИ у детей первой группы также достоверно ниже в течение всего заболевания относительно группы сравнения.
При анализе лейкоцитарной формулы крови (рис. 7.5) у детей первой группы отмечено резкое падение количества лей, коцитов к разгару заболевания (с 16,8±1,0 • 109/л до 9,9±0,5 • 109/л) по сравнению со второй группой, где число лейкоцитов снизилось с 18,6±1,3 • 109/лдо 15,8± 1,2 • 109/л. Подобная динамика наблюдалась и в отношении абсолютного количества сегментоядерных нейтрофилов. У детей первой группы имело место выраженное снижение числа сегментоядерных нейтрофилов не только по отношению к группе сравнения (соответственно 5,1282±3,336 • 109/л и 7,7682±0,5753 • 109/л; t=3,9), но и относительно исходного значения (9,7866±0,8498 • 109/л и 5,1282± ±0,336 • 109/л; 1=2,2).
Динамика палочкоядерных нейтрофилов соответствовала той же тенденции: резкое снижение их в разгар болезни у детей первой группы по сравнению с контрольными данными (соответственно 4,4 и 6,6 % или 0,5529±0,0629 • 109/л и 0,9086±
¦' ±0,0842 • 109/л; 1=3,4) и значительное их снижение относитель
но исходного показателя (с 9,2 до 4,3 % или с 1,6775+0,0909 х х 109/л до 0,5529+0,0629 • 109/л). При этом к концу заболевания количество этих клеток у детей первой группы оставалось достоверно ниже (соответственно 1,8+0,2 % и 3,0+0,4 % или
- 1898±0,0283 . Ю9/л и 0,3629±0,0405 • 107л). Подобная ситуация характерна и для юных форм нейтрофилов с достаточно высокой статистической достоверностью. Достоверного различия в процентном и абсолютном количестве эозинофилов в исследуемых группах не обнаружено.
У детей первой группы наблюдалось относительно низкое абсолютное число лимфоцитов в начале заболевания (3,4839+ ±0,1935 • 109/л; контрольная группа — 4,5558+0,2365 • 109/л; t=3,5) с выраженной тенденцией к снижению в разгар болезни по отношению к исходной величине (3,4839±0,1935 • 109/л и 2,9542±0,202 • 109/л; t=l,9) и относительно группы сравнения (соответственно 2,9542+0,202 • 109/л и 4,4606±0,2Ш • 109/л; t=5,l). При этом в разгар болезни статистически достоверно различие и процентного количества лимфоцитов в группах (первая группа — 26,2± 1,2 % и вторая — 36,4+2,0 %; t=2,8). К концу заболевания процентное и абсолютное количество лимфоцитов в обеих группах практически одинаково.
Содержание моноцитов в периферической крови у детей первой группы было значительно ниже по сравнению с контрольными данными (соответственно 6,5+0,5 % и 8,3+0,5 %; t=2,65 и 1,1610+0,1151 • 109/л и 1,5349±0,1292 • 109/л; t=2,2). Единственный клеточный элемент периферической крови, количество которого было повышено в начале заболевания у детей первой группы, — это базофилы. Рост их, вероятно, обусловливался более выраженным аллергическим компонентом воспалительной реакции у этих больных.
Кроме вышеуказанных показателей параметрической статистики, характеризующей затяжное течение воспалительного процесса у детей с ОГДП, можно выделить ряд клинико-иммунологических параллелей, свойственных больным с наиболее неблагоприятным течением болезни. Так, у 4 больных (из 63) с очень тяжелым и затяжным течением заболевания отмечалось резкое снижение уровней сывороточных иммуноглобулинов всех классов в разгар болезни, а у 6 детей наблюдалось угнетение синтеза IgG и IgM в течение всего заболевания. С другой стороны, очень высокие показатели IgG и IgM во второй половине болезни, наблюдавшиеся у 16 детей, сопровождались значительным увеличением продолжительности заболевания и стационарного лечения.
Следует отметить, что у детей с низкими уровнями IgG и IgM наблюдалось значительное снижение абсолютного количества лимфоцитов.
Таким образом, затяжное течение гнойно-воспалительных процессов в легких и плевре у детей связано во всех случаях с контаминацией грамотрицательной микрофлоры, наибольший удельный вес среди которой имеет синегнойная палочка.
Этиологические факторы затяжных форм ОГДП постоянно изменяются в течение всего заболевания. Смена микрофлоры или присоединение нового микроорганизма сопровождается, как правило, более или менее выраженной отрицательной динамикой болезни с соответствующими изменениями клиникоиммунологических показателей и гемограммы.
Для всех детей с затяжными формами ОГДП характерны нарушения системы АИР. Наиболее глубокие дефекты наблюдаются в системе фагоцитирующих нейтрофилов и содержании гемолитического комплемента.
Снижение абсолютного количества практически всех клеточных элементов периферической крови (кроме базофилов) в остром периоде ¦ заболевания свидетельствует об угнетении ге- мопоэтической функции костного мозга у таких больных. Резкий подъем абсолютного и процентного количества базофилов крови является неблагоприятным фактором, что может быть связано с активацией медиаторов воспаления.
Затяжное течение ОГДП у детей сопровождается дисимму- ноглобулинемией. У большинства детей отмечаются относительно низкие исходные уровни IgG и IgA.
Следует подчеркнуть, что резкое повышение уровней сывороточных иммуноглобулинов различных классов так же неблагоприятно, как и их угнетение.
Исходя из анализа исследованных лабораторных параметров, можно выделить ряд критериев, позволяющих прогнозировать и своевременно устранять затяжные гнойно-воспалительные процессы в легких.
Неблагоприятными факторами, указывающими на возможное длительное и трудно управляемое течение ОГДП у детей, являются следующие.
- Преобладание синегнойной палочки в содержимом плевральной полости.
- Присоединение новой микрофлоры в гнойном очаге в процессе заболевания.
- Относительно низкие исходные уровни IgG в начале заболевания (lt;10,0 г/л) и относительно высокие — во второй его половине (gt;16,0 г/л).
- Увеличение синтеза IgM в середине заболевания и во второй его половине.
- Резкое снижение количества фагоцитирующих нейтрофилов и их ФИ параллельно со снижением содержания сегментоядерных нейтрофилов в периферической крови.
- Снижение абсолютного количества всех клеточных элементов лейкограммы.
Исходя из указанных положений, можно определить ряд
превентивных мероприятий, направленных на снижение вероятности развития затяжного течения ОГДП.
Во-первых, это — своевременная профилактика суперинфекции и борьба с ней. Во-вторых, — адекватная заместительная терапия гипериммунными препаратами в начале заболевания. В-третьих, — устранение дефектов нейтрофильного фагоцитоза. И наконец, — стимуляция гемопоэтической функции костного мозга. Очевидно, наибольший эффект этих мероприятий возможен при условии систематического иммуноми- кробиологического контроля.
А так же в разделе «Клинико-лабораторная характеристика наблюдавшихся больных »
- Зависимость контаминации от состояния системы антиинфекционной резистентности организма
- Общие принципы комплексной терапии у детей с острой гнойной деструктивной пневмонией и ее осложнениями
- Детоксикация организма у детей с острой гнойной деструктивной пневмонией
- Местное лечение детей с острой гнойной деструктивной пневмонией
- Результаты лазерной терапии при осложненных формах деструктивной пневмонии