Действие цитокинов на клетки-мишени опосредуются через специфические рецепторы, связывающие цитокины с очень высокой аффинностью, причем отдельные цитокины могут использовать
общие субъединицы рецепторов. Каждый цитокин связывается со своим специфическим рецептором.
Рецепторы цитокинов представляют собой трансмембранные белки и делятся на 5 основных типов. Наиболее распространен так называемый гемопоэтиновый тип рецепторов, имеющих два экстраклеточных домена, один из которых содержит общую последовательность аминокислотных остатков двух повторов триптофана и серина, разделенных любой аминокислотой (WSXWS-мотив). Второй тип рецепторов может иметь два внеклеточных домена с большим количеством консервативных цистеинов. Это рецепторы семейства ИЛ-10 и ИФН. Третий тип представлен рецепторами цитокинов, относящихся к группе ФНО. Четвертый тип рецепторов цитокинов принадлежит к суперсемейству иммуноглобулиновых рецепторов, имеющих внеклеточные домены, напоминающие по строению домены молекул иммуноглобулинов. Пятый тип рецепторов, связывающих молекулы семейства хемокинов, представлен трансмембранными белками, пересекающими клеточную мембрану в 7 местах. Рецепторы цитокинов могут существовать в растворимой форме, сохраняя способность связывать лиганды (Кетлинский С.А. и др., 2008).
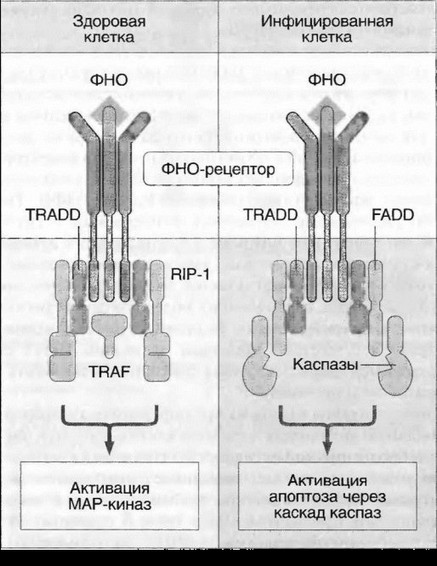
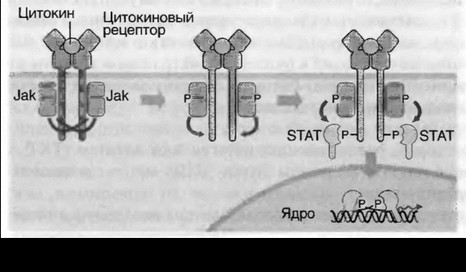
Цитокины способны влиять на пролиферацию, дифференцировку, функциональную активность и апоптоз клеток-мишеней (см. рис. 7.1). Проявление биологической активности цитокинов в клетках-мишенях зависит от участия различных внутриклеточных систем в передаче сигнала от рецептора, что связано с особенностями клеток-мишеней. Сигнал к апоптозу проводится в том числе с помощью специфического участка семейства рецепторов ФНО, так называемого домена «смерти» (рис. 7.5, см. цв. вклейку). Дифференцировочный и активирующий сигналы передаются посредством внутриклеточных белков Jak-STAT — сигнальных трансдукторов и активаторов транскрипции (рис. 7.6, см. цв. вклейку). G-белки участвуют в передаче сигнала от хемокинов, что приводит к усилению миграции и адгезии клеток.
В комплексный анализ системы цитокинов входит следующее.
I. Оценка клеток-продуцентов.
1. Определение экспрессии:
• генов цитокинов (ПЦР); белковых молекул цитокинов (оценка
цитокинсинтезирующей функции мононуклеарных клеток человека).
В настоящее время разработаны многочисленные методы оценки системы цитокинов, которые дают разноплановую информацию. Среди них различают:
Приводим краткую характеристику этих методов.
С помощью молекулярно-биологических методов можно исследовать экспрессию генов цитокинов, их рецепторов, сигнальных молекул, изучать полиморфизм указанных генов. В последние годы выполнено большое число работ, выявивших ассоциации между вариантами аллелей генов молекул системы цитокинов и предрасположенностью к ряду заболеваний. Изучение аллельных вариантов генов цитокинов может дать информацию о генетически запрограммированной продукции того или иного цитокина. Наиболее чувствительной считается полимеразная цепная реакция в реальном времени — ПЦР-РВ (см. гл. 6). Метод гибридизации in situ позволяет уточнить тканевую и клеточную локализацию экспрессиии цитокиновых генов.
Количественное определение цитокинов в биологических жидкостях и в культурах мононуклеарных клеток периферической крови методом ИФА можно охарактеризовать следующим образом. Поскольку цитокины являются локальными медиаторами, более целесообразно измерять их уровни в соответствующих тканях после экстракции тканевых протеинов или в естественных жидкостях, например в слезе, смывах из полостей, моче, амниотической жидкости, спинномозговой жидкости и т.д. Уровни цитокинов в сыворотке или других биологических жидкостях отражают текущее состояние иммунной системы, т.е. синтез цитокинов клетками организма in vivo.
Определение уровней продукции цитокинов мононуклеарами периферической крови (МНК) показывает функциональное состояние клеток. Спонтанная продукция цитокинов МНК в культуре свидетельствует, что клетки уже активированы in vivo. Индуцированный (различными стимуляторами, митогенами) синтез цитокинов отражает потенциальную, резервную способность клеток отвечать на антигенный стимул (в частности, на действие лекарственных препаратов). Сниженная индуцированная продукция цитокинов может служить одним из признаков иммунодефицитного состояния. Цитокины не специфичны в отношении конкретного антигена. Поэтому специфическая диагностика инфекционных, аутоиммунных и аллергических заболеваний с помощью определения уровня тех или иных цитокинов невозможна. В то же время оценка уровней цитокинов позволяет получить данные о тяжести воспалительного процесса, его переходе на системный уровень и прогнозе, функциональной активности клеток иммунной системы, о соотношении ТЫ- и ТЬ2-клеток, что очень важно при дифференциальной диагностике ряда инфекционных и иммунопатологических процессов.
В биологических средах можно определить цитокины количественно с помощью целого ряда методов иммуноанализа, используя поликлональные и моноклональные антитела (см. гл. 4). ИФА позволяет узнать, каковы точные концентрации цитокинов в биологических жидкостях организма. Иммуноферментное выявление цитокинов имеет ряд преимуществ перед другими методами (высокая чувствительность, специфичность, независимость от присутствия антагонистов, возможность точного автоматизированного учета, стандартизации учета). Однако и этот метод имеет свои ограничения: ИФА не характеризует биологическую активность цитокинов, может давать ложные результаты за счет перекрестно-реагирующих эпитопов.
Биологическое тестирование проводят на основе знания основных свойств цитокинов, их действия на клетки-мишени. Изучение биологических эффектов цитокинов позволило разработать четыре разновидности тестирования цитокинов:
ИЛ-1 определяют по стимулирующему действию на пролиферацию мышиных тимоцитов, активированных митогеном in vitro; ИЛ-2 — по способности стимулировать пролиферативную активность лимфобластов; по цитотоксическому действию на мышиные фибробласты (L929) тестируют ФНОа и лимфотоксины. Колониестимулирующие факторы оценивают по их способности поддерживать рост костномозговых предшественников в виде колоний в агаре. Противовирусную активность ИФН выявляют по угнетению цитопатического действия вирусов в культуре диплоидных фибробластов человека и опухолевой линии фибробластов мышей L-929.
Созданы клеточные линии, рост которых зависит от присутствия определенных цитокинов. В табл. 7.1 представлен список клеточных линий, используемых для тестирования цитокинов. По способности индуцировать пролиферацию чувствительных клеток-мишеней проводят биотестирование ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-7, ИЛ-15 и др. Однако эти методы тестирования отличаются недостаточной чувствительностью и информативностью. Молекулы ингибиторов и антагонистов могут маскировать биологическую активность цитокинов. Некоторые цитокины проявляют общую биологическую активность. Тем не менее эти методы идеальны для тестирования специфической активности рекомбинантных цитокинов.
Таблица 7.1. Клеточные линии, используемые для тестирования биологической активности цитокинов
Окончание табл. 7.1
Лабораторная работа 7-1
Определение биологической активности ИЛ-1 по комитоген-
ному действию на пролиферацию тимоцитов мышей
В основе метода биологического тестирования ИЛ-1 лежит способность цитокина стимулировать пролиферацию мышиных тимоцитов.
ИЛ-1 может быть определен в культуре моноцитов, стимулированных ЛПС, а также в любой биологической жидкости организма.
Необходимо обратить внимание на ряд деталей.
Порядок работы
тср в присутствии исследуемого образа
тср в контроле
где тср — среднее число импульсов в 3 лунках.
Если тимоциты отвечают на стимуляцию стандартным ИЛ-1, то индекс стимуляции исследуемого образца, превышающий 3, достоверно свидетельствует об ИЛ-1-активности.
Биоанализ является единственным методом для оценки функционирования цитокина, но данный метод должен быть дополнен разными видами соответствующего контроля на специфичность с использованием моноклональных антител. Добавление определенных моноклональных антител к цитокину в культуру блокирует биологическую активность цитокина, что доказывает: сигналом к пролиферации клеточной линии служит определяемый цитокин.
Использование биоанализа для выявления интерферона. Принцип оценки биологической активности ИФН основан на его противовирусном действии, которое определяется по степени ингибиции размножения тест-вируса в культуре клеток.
В работе могут быть использованы клетки, чувствительные к действию ИФН: первично трипсинизированные клетки-фибробласты эмбрионов кур и человека, перевиваемые клетки диплоидных фибробластов человека и культура мышиных клеток (L929).
При оценке противовирусного действия ИФН целесообразно использовать вирусы с коротким циклом размножения, высокой чувствительностью к действию ИФН: вирус энцефаломиелита мышей, везикулярного стоматита мыши и др.
общие субъединицы рецепторов. Каждый цитокин связывается со своим специфическим рецептором.
Рецепторы цитокинов представляют собой трансмембранные белки и делятся на 5 основных типов. Наиболее распространен так называемый гемопоэтиновый тип рецепторов, имеющих два экстраклеточных домена, один из которых содержит общую последовательность аминокислотных остатков двух повторов триптофана и серина, разделенных любой аминокислотой (WSXWS-мотив). Второй тип рецепторов может иметь два внеклеточных домена с большим количеством консервативных цистеинов. Это рецепторы семейства ИЛ-10 и ИФН. Третий тип представлен рецепторами цитокинов, относящихся к группе ФНО. Четвертый тип рецепторов цитокинов принадлежит к суперсемейству иммуноглобулиновых рецепторов, имеющих внеклеточные домены, напоминающие по строению домены молекул иммуноглобулинов. Пятый тип рецепторов, связывающих молекулы семейства хемокинов, представлен трансмембранными белками, пересекающими клеточную мембрану в 7 местах. Рецепторы цитокинов могут существовать в растворимой форме, сохраняя способность связывать лиганды (Кетлинский С.А. и др., 2008).
Цитокины способны влиять на пролиферацию, дифференцировку, функциональную активность и апоптоз клеток-мишеней (см. рис. 7.1). Проявление биологической активности цитокинов в клетках-мишенях зависит от участия различных внутриклеточных систем в передаче сигнала от рецептора, что связано с особенностями клеток-мишеней. Сигнал к апоптозу проводится в том числе с помощью специфического участка семейства рецепторов ФНО, так называемого домена «смерти» (рис. 7.5, см. цв. вклейку). Дифференцировочный и активирующий сигналы передаются посредством внутриклеточных белков Jak-STAT — сигнальных трансдукторов и активаторов транскрипции (рис. 7.6, см. цв. вклейку). G-белки участвуют в передаче сигнала от хемокинов, что приводит к усилению миграции и адгезии клеток.
В комплексный анализ системы цитокинов входит следующее.
I. Оценка клеток-продуцентов.
1. Определение экспрессии:
- рецепторов, распознающих патоген или антиген (ТКР, TLR) на уровне генов и молекулы белка (ПЦР, метод проточной цитоф- луориметрии);
- адаптерных молекул, проводящих сигнал, запускающий транскрипцию цитокиновых генов (ПЦР и др.);


• генов цитокинов (ПЦР); белковых молекул цитокинов (оценка
цитокинсинтезирующей функции мононуклеарных клеток человека).
- Количественное определение субпопуляций клеток, содержащих те или иные цитокины: Thl, Th2 ТЫ7 (метод внутриклеточного окрашивания цитокинов); определение количества клеток, секрети- рующих определенные цитокины (метод ELISPOT, см. гл. 4).
- Оценка цитокинов и их антагонистов в биологических средах организма.
- Тестирование биологической активности цитокинов.
- Количественное определение цитокинов с помощью ИФА.
- Иммуногистохимическое окрашивание цитокинов в тканях.
- Определение соотношения оппозитных цитокинов (про- и противовоспалительных), цитокинов и антагонистов рецепторов цитокинов.
- Оценка клеток-мишеней.
- Определение экспрессии рецепторов цитокинов на уровне генов и белковой молекулы (ПЦР, метод проточной цитофлуориме- трии).
- Определение сигнальных молекул во внутриклеточном содержимом.
- Определение функциональной активности клеток-мишеней.
В настоящее время разработаны многочисленные методы оценки системы цитокинов, которые дают разноплановую информацию. Среди них различают:
- молекулярно-биологические методы;
- методы количественного определения цитокинов с помощью иммуноанализа;
- тестирование биологической активности цитокинов;
- внутриклеточное окрашивание цитокинов;
- метод ELISPOT, позволяющий выявить цитокины вокруг единичной цитокинпродуцирующей клетки;
- иммунофлюоресценцию.
Приводим краткую характеристику этих методов.
С помощью молекулярно-биологических методов можно исследовать экспрессию генов цитокинов, их рецепторов, сигнальных молекул, изучать полиморфизм указанных генов. В последние годы выполнено большое число работ, выявивших ассоциации между вариантами аллелей генов молекул системы цитокинов и предрасположенностью к ряду заболеваний. Изучение аллельных вариантов генов цитокинов может дать информацию о генетически запрограммированной продукции того или иного цитокина. Наиболее чувствительной считается полимеразная цепная реакция в реальном времени — ПЦР-РВ (см. гл. 6). Метод гибридизации in situ позволяет уточнить тканевую и клеточную локализацию экспрессиии цитокиновых генов.
Количественное определение цитокинов в биологических жидкостях и в культурах мононуклеарных клеток периферической крови методом ИФА можно охарактеризовать следующим образом. Поскольку цитокины являются локальными медиаторами, более целесообразно измерять их уровни в соответствующих тканях после экстракции тканевых протеинов или в естественных жидкостях, например в слезе, смывах из полостей, моче, амниотической жидкости, спинномозговой жидкости и т.д. Уровни цитокинов в сыворотке или других биологических жидкостях отражают текущее состояние иммунной системы, т.е. синтез цитокинов клетками организма in vivo.
Определение уровней продукции цитокинов мононуклеарами периферической крови (МНК) показывает функциональное состояние клеток. Спонтанная продукция цитокинов МНК в культуре свидетельствует, что клетки уже активированы in vivo. Индуцированный (различными стимуляторами, митогенами) синтез цитокинов отражает потенциальную, резервную способность клеток отвечать на антигенный стимул (в частности, на действие лекарственных препаратов). Сниженная индуцированная продукция цитокинов может служить одним из признаков иммунодефицитного состояния. Цитокины не специфичны в отношении конкретного антигена. Поэтому специфическая диагностика инфекционных, аутоиммунных и аллергических заболеваний с помощью определения уровня тех или иных цитокинов невозможна. В то же время оценка уровней цитокинов позволяет получить данные о тяжести воспалительного процесса, его переходе на системный уровень и прогнозе, функциональной активности клеток иммунной системы, о соотношении ТЫ- и ТЬ2-клеток, что очень важно при дифференциальной диагностике ряда инфекционных и иммунопатологических процессов.
В биологических средах можно определить цитокины количественно с помощью целого ряда методов иммуноанализа, используя поликлональные и моноклональные антитела (см. гл. 4). ИФА позволяет узнать, каковы точные концентрации цитокинов в биологических жидкостях организма. Иммуноферментное выявление цитокинов имеет ряд преимуществ перед другими методами (высокая чувствительность, специфичность, независимость от присутствия антагонистов, возможность точного автоматизированного учета, стандартизации учета). Однако и этот метод имеет свои ограничения: ИФА не характеризует биологическую активность цитокинов, может давать ложные результаты за счет перекрестно-реагирующих эпитопов.
Биологическое тестирование проводят на основе знания основных свойств цитокинов, их действия на клетки-мишени. Изучение биологических эффектов цитокинов позволило разработать четыре разновидности тестирования цитокинов:
- по индукции пролиферации клеток-мишеней;
- по цитотоксическому эффекту;
- по индукции дифференцировки костно-мозговых предшественников;
- по противовирусному действию.
ИЛ-1 определяют по стимулирующему действию на пролиферацию мышиных тимоцитов, активированных митогеном in vitro; ИЛ-2 — по способности стимулировать пролиферативную активность лимфобластов; по цитотоксическому действию на мышиные фибробласты (L929) тестируют ФНОа и лимфотоксины. Колониестимулирующие факторы оценивают по их способности поддерживать рост костномозговых предшественников в виде колоний в агаре. Противовирусную активность ИФН выявляют по угнетению цитопатического действия вирусов в культуре диплоидных фибробластов человека и опухолевой линии фибробластов мышей L-929.
Созданы клеточные линии, рост которых зависит от присутствия определенных цитокинов. В табл. 7.1 представлен список клеточных линий, используемых для тестирования цитокинов. По способности индуцировать пролиферацию чувствительных клеток-мишеней проводят биотестирование ИЛ-1, ИЛ-2, ИЛ-4, ИЛ-6, ИЛ-7, ИЛ-15 и др. Однако эти методы тестирования отличаются недостаточной чувствительностью и информативностью. Молекулы ингибиторов и антагонистов могут маскировать биологическую активность цитокинов. Некоторые цитокины проявляют общую биологическую активность. Тем не менее эти методы идеальны для тестирования специфической активности рекомбинантных цитокинов.
Таблица 7.1. Клеточные линии, используемые для тестирования биологической активности цитокинов
|
Цито кины |
Клеточные линии |
Источник |
Чувстви тельность |
Ответ других цитокинов |
|
ИЛ-1 |
D10S |
Мышиные Т-херперы |
0,1—100 пг |
ИЛ-2 |
|
ИЛ-2 |
CTLL-2 |
Мышиные цитотоксические Т-клетки |
1—700 пг |
ИЛ-15, ТФРр |
|
ИЛ-3 |
М07е |
Мегакариобласты больных лейкозом |
50 пг — 100 нг |
ГМ-КСФ, ИЛ-9, ИЛ-15, ФИО, ИФНа |
|
ИЛ-4 |
CTh4S |
Мышиные цитотоксические Т-клетки с трансфекцией человеческого ИЛ-4Р |
2 пг — 1 нг |
ИЛ-2, ФНОа, ТФРр, ИФНа, ИФНу |
|
|
CCL-185 |
Клетки опухоли легких человека |
5 пк — 1 нг |
ИЛ-13, ИЛ-1, ФНО, ИЛ-3, ИЛ-4 |
|
ИЛ-5 |
TF-1 |
Клетки больных эритролейкозом |
10 пг — 2 нг |
ИЛ-13, ИЛ-4, ИЛ-6, ГМ-КСФ, ТФР, ИФН, ФНО |
|
ИЛ-6 |
В9 |
Мышиная гибри- дома |
2—50 пг |
ИЛ-13, ИЛ-11 |
|
ИЛ-7 |
2Ьх |
Мышиные пре-В- клетки |
100 пг — 50 нг |
|
Окончание табл. 7.1
|
Цито кины |
Клеточные линии |
Источник |
Чувстви тельность |
Ответ других цитокинов |
|
ИЛ-9 |
М07е |
Мегакариобласты от больных лейкозом |
500 пг — 10 нг |
ГМ-КСФ, ИЛ-9, ИЛ-15, ФНОа, ИФНа |
|
ИЛ-10 |
МС-9 |
Линия тучных клеток мышей |
500 пг — 100 нг |
ИЛ-5 |
|
ИЛ-11 |
В9-11 |
Мышиная гибри- дома |
1—100 пг |
|
|
ИЛ-12 |
KIT-225 |
Клетки Т-лимфо- цитарного лейкоза человека |
2 пг — 1 нг |
ИЛ-2 |
|
ИЛ-13 |
В9.1.3 TF-1 |
Мышиная гибри- дома |
300 пг - 20 нг |
ИЛ-6, ИЛ-11 |
|
ИЛ-15 |
CTLL-2 |
Мышиные цитотоксические Т-клетки |
20 пг — 1 нг |
ИЛ-2, ТФРр |
|
ГМ-КСФ |
М07е |
Мегакариобласты больных лейкозом |
5 пг — 1 нг |
ИЛ-9, ИЛ-15, ФИО, ИФНа |
Лабораторная работа 7-1
Определение биологической активности ИЛ-1 по комитоген-
ному действию на пролиферацию тимоцитов мышей
В основе метода биологического тестирования ИЛ-1 лежит способность цитокина стимулировать пролиферацию мышиных тимоцитов.
ИЛ-1 может быть определен в культуре моноцитов, стимулированных ЛПС, а также в любой биологической жидкости организма.
Необходимо обратить внимание на ряд деталей.
- Для тестирования применяют тимоциты мышей линии СЗН/ HeJ, стимулированные к пролиферации митогенами (конканава- лин А — Кон А и фитогемагглютинин — ФГА). Тимоциты СЗН/HeJ выбраны не случайно: мыши этой инбредной линии не отвечают на ЛПС, который может находиться в составе тестируемого материала и вызывать продукцию ИЛ-1.
- Тимоциты отвечают на ИЛ-2 и митогены, поэтому в препаратах, тестируемых на ИЛ-1, следует определять также присутствие ИЛ-2 и митогенов.
Порядок работы
- Получают суспензию тимоцитов в концентрации 12х106/мл среды RPMI 1640, содержащей 10% сыворотки эмбрионов коров и 2-меркаптоэтанол (5х10-5 М).
- Готовят ряд последовательных двукратных разведений опытных (биологические жидкости организма) и контрольных образцов. В качестве контрольных используют биологические жидкости, содержащие ИЛ-1 или образцы, полученные при инкубации мононуклеарных клеток без ЛПС, и лабораторный стандартный ИЛ-1-содержащий препарат. В 96-луночные круглодонные планшеты из каждого разведения переносят по 50 мкл в 6 лунок.
- В три лунки каждого разведения добавляют по 50 мкл растворенного в полной среде очищенного ФГА (Wellcome) в концентрации 3 мкг/мл, а в другие 3 лунки — по 50 мкл среды.
- В каждую лунку добавляют по 50 мкл суспензии тимоцитов и инкубируют в течение 48 ч при 37 °С.
- Перед завершением культивирования в лунки вносят по 50 мкл раствора (1 мкКи/мл) [3Н]-тимидина и инкубируют еще 20 ч.
- Для определения уровня радиоактивности клетки культуры переносят на фильтровальную бумагу с помощью автоматического сборщика клеток, фильтры высушивают и определяют включение метки жидкостным сцинтилляционным счетчиком.
- Результаты выражают в виде коэффициента стимуляции.
тср в присутствии исследуемого образа
тср в контроле
где тср — среднее число импульсов в 3 лунках.
Если тимоциты отвечают на стимуляцию стандартным ИЛ-1, то индекс стимуляции исследуемого образца, превышающий 3, достоверно свидетельствует об ИЛ-1-активности.
Биоанализ является единственным методом для оценки функционирования цитокина, но данный метод должен быть дополнен разными видами соответствующего контроля на специфичность с использованием моноклональных антител. Добавление определенных моноклональных антител к цитокину в культуру блокирует биологическую активность цитокина, что доказывает: сигналом к пролиферации клеточной линии служит определяемый цитокин.
Использование биоанализа для выявления интерферона. Принцип оценки биологической активности ИФН основан на его противовирусном действии, которое определяется по степени ингибиции размножения тест-вируса в культуре клеток.
В работе могут быть использованы клетки, чувствительные к действию ИФН: первично трипсинизированные клетки-фибробласты эмбрионов кур и человека, перевиваемые клетки диплоидных фибробластов человека и культура мышиных клеток (L929).
При оценке противовирусного действия ИФН целесообразно использовать вирусы с коротким циклом размножения, высокой чувствительностью к действию ИФН: вирус энцефаломиелита мышей, везикулярного стоматита мыши и др.
