Механизмы запуска
Альтернативный путь активации филогенетически наиболее древний. Он полностью реализуется в рамках врожденного иммунитета. Запуск альтер-
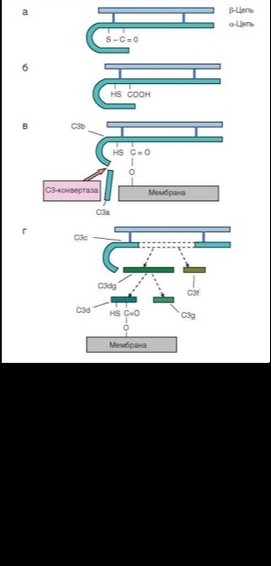
нативного пути активации связан с гидролизом вышеупомянутой тиоэфир- ной связи в молекуле С3, происходящим постоянно, но в очень немногих молекулах С3 (0,5% от числа молекул сывороточного С3). Эти молекулы спонтанно (стохастически) приобретают развернутую конформацию, при которой тиоэфирная связь становится доступной для Н2О. После гидролиза тиоэфирной связи развернутая (денатурированная) конформация молекулы С3 стабилизируется. Образующийся при этом в малом количестве продукт С3(Н2О) участвует в гидролизе фактора В (см. рис. 2.39), делая его доступным для расщепления сывороточной трипсиноподобной сериновой протеазой — фактором D. В результате образуется два продукта расщепления фактора В — Ва (33 кДа) и ВЬ (60 кДа). Фрагмент Bb формирует комплекс с С3(Н2О) — С3(Н2О^Ь, обладающий активностью СЗ-конвертазы, т.е. способный расщеплять, а следовательно и активировать, фактор С3. Энзиматическая активность комплекса С3(Н2О^Ь обусловлена фрагментом Bb.
Комплекс С3(Н2О^Ь образуется в следовых количествах, но он запускает фазу амплификации (умножения). С3(Н2О^Ь расщепляет a-цепи С3 компонента комплемента (напомним, что С3 состоит из двух полипептидных цепей — а и в). В результате действия на С3 «затравочных» количеств С3(Н2О^Ь происходит расщепление дополнительных количеств С3. Малый фрагмент С3а (10 кДа) отщепляется от N-концевой части а-цепи. Большой фрагмент C3b (185 кДа) включает оставшуюся часть a-цепи и в-цепь (см. рис. 2.40). Дисульфидные связи в молекуле сохраняются без изменений. Фрагмент С3Ь обладает сродством к фактору В. При этом, как и при взаимодействии с C3(H2O), фактор В расщепляется фактором D на фрагменты Ва и ВЬ. Это расщепление происходит уже в значительно большем масштабе. Фрагмент ВЬ связывается с С3Ь в присутствии ионов Mg2+ с образованием комплекса C3bBb, также обладающего активностью С3-конвертазы. C3bBb называют амплифицирующей конвертазой, поскольку он значительно эффективнее осуществляет конверсию С3, чем С3(Н2О)ВЬ. В формировании комплекса C3bBb может участвовать также фрагмент С3Ь, образующийся при активации комплемента по классическому пути (см. далее); в то же время С3^фрагмент, образующийся по альтернативному пути, может входить в состав C3-конвертазы классического пути. Это означает возможность взаимодействия и взаимного усиления двух путей активации комплемента.
Стабилизация СЗ-конвертазы альтернативного пути
В растворе комплекс C3bBb быстро инактивируется, диссоциируя под действием фактора Н (он вытесняет Bb из комплекса). Затем a-цепь С3Ь в составе комплекса С3bH расщепляется фактором I. Стабилизация комплекса С3bBb происходит только при его иммобилизации на клеточной мембране, с участием упоминавшейся выше тиоэфирной связи a-цепи С3Ь. Фактор Н может атаковать и прикрепленный к мембране C3bBb, однако инактивация этого комплекса происходит только при наличии на поверхности клетки остатков сиаловых кислот. Поскольку эти остатки представлены на клетках макроорганизма, но не на поверхности микроорганизмов, комплекс С3bBb относительно стабилен только на поверхности микроорганизмов. На собственных клетках макроорганизма-хозяина комплекс разрушается под действием факторов Н и I. В качестве кофакторов при этом выступают мембранные молекулы — рецептор комплемента CR1 ^D35) и DAF (Decayactivating factor; CD55). Некоторые бактериальные продукты [ЛПС (активна его сахаридная часть) и полисахаридные токсины], напротив, стабилизируют комплекс С3bBb. Аналогичной активностью обладают зимозан, полиэлектролиты и агрегированные иммуноглобулины (последние блокируют действие фактора Н). Таким образом, постоянно происходящая в организме активация комплемента по альтернативному пути не повреждает собственные клетки организма, но обеспечивает защиту от патогенов.
Исходным событием при обнаружении и дальнейшем изучении альтернативного пути активации комплемента стало открытие Л. Пиллемером пропердина. Пропердин, или белок Р, обеспечивает стабилизацию комплекса C3bBb за счет ослабления его спонтанной диссоциации. Под влиянием белка P время полужизни комплекса увеличивается с 60 мкс до 90 с. Помимо этого, пропердин ускоряет сборку комплекса C3bBb и предотвращает действие на него фактора Н. Пропердин способен связываться с поверхностью бактериальной клетки и усиливать фиксацию на ней С3-конверта- зы ^3bBb). При этом к комплексу могут присоединяться дополнительные молекулы С3Ь, что приводит к появлению на поверхности клетки избытка молекул С3Ь, важного для проявления опсонизирующего эффекта комплемента. Комплекс Р(С3Ь)^Ь функционирует как С5-конвертаза (хотя сохраняет активность и в отношении компонента С3); при этом ферментативная активность этого комплекса, как и в С3-конвертазе, связана с Bb.
Первый этап активации комплемента по альтернативному пути на этом завершается. Рассмотрение его механизмов позволяет заключить, что сама по себе активация С3 и фактора В происходит спонтанно и непрерывно. Направленное действие комплемента как части иммунной системы реализуется при стабилизации комплекса C3bBb на мембране бактериальных клеток, но не собственных клеток организма. Результат первой фазы активации комплемента по альтернативному пути — образование С5-конвертазы и опсонизация клеток молекулами С3Ь.
Альтернативный путь активации филогенетически наиболее древний. Он полностью реализуется в рамках врожденного иммунитета. Запуск альтер-


нативного пути активации связан с гидролизом вышеупомянутой тиоэфир- ной связи в молекуле С3, происходящим постоянно, но в очень немногих молекулах С3 (0,5% от числа молекул сывороточного С3). Эти молекулы спонтанно (стохастически) приобретают развернутую конформацию, при которой тиоэфирная связь становится доступной для Н2О. После гидролиза тиоэфирной связи развернутая (денатурированная) конформация молекулы С3 стабилизируется. Образующийся при этом в малом количестве продукт С3(Н2О) участвует в гидролизе фактора В (см. рис. 2.39), делая его доступным для расщепления сывороточной трипсиноподобной сериновой протеазой — фактором D. В результате образуется два продукта расщепления фактора В — Ва (33 кДа) и ВЬ (60 кДа). Фрагмент Bb формирует комплекс с С3(Н2О) — С3(Н2О^Ь, обладающий активностью СЗ-конвертазы, т.е. способный расщеплять, а следовательно и активировать, фактор С3. Энзиматическая активность комплекса С3(Н2О^Ь обусловлена фрагментом Bb.
Комплекс С3(Н2О^Ь образуется в следовых количествах, но он запускает фазу амплификации (умножения). С3(Н2О^Ь расщепляет a-цепи С3 компонента комплемента (напомним, что С3 состоит из двух полипептидных цепей — а и в). В результате действия на С3 «затравочных» количеств С3(Н2О^Ь происходит расщепление дополнительных количеств С3. Малый фрагмент С3а (10 кДа) отщепляется от N-концевой части а-цепи. Большой фрагмент C3b (185 кДа) включает оставшуюся часть a-цепи и в-цепь (см. рис. 2.40). Дисульфидные связи в молекуле сохраняются без изменений. Фрагмент С3Ь обладает сродством к фактору В. При этом, как и при взаимодействии с C3(H2O), фактор В расщепляется фактором D на фрагменты Ва и ВЬ. Это расщепление происходит уже в значительно большем масштабе. Фрагмент ВЬ связывается с С3Ь в присутствии ионов Mg2+ с образованием комплекса C3bBb, также обладающего активностью С3-конвертазы. C3bBb называют амплифицирующей конвертазой, поскольку он значительно эффективнее осуществляет конверсию С3, чем С3(Н2О)ВЬ. В формировании комплекса C3bBb может участвовать также фрагмент С3Ь, образующийся при активации комплемента по классическому пути (см. далее); в то же время С3^фрагмент, образующийся по альтернативному пути, может входить в состав C3-конвертазы классического пути. Это означает возможность взаимодействия и взаимного усиления двух путей активации комплемента.
Стабилизация СЗ-конвертазы альтернативного пути
В растворе комплекс C3bBb быстро инактивируется, диссоциируя под действием фактора Н (он вытесняет Bb из комплекса). Затем a-цепь С3Ь в составе комплекса С3bH расщепляется фактором I. Стабилизация комплекса С3bBb происходит только при его иммобилизации на клеточной мембране, с участием упоминавшейся выше тиоэфирной связи a-цепи С3Ь. Фактор Н может атаковать и прикрепленный к мембране C3bBb, однако инактивация этого комплекса происходит только при наличии на поверхности клетки остатков сиаловых кислот. Поскольку эти остатки представлены на клетках макроорганизма, но не на поверхности микроорганизмов, комплекс С3bBb относительно стабилен только на поверхности микроорганизмов. На собственных клетках макроорганизма-хозяина комплекс разрушается под действием факторов Н и I. В качестве кофакторов при этом выступают мембранные молекулы — рецептор комплемента CR1 ^D35) и DAF (Decayactivating factor; CD55). Некоторые бактериальные продукты [ЛПС (активна его сахаридная часть) и полисахаридные токсины], напротив, стабилизируют комплекс С3bBb. Аналогичной активностью обладают зимозан, полиэлектролиты и агрегированные иммуноглобулины (последние блокируют действие фактора Н). Таким образом, постоянно происходящая в организме активация комплемента по альтернативному пути не повреждает собственные клетки организма, но обеспечивает защиту от патогенов.
Исходным событием при обнаружении и дальнейшем изучении альтернативного пути активации комплемента стало открытие Л. Пиллемером пропердина. Пропердин, или белок Р, обеспечивает стабилизацию комплекса C3bBb за счет ослабления его спонтанной диссоциации. Под влиянием белка P время полужизни комплекса увеличивается с 60 мкс до 90 с. Помимо этого, пропердин ускоряет сборку комплекса C3bBb и предотвращает действие на него фактора Н. Пропердин способен связываться с поверхностью бактериальной клетки и усиливать фиксацию на ней С3-конверта- зы ^3bBb). При этом к комплексу могут присоединяться дополнительные молекулы С3Ь, что приводит к появлению на поверхности клетки избытка молекул С3Ь, важного для проявления опсонизирующего эффекта комплемента. Комплекс Р(С3Ь)^Ь функционирует как С5-конвертаза (хотя сохраняет активность и в отношении компонента С3); при этом ферментативная активность этого комплекса, как и в С3-конвертазе, связана с Bb.
Первый этап активации комплемента по альтернативному пути на этом завершается. Рассмотрение его механизмов позволяет заключить, что сама по себе активация С3 и фактора В происходит спонтанно и непрерывно. Направленное действие комплемента как части иммунной системы реализуется при стабилизации комплекса C3bBb на мембране бактериальных клеток, но не собственных клеток организма. Результат первой фазы активации комплемента по альтернативному пути — образование С5-конвертазы и опсонизация клеток молекулами С3Ь.
