Генетика главного комплекса гистосовместимости
В 20-е годы XX века в Джексоновской лаборатории (Бар Харбор, США) была проведена масштабная работа по получению генетически чистых линий мышей путем длительного инбридинга. В опытах с межлинейной пересадкой опухолей сотрудники этой лаборатории Дж.Д. Литтл (G.D. Little), Дж. Снелл (G. Snell) и другие американские исследователи установили существование нескольких десятков (более 30) генетических локусов, различие по которым обусловливает отторжение трансплантируемых тканей. Они были обозначены как локусы гистосовместимости (Н-локусы, от английского Histocompatibility). Одновременно сходную задачу решал английский иммунолог П. Горер (P. Gorer), изучая группы крови мышей. В 1948 г. в совместной работе Дж. Снелла и П. Горера был описан локус гистосовместимости, определяющий наиболее сильную реакцию отторжения. Он был назван Н-2, поскольку соответствовал гену 2-й группы крови мышей. Вскоре была установлена сложная структура этого генетического комплекса, включающего очень большое число генов. К тому времени уже была доказана иммунологическая природа отторжения трансплантата и было ясно, что эффект несовместимости по Н-локусам обусловлен различиями в антигенах, кодируемых генами этого локуса. Такие антигены стали называть аллоантигенами, или антигенами гистосовместимости.
В 60-е годы ХХ века французский иммуногематолог Ж. Доссе (J. Dausset) описал несколько антигенов лейкоцитов, аналогичных некоторым аллельным продуктам Н-2. Вскоре Ж. Доссе вместе с другими специалистами по генетике трансплантаций на основе анализа накопленных к тому времени данных об аллоантигенах человека постулировал существование у человека генетического комплекса, аналогичного локусу Н-2 мышей. Была выявлена принадлежность к этому комплексу нескольких аллоантигенов, открытых ранее благодаря использованию сывороток многократно рожавших женщин. В этих сыворотках присутствовали антитела к аллоантигенам плодов. Открытый генетический комплекс был назван HLA (от Human leukocyte antigens). Аналогичные комплексы были обнаружены у всех изучавшихся млекопитающих и птиц. В связи с этим было введено общее обозначение для генетических комплексов такого рода — MHC (от Major histocompatibility complex). Это обозначение было перенесено и на продукты генов — MHC-антигены.
Комплекс Н-2 локализуется в хромосоме 17 мыши; комплекс HLA — в коротком плече хромосомы 6 человека (6р). Структура локуса HLA человека схематично представлена на рис. 3.28. Он занимает очень большое
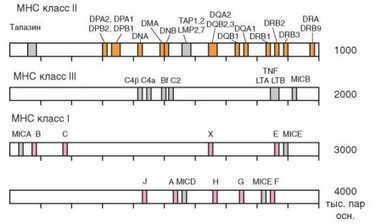
Рис. 3.28. Карта генов главного комплекса гистосовместимости (MHC) на примере комплекса лейкоцитарных антигенов человека (HLA). Участок хромосомы разделен на 4 отрезка, представленные на рисунке последовательно. Справа указаны номера 3’-нуклеотидов каждого отрезка
пространство — 4 млн пар нуклеотидов и содержит больше 200 генов. Выделяют 3 класса генов MHC — I, II и III. В отторжении несовместимых трансплантатов и презентации антигена Т-клеткам участвуют продукты генов классов I и II, расположенные соответственно в 3’- и 5’-частях комплекса. Первоначально их разделяли по индукции их продуктами преимущественно гуморального (I класс) или клеточного (II класс, описанный несколько позже, чем I) иммунитета. Выделяют 2 группы генов I класса. Первую образуют гены А, В и С, отличающиеся беспрецедентно высоким полиморфизмом — известно по нескольку сотен их аллельных форм (например, HLA-B — 830) — см. табл. 3.7. Это классические гены I класса. Другую группу образуют неклассические гены Е, F, G, H (гены с ограниченным полиморфизмом). Только продукты классических генов I класса участвуют в презентации антигена Т-лимфоцитам.
Таблица 3.7. Полиморфизм генов лейкоцитарных антигенов человека (HLA)
|
Класс |
Локус |
Число аллелей, выявленных ДНК-типированием |
|
I |
HLA-A |
489 |
|
HLA-B |
830 |
|
|
HLA-C |
266 |
|
|
HLA-E |
9 |
|
|
HLA-F |
21 |
|
|
HLA-G |
23 |
Окончание табл. 3.7
|
Класс |
Локус |
Число аллелей, выявленных ДНК-типированием |
|
II |
HLA-DRA |
3 |
|
|
HLA-DRB1 |
463 |
|
|
HLA-DRB2-9 |
82 |
|
|
HLA-DQA1 |
34 |
|
|
HLA-DQB1 |
78 |
|
|
HLA-DPA1 |
23 |
|
|
HLA-DPB1 |
125 |
|
|
HLA-DOA |
12 |
|
|
HLA-DOB |
9 |
|
|
HLA-DMA |
4 |
|
|
HLA-DMB |
7 |
|
Всего |
|
2478 |
Гены MHC класса II также включают несколько вариантов. В презентации антигена непосредственно участвуют продукты генов DR (а и в), DP (а и в) и DQ (а и в), кодирующие соответствующие полипептидные цепи молекул. Во всех случаях для генов в-цепей характерен значительно более высокий полиморфизм, чем для генов а-цепей. Более позднее обнаружение этих генов связано с трудностями идентификации их продуктов: сыворотки многократно рожавших женщин, использованные для выявления продуктов MHC, содержали антитела к молекулам MHC почти исключительно I класса. С их помощью выявлены только аллоантигенные варианты гена HLA-DRB. Для определения молекул II класса применяли смешанную культуру лимфоцитов (т.е. Т-клеточную реакцию), предоставляющую значительно меньше возможностей для выявления тонкостей антигенных различий. В настоящее время антигены обоих классов определяют в полимеразной цепной реакции (т.е. определяют именно гены, а не их продукты, как раньше). К классу II относят несколько генов с невысоким уровнем полиморфизма, продукты которых не презентируют антиген, но участвуют в его внутриклеточной обработке — процессинге (гены ТАР, LMP) или способствуют встраиванию антигенного пептида в молекулы MHC-II (HLA-DM, HLA-DO).
Гены MHC класса III, как уже упоминалось, не причастны к молекулам гистосовместимости и осуществляемой ими презентации. Они кодируют некоторые компоненты комплемента, цитокины семейства фактора некроза опухоли, белки теплового шока.
Строение мышиного локуса Н-2 аналогично описанному выше строению локуса HLA человека. Основное различие касается локализации генов класса I (К и D), которые у мышей пространственно разобщены, тогда как расположение генов классов II (A, E) и III соответствует таковому в локусе HLA человека.
Молекулы MHC — полиморфные продукты главного комплекса гистосовместимости классов I и II
При значительном сходстве общего плана строения молекул MHC классов I и II они имеют ряд различий. Схема доменной структуры этих молекул представлена на рис. 3.29. Молекулы обоих типов образованы двумя полипептидными цепями, содержащими 1—3 домена (табл. 3.8). Каждый домен содержит около 90 аминокислотных остатков. Молекулы MHC классов I и II имеют сходную молекулярную массу — около 60 кДа.
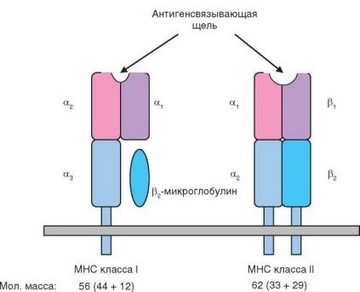
Рис. 3.29. Схема строения молекул MHC
Таблица 3.8. Характеристика полипептидных цепей молекул HLA классов I и II
|
Молекула |
Название цепи |
ей о О ей S о А |
Внеклеточные домены |
1 Я О. g 1 | Ф Z, 2 ? * ^ Й в г- з н * |
Число S-S-связей |
Число остатков в доменах |
||
|
1 Я О Н Ф ч ф в я 3 CQ Q |
1 ю S ф S « « 3 и я ей щ Н о. |
I * А н * ^ м О и 2 о ? н S я Й Я 2 |
||||||
|
HLA, класс I |
«1 |
45 |
аЬ ^ а3 |
есть |
2 |
90-90-90 |
25 |
30 |
|
в2-микро- глоублин |
12 |
в2-микро- глобулин |
нет |
0 |
100 |
- |
- |
|
|
HLA, класс II |
а |
33-35 |
ai, а2 |
есть |
1 |
90-90 |
25 |
варьирует |
|
в |
29 |
Pi, в2 |
есть |
2 |
90-90 |
25 |
варьирует |
|
В молекулах класса I полипептидные цепи сильно отличаются друг от друга. Цепь а состоит из трех внеклеточных доменов, из которых 3-й (прилегающий к мембране) принадлежит суперсемейству иммуноглобулинов, а 2 других имеют иное строение, которое рассмотрим ниже. а-Цепь заякорена в мембране; помимо трансмембранного, она имеет короткий цитоплазматический участок (30 остатков), не обладающий ферментативной активностью и не связанный с ферментами. в-Цепь, называемая также Р2-микроглобулином, относится к суперсемейству иммуноглобулинов. Она нековалентно связана с а3-доменом а-цепи и не имеет трансмембранного участка. р2-Микроглобулин кодируется геном, расположенным вне комплекса MHC (в хромосоме 15). Описанная структура свойственна молекулам HLA-A, HLA-B и HLA-C человека, а также молекулам H-2K и H-2D мыши и молекулам MHC-I всех других видов животных.
Молекулы MHC-II тоже имеют одинаковое строение для HLA-DP, HLA-DQ, HLA-DR человека, а также Н-2А и Н-2Е мыши. В их состав входят 2 цепи аналогичного строения — а и р. Обе цепи пронизывают мембрану, имеют 2 домена во внеклеточной части и короткий (12—15 остатков) цитоплазматический участок. Домены а2 и р2, прилежащие к мембране, принадлежат к суперсемейству иммуноглобулинов, а дистальные домены aj и Pj по своей структуре сходны с доменами а1 и а2 молекул MHC-I.
Таким образом, все молекулы MHC в общей сложности содержат 2 при- мембранных домена суперсемейства иммуноглобулинов и 2 дистальных домена другой (сходной между собой) структуры. Дистальные домены в молекулах MHC-I образованы одной цепью (а), а в молекулах MHC-II — разными цепями (а и р). Именно эти дистальные домены молекул MHC связывают антигенный пептид и играют ключевую роль в формировании лиганда TCR.
Схематично строение антигенсвязывающих полостей (или желобков, щелей — от английского — groove) представлено на рис. 3.30. Полости имеют дно и стенки. Дно — плоский участок, выстланный р-слоистой (N-концевой) частью доменов полипептидной цепи, тогда как стенки сформированы С-концевыми а-спирализованными участками доменов. В молекулах MHC-I вся эта структура образована непрерывной полипептидной цепью а1 и а2-доменов единой а-цепи, тогда как в молекулах MHC-II пеп- тидсвязывающая полость образована доменами двух разных цепей (а1- и Pj-доменами соответствующих цепей), примыкающих друг к другу в области в-структурированного дна желобка.
Выше говорилось о чрезвычайно высоком полиморфизме классических молекул MHC обоих классов: существует по нескольку сотен аллельных вариантов генов и, следовательно, их белковых продуктов. Если наложить расположение варьирующих аминокислотных остатков на схему молекул MHC, оказывается, что, во-первых, они расположены в основном в дистальных доменах (а1 и а2 — в молекулах MHC-I, а1 и Pj — в молекулах MHC-II), во-вторых, они связаны почти исключительно со стенками антигенсвязыва- ющей полости. В молекулах MHC-II варибельность преобладает в той части стенок, которая образована ргдоменом. Таким образом, эта полость имеет стандартную организацию, но в зависимости от MHC-генотипа, тонкие детали ее строения варьируют. Сродство различных пептидов к антигенсвя-
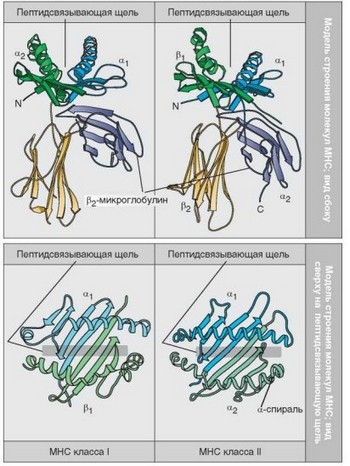
Рис. 3.30. Трехмерные модели строения молекул главного комплекса гистосовместимости. Пространственные модели молекул главного комплекса гистосовместимости, представленные под разными углами зрения (по Bjorkman et al, 1987)
зывающей щели молекул MHC изменяется в широких пределах. Достаточно высоким считается сродство порядка 10-5 М.
Подчеркнем одно очень важное обстоятельство, касающееся вариабельности ключевых молекул иммунной системы. Исключительно высокий уровень вариабельности свойствен как антигенраспознающим структурам (антителам, TCR), так и молекулам MHC, участвующим в построении лиганда 'TCR. Однако все варианты антител и TCR (порядка 106) присутствуют в одном организме, являясь продуктами одновременно присутствующих в нем генов, в то время как вариабельность молекул МНС проявляется на
уровне популяций человека и животных, тогда как в каждом конкретном организме может присутствовать не более 2 вариантов молекул — продуктов аллельных генов. Если учесть, что у человека есть 8 высокаполиморфных генов MHC (А, В, С, а также p-гены DP, DQ и DR и a-гены DP и DQ), то число вариантов полипептидных цепей MHC не может превышать 16.
Молекулы MHC-I и MHC-II представлены на поверхности клеток, но существенно различаются по тканевому распределению. Молекулы MHC-I присутствуют практически на всех ядросодержащих клетках организма и отсутствуют на эритроцитах и клетках ворсинчатого трофобласта. На каждой клетке обычно содержится около 7000 молекул MHC-I. Плотность их экспрессии может изменяться под влиянием различных факторов, в частности, цитокинов. Молекулы MHC-II присутствуют на поверхности ограниченного числа клеточных типов. Они экспрессируются прежде всего на АПК — дендритных клетках, В-лимфоцитах и активированных макрофагах. Содержание молекул на поверхности этих клеток сильно варьирует. На одной дендритной клетке обычно содержится порядка 100 000 молекул MHC-II. При определенных условиях (например, при воспалении) они могут появляться на поверхности других активированных клеток — эпителиальных, эндотелиальных и т.д. Классический индуктор молекул MHC-II — IFNy. Особенность мембранных молекул MHC — их быстрый обмен на поверхности клеток, особенно характерный для MHC-I (время обновления молекул — около 6 ч).
Особую группу антигенпрезентирующих молекул образуют гомологи продуктов MHC-I — молекулы CD1 (CD1a, CD1b, CD1c и CD1d), кодируемые пятью полиморфными генами (CD1 A-D), локализованными у человека в хромосоме 1. По своей структуре молекулы CD1 сходны с MHC-I (гомология составляет 20—25%). Они обладают сходной доменной структурой (домены aj, a2 и a3). CD1 — трансмембранные белки, связанные с молекулой р2-мик- роглобулина. Молекулярная масса белковой части CDl-комплекса — 33 кДа. Домены aj и a2 образуют антигенсвязывающую полость, закрытую с обоих концов (как и в молекулах MHC-I). Ее вместимость несколько больше, чем в молекулах MHC-I. CD1 связывает бактериальные и аутологичные липиды (диацилглицерол, миколевую кислоту и т.д.) и липопептиды. От других молекул CD1 по ряду свойств отличается CD1d. Эта молекула связывает аутологчиные гликолипиды. Ее наиболее известный лиганд — a-галакто- зилцерамид. Молекулы CD1a, CD1b и CD1c экспрессируются на поверхности дендритных клеток, моноцитов и макрофагов, причем у человека CD1c служит маркером всей популяции дендритных клеток, а CD^ — клеток Лангерганса. CD1d в малом количестве экспрессируется на дендритных клетках (кроме клеток Лангерганса), моноцитах и макрофагах.
