Как уже упоминалось выше, продукты генов MHC в силу своей чрезвычайно высокой вариабельности в пределах популяции обусловливают отторжение пересаживаемых тканей. Долгое время эти молекулы изучали преимущественно в контексте трансплантологии, что определило их обозначение как генов и антигенов гистосовместимости. Однако пересадка тканей — искусственная процедура, практически не имеющая аналогов в естественных условиях (наиболее близкая аналогия — развивающийся плод млекопитающих — скорее служит примером противостояния отторжению несовместимых тканей). Поэтому вскоре после описания генов MHC и их продуктов возник вопрос об их функциях. Их биологическое назначение было осмыслено в 70-х годах XX века в уже упоминавшихся исследованиях Р. Цинкернагеля (R. Zinkernagel) и П. Догерти (Р. Dogherty), которые показали, что Т-клетки распознают «измененное свое» — фрагмент антигена, встраивающийся в состав молекулы MHC, вместе с модифицированной этим пептидом молекулой MHC (Нобелевская премия 1996 г.). Таким образом, антиген распознается Т-клеткой только при встраивании его фрагментов в состав молекул MHC, которые при этом выступают не только в роли каркаса, несущего пептид, но и в качестве распознаваемого лиганда. Только в таком виде антиген может быть распознан Т-лимфоцитами. Поскольку Т-клетки участвуют как в индукции иммунного ответа, так и в его регуляции и осуществлении ряда эффекторных функций, презентация антигенного пептида Т-лимфоцитам может рассматриваться как одно из ключевых событий иммунного ответа. Это определяет исключительную важность процесса встраивания пептида в молекулы МНС.
Молекулы MHC, не содержащие пептида, встроенного в антигенсвя- зывающую полость, нестабильны. На поверхности клеток присутствуют молекулы MHC, содержащие в своем составе пептиды. Таким образом, встроенный в молекулу MHC пептид следует рассматривать как ее интегральную часть. В каждой клетке в составе молекул MHC презентируются тысячи разных пептидов, что еще больше увеличивает вариабельность рассматриваемых молекул.
В структуре антигенсвязывающей полости молекул MHC-I и MHC-II имеются некоторые особенности (табл. 3.9). В MHC-I полость замкнута, т.е. ограничена не только с боков, но и с концов. В результате размер пептида, способного встроиться в нее, строго ограничен 8—10 аминокислотными остатками (чаще всего — 9). В отдельных случаях, если размеры пептида превышают указанные значения, он «выпирает» из щели, формируя арку. В MHC-II полость ограничена только с боков и имеет открытые концы. Поэтому размер встраивающихся в нее пептидов может варьировать в широких пределах — от 12 до 25 аминокислотных остатков; концы пептида могут выступать за пределы полости.
Таблица 3.9. Характеристика антигенсвязывающих полостей антигенпрезентирую- щих молекул
|
Параметр |
MHC класса I |
MHC класса II |
CD1 |
|
Домены, формирующие полость |
а1 и а2 |
aj и Pj |
а! и а2 |
|
Встраиваемый олигомер |
Пептид |
Пептид |
Липиды и гликолипиды |
|
Число аминокислотных остатков в пептиде |
8-10 |
12-25 |
- |
|
Тип полости |
Закрытая |
Открытая |
Закрытая |
|
Число (типичная локализация) «якорных» остатков |
2 (позиции 2/6, 9) |
Разное (2-4) |
2 |
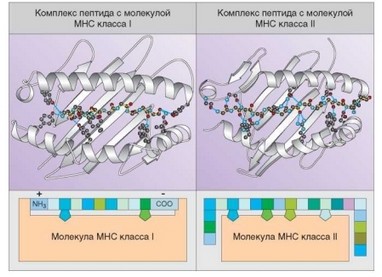
Рис. 3.31. Схема расположения пептида в молекулах главного комплекса гистосовместимости. На схеме в пептидсвязывающую щель «встроены» пептиды. Аминокислотные остатки изображены в виде разноцветных квадратов; пятиугольниками отмечены заякоренные остатки
В молекулах MHC-I и MHC-II пептид закрепляется в полости путем заякоривания в ее дно (рис. 3.31). В молекулах MHC-I заякоривание осуществляется в двух «карманах» дна пептидсвязывающей полости. Один из этих карманов обычно связан с С-концевым остатком дна полости, расположение второго варьирует в зависимости от аллельного варианта молекулы (обычно он соответствует 9 позиции). В MHC-II пептид заякорен в нескольких (обычно четырех) карманах в разных участках дна полости (в типичных случаях — на уровне остатков 1, 4, 6 и 9; см. рис. 3.31). Процессы встраивания пептидов в состав молекул MHC изучены к настоящему времени достаточно детально. Для молекул MHC-I и MHC-II принципиально различны как источники пептидов, так и механизмы их встраивания.
В молекулы MHC-I встраиваются пептиды — образующиеся в цитоплазме клетки в процессе естественной деградации цитоплазматических белков в специальных образованиях (протеасомах). Протеасомы — надмолекулярные структуры с константой седиментации 20S (молекулярная масса — 1500 кДа). Они сформированы наружным и внутренним кольцами, каждое из которых образовано семью субъединицами — а (наружное кольцо) и в (внутреннее кольцо). Три в-субъединицы — рь в2 и в5 обладают протеолитической активностью и участвуют в расщеплении белков цитозоля. Под влиянием
IFNy (образуется при иммунных процессах NKT-, NK- и Thl-клетками) синтезируются цепи ip1 (LMP2), ip2 (MECL1) и ip5 (LMP-7), замещающие соответствующие протеолитические субъединицы. Обновленную протеа- сому называют иммунопротеасомой. Смысл замены субъединиц состоит в усилении хемотриписно- и трипсиноподобной активности и ослаблении кас- пазоподобной активности протеасомы, что приводит к повышению эффективности образования пептидов с основными и гидрофобными С-концами (именно они встраиваются в молекулы MHC-I) и уменьшению доли пептидов с кислыми С-концами (не встраиваются в MHC-I).
Образовавшиеся пептиды транспортируются из цитополазмы в эндоплазматический ретикулум, в котором на рибосомах синтезируются полипептидные цепи молекулы MHC-I — a-цепь и р2-микроглобулин. Транспорт пептидов происходит с участием транспортных систем ТАР (Transporter associated with antigen processing), кодируемых MHC-генами ТАР1 и ТАР2. a-Цепь молекул класса I сразу после синтеза и встраивания в мембрану эндоплазматического ретикулума соединяется с р2-микроглобулином. Однако, как уже упоминалось, молекулы MHC, не содержащие пептид, нестабильны. Их конформация стабилизируется временно с помощью специальных молекул — шаперонов (в данном случае — калнексина и калретикулина). Доставленные в эндоплазматический ретикулум пептиды при контакте с молекулами MHC-I встраиваются в их полость, после чего молекулы шаперонов отделяются от готовой и стабилизированной молекулы класса I. В составе мембран эндоплазматического ретикулума молекулы класса I перемещаются сначала в аппарат Гольджи, а затем при помощи секреторных везикул — на поверхность клетки. В результате на клеточной поверхности
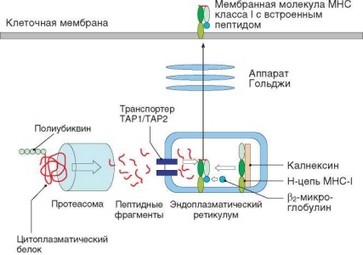
Рис. 3.32. Процессинг молекул главного комплекса гистосовместимости класса I и цитоплазматических пептидов. Белки и пептиды отмечены красным
оказываются молекулы MHC-I, содержащие различные фрагменты внутриклеточных белков (рис. 3.32).
Пептиды, презентируемые в составе молекул MHC-II, имеют внеклеточное происхождение. Дендритные и другие АПК поглощают экзогенные молекулы в процессе эндоцитоза. Выделяют 4 разновидности эндоцитоза:
- фагоцитоз;
- макропиноцитоз;
- клатринопосредованный эндоцитоз;
- кавеолоопосредованный эндоцитоз.
Фагоцитарный механизм относительно слабо используется любыми АПК, кроме моноцитов/макрофагов, для которых этот путь интернализации является основным. Макропиноцитоз широко распространен при интернализации экзогенных веществ макрофагами и незрелыми дендритными клетками. Клатринзависимый механизм чаще всего бывает задействован при поглощении иммунных комплексов и других формах рецепторного эндоцитоза (одинаково выражен у незрелых и зрелых дендритных клеток). Кавеолозави- симый эндоцитоз происходит несколько реже. Среди рецепторов, усиливающих эндоцитоз, наиболее важную роль (особенно для дендритных клеток) играет лектиновый рецептор DEC-205. В результате эндоцитоза формируются ранние эндосомы, содержащие интернализованные белки из межклеточного пространства. Некоторые ранние эндосомы возвращаются на наружную мембрану со сроком полужизни 1—2 мин. Около 25% эндосом транспортируется вглубь клетки и сливается с секреторными везикулами, формирующимися из эндоплазматического ретикулума и содержащими встроенные в мембрану молекулы MHC-II. В эндосомы может проникать также содержимое цитозоля (по механизму аутофагии), что приводит к презентации фрагментов цитоплазматических белков в составе молекул MHC-II. Структуру еще не связавших пептид молекул MHC-II стабилизирует полипептидная цепь Ii (от англ. — Invariant chain), заполняющая антигенсвязывающую полость и примыкающая к боковой поверхности цепей молекулы класса II. Участок внутриклеточного пространства, в котором происходят описываемые процессы, называют MIIC (MHC class II compartment).
При перемещении в глубь клетки внутренняя среда эндосом закисляется, что способствует активации содержащихся в них протеаз — катепсинов L и S. С такой закисленной эндосомой сливаются везикулы, содержащие молекулы MHC-II. Катепсины расщепляют белки, содержащиеся в эндосоме, с образованием пептидов. Одновременно они расщепляют Ii-цепь таким образом, что в составе молекулы класса II остается только фрагмент Ii-цепи, встроенный в пептидсвязывающую полость. Этот пептид обозначают как CLIP (Class II associated invariant chain peptide). Пептиды, образующиеся из экзогенных белков, вытесняют CLIP из полости. В этом процессе задействована молекула HLA-DM (продукт гена MHC класса II), присутствующая в везикуле. Взаимодействие HLA-DM с MHC-II катализирует высвобождение CLIP, в результате чего пептидсвязывающая полость MHC становится доступной для встраивания других пептидов. У мышей с мутациями гена HLA-DM этот процесс не осуществляется, в результате чего все молекулы MHC-II содержат один и тот же пептид — CLIP. После слияния эндо- сом с везикулами поздняя эндосома перемещается к поверхности клетки.
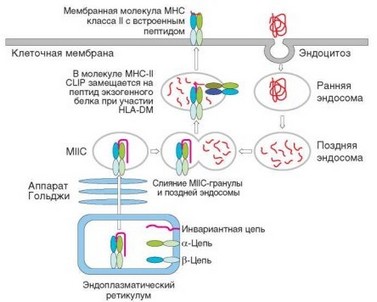
Рис. 3.33. Процессинг молекул главного комплекса гистосовместимости класса II и внеклеточных пептидов. Белки и пептиды отмечены красным
Происходит экзоцитоз ее содержимого. При этом мембрана везикулы сливается с мембраной клетки, в результате чего молекулы MHC-II, несущие пептид, оказываются на поверхности клетки (рис. 3.33).
Еще недавно считали, что два описанных пути процессинга антигенов и их встраивания в молекулы MHC автономны и изолированы друг от друга, в результате чего пептидные фрагменты внутриклеточных белков могут попасть только в состав молекул MHC-I, а пептиды экзогенного происхождения — только в состав молекул MHC-II. Поэтому было неясно, как происходит запуск цитотоксического иммунного ответа на внеклеточные патогены с участием молекул MHC-I. Ответом на этот вопрос послужило описание перекрестной презентации. Этот процесс заключается в том, что белки, поступившие из внеклеточной среды в эндосомы, могут проникнуть в цитозоль (где они расщепляются в протеасомах, а пептиды транспортируются в эндоплазмтический ретиклум) или непосредственно доставляются в эндоплазматический ретикулум по механизму ретроградного транспорта. В ретикулуме пептидные фрагменты этих экзогенных белков встраиваются в молекулы MHC-I и затем транспортируются на мембрану. Кроме того, допускают возможность реализации других механизмов, например, проникновения внеклеточных белков в цитозоль, минуя эндосомы. Возможно также расщепление попавших в эндосомы белков до пептидов с участием связанных с эндосомами протеасом. Образуемые при этом пептиды встраиваются в молекулы MHC-I.
Рассматривая встраивание пептидов в молекулы MHC, предполагалось, что эти фрагменты будут выполнять роль антигенных эпитопов, и сам процесс предназначен для формирования лигандов для TCR. Однако при встраивании пептидов в молекулы MHC отсутствует какая-либо предпочтительность в отношении антигенных пептидов. О том же свидетельствуют результаты исследования пептидов, извлекаемых из состава мембранных молекул MHC при закислении среды. Оказалось, что из молекул MHC-II элюируются в основном (до 90%) собственные белки клетки. Остальные 10% — внеклеточные белки, происходящие из межклеточной жидкости и окружающих клеток. Даже при инфекционном поражении на долю чужеродных пептидов приходится не более 0,1% от общего числа выделенных из мембранных молекул MHC пептидов. Таким образом, из примерно 100 000 молекул MHC, присутствующих на поверхности клетки, чужеродный эпитоп будет входить в состав всего лишь 100 молекул.
Описанные процессы встраивания фрагментов внутриклеточных и внеклеточных белков в молекулы MHC отражают важные для клетки процессы, назначение которых пока непонятно. Всем клеткам организма зачем-то нужно представлять на своей поверхности фрагменты собственных белков, а АПК — еще и фрагменты белков из их окружения. Очевидно, иммунная система лишь воспользовалась готовым механизмом для формирования антигенных структур, распознаваемых Т-клетками, и запуска иммунных процессов.
Выше говорилось исключительно о встраивании в молекулы MHC пептидных фрагментов антигенов. Однако известно, что аналогичным образом липидные эпитопы могут встраиваться в MHC-подобные молекулы семейства CD1. Полость молекулы CD1 обладает высоким сродством к липидам (10-7—10-8 М). Встраивание липида происходит в эндоплазматическом ретикулуме по схеме, аналогичной таковой при встраивании пептидов в молекулы MHC-I и с участием тех же шаперонов. В обновлении мембранных молекул, несущих антигенный липид, важную роль играет рециклинг (повторное использование) мембранных комплексов. CD1 поглощаются клеткой и проходят путь, аналогичный таковому при формировании комплексов молекул MHC-II с пептидами.
Отдельно следует упомянуть о презентации гликолипидных молекул NKT-клеткам, осуществляемой с помощью неклассической MHC-I-подобной молекулы CD1d. CD1d синтезируется в эндоплазматическом ретикулуме и там же связывает гликолипиды. Доставка гликолипидов в эндоплазматический ретикулум происходит с участием белкового переносчика липидов — фактора MTP (Microsomal transfer protein). Нагруженная молекула CD1d транспортируется на поверхность АПК, а затем в процессе эндоцитоза попадает в позднюю эндосому. Здесь молекулы CD1d с помощью белковых переносчиков липидов сапозина (Saps) и Gm2-активатора могут нагружаться содержащимися в эндосоме гликолипидами и снова транспортироваться на поверхность клетки. Поглощение экзогенных гликолипидов происходит с помощью липопротеинового рецептора. Затем эти гликолипиды доставляются в эндосому, где они могут вытеснять из комплекса с CD1d эндогенные лиганды.
В настоящее время нет данных о встраивании в молекулы MHC или в родственные им молекулы олигосахаридов. Вероятно, углеводные эпитопы не презентируются Т-клеткам. Именно поэтому полисахариды выступают
в качестве ТН -антигенов, а тимусзависимые свойства приобретают только в комплексе с белками, т.е. в форме гликопротеинов.
