Физико-химические основы взаимодействия антиген-антитело
В основе реакции антиген-антитело лежит взаимодействие между эпитопом антигена и активным центром антитела, основанное на их пространственном соответствии (комплементарности). Это взаимодействие состоит в установлении между эпитопом и активным центром антитела нековалентных химических связей, в основе которых лежат следующие типы межмолекулярных взаимодействий (ни одно из них не является специфичным для реакции антиген-антитело) (рис. 3.25):
- электростатические; они включают ионные (между заряженными группами аминокислотных остатков, например, карбоксильными и аминогруппами) и полярные (связанные с формированием диполей) взаимодействия;
- водородные (связаны с формированием водородных мостиков между гидрофильными группами);
- гидрофобные (обусловлены энергетическими преимуществами контакта гидрофобных участков молекул между собой);
- силы Ван-дер-Ваальса (основаны на взаимодействии электронных облаков).
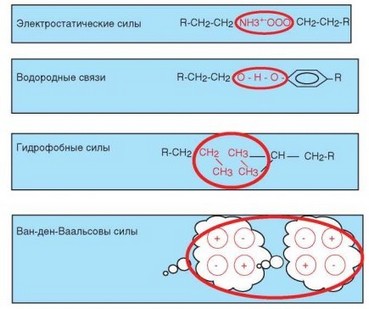
Рис. 3.25. Нековалентные связи, обеспечивающие взаимодействие антигена с антителом. Основные типы связей, играющих роль во взаимодействии антигена с антителом, обведены красным
Все эти взаимодействия проявляются только при близком контакте молекул. Так, интенсивность электростатических взаимодействий убывает пропорционально квадрату расстояния, а ван-дер-ваальсовых сил — пропорционально 7-й степени расстояния. Такое маленькое расстояние между молекулами может быть достигнуто только за счет комплементарности эпитопа и активного центра антитела.
Аффинность антител
Взаимодействие антигена с антителом обратимо и подчиняется закону действия масс, на основе которого рассчитывают константу равновесия. В реакции антител с гаптеном формула имеет вид:
Ка = [AbH]/[Ab][H],
где Ка — константа равновесия (или константа связывания); [Ab] — концентрация несвязанных антител; [H] — концентрация свободного гаптена; [AbH] — концентрация комплекса антитело—гаптен. Размерность константы связывания — 1/моль.
Часто бывает удобно использовать величину, обратную константе связывания, которая обозначается как константа диссоциации (Kd=1/Ka) и выражается в молях.
Константа связывания служит мерой сродства (аффинности) антител и может рассматриваться как показатель специфичности антител к данному эпитопу. Для прямого экспериментального определения аффинности антител используют метод равновесного диализа. Антитела помещают в диализационный мешок, стенки которого проницаемы для гаптена, но не для антител. Диализный мешок с антителами помещают в раствор гаптена, который начинает диффундировать в мешок по градиенту концентрации. После установления равновесия измеряют концентрацию гаптена внутри и снаружи мешка. Превышение первой величины над второй соответствует количеству гаптена, связавшегося с антителами. Результаты выражают в координатах Скэтчарда, используемых при количественной оценке параметров связывания различных веществ (например, лекарственных средств и их рецепторов). Это позволяет рассчитать величину Ка, т.е. оценить аффинность взаимодействия. Помимо кинетического подхода к оценке аффинности существует термодинамический подход, основанный на анализе изменений свободной энергии при взаимодействии антиген—антитело. Аффинность антител существенно меняется в ходе иммунного ответа («созревание аффинности» — см. раздел 3.6.2.2). При этом она возрастает от 10-7-10-8 М до 10-10-10-11 М.
При использовании высокомолекулярных антигенов, содержащих большое число эпитопов, точное определение аффинности взаимодействия каждого эпитопа со своим антителом становится невозможным. В этом случае оценивают суммарное сродство (функциональную аффинность, или авидность). Его определяют чаще всего по устойчивости иммунных комплексов к таким воздействиям, как повышение ионной силы раствора, способствующее разрыву связей между эпитопами и активными центрами антител. Оценку проводят с помощью иммуноферментного или радио - иммунного тестов. Как правило, авидность взаимодействия с антителами целого антигена выше, чем сумма взаимодействий с антителами индивидуальных эпитопов. Это превышение объясняют тем, что диссоциация каждой связи затрудняется при сохранении контакта молекул, удерживаемых за счет других связей.
Существует значительная трудность в определении аффинности поли- клоналных антител в иммунных сыворотках из-за высокой степени их гетерогенности. Эту проблему можно решить, используя моноклональные антитела — антитела с идентичной аффинностью (получают, как правило, в культурах гибридных клеток).
Методы оценки взаимодействия антиген-антитело
Часто возникает необходимость измерения взаимодействия антигена и антитела — как для определения содержания антител, так и для выявления антигенов в биологических жидкостях и растворах. Для этого применяют 2 группы методов. Первая группа основана на непосредственной регистрации связывания антигенов и антител. Для этого один из компонентов (обычно антитела) метят и затем выявляют связывание меченного реагента с другим компонентом реакции. В качестве метки используют радиоактивные изотопы (радионуклиды), ферменты и флуоресцентные красители (флуорохромы). Методы соответственно обозначают как радиоиммунные,
иммуноферментные и иммунофлуоресцентные. Радиоиммунный анализ обычно проводят в прямом варианте, т.е. содержание антигена определяют по количеству связавшихся с ним меченых антител. Наиболее распространенные варианты иммуноферментного метода — конкурентный и двусайтовый. В первом случае оценивают степень ослабления связывания меченных антител с антигеном, фиксированным на пластиковой поверхности, после добавления исследуемого реагента. Во втором случае на пластике фиксируют немеченные антитела, специфичные к одному из эпитопов антигена, к ним добавляют исследуемый материал и содержание в нем антигена определяют по связыванию меченных антител к другому его эпитопу. Схемы постановки иммуноферментного теста представлены на рис. 3.26.
Антитела, меченные флуорохромами, обычно применяют для изучения поверхностных антигенов клеток. Для выявления связывания раньше использовали люминесцентную микроскопию. В настоящее время в цитологических исследованиях чаще применяют проточную лазерную цитометрию (люминесцентную микроскопию продолжают использовать в гистологических исследованиях).
Другая группа методов оценки взаимодействия антител с антигенами основана на регистрации так называемых вторичных феноменов:
- преципитации (осаждения) иммунных комплексов;
- агглютинации (склеивания) частиц, несущих антиген (эритроцитов, частиц латекса и т.д.);
- связывания и активации комплемента с последующим лизисом эритроцитов, несущих антиген и т.д.
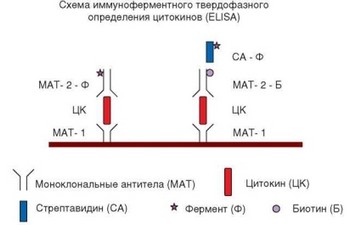
Рис. 3.26. Схема иммуноферментного твердофазного определения антигена (ELISA) на примере цитокина. Коричневая полоса — пластиковая поверхность, на которую последовательно наслаивают указанные реагенты
Эти методы просты, но возникают значительные трудности при их автоматизации и проведении их количественной оценки. Результаты этих реакций оценивают титрами, т.е. последним разведением антител, дающим положительный результат. Использование этих методов сыграло огромную роль на ранних этапах развития иммунологии (тогда их применяли для выявления антител и антигенов с целью диагностики многих инфекционных заболеваний).
Эти методы послужили единственной методической основой работ, заложивших теоретические основы иммунохимии. Так, анализ кривой преципитации, методы которого в 30-е годы ХХ века разработал М. Хейдельбергер (М. Heidelberger), позволил установить основные закономерности взаимодействия антигенов и антител, когда не только отсутствовала возможность получения чистых и гомогенных препаратов антител, но даже их природа была неизвестна. Кривую преципитации строили, измеряя количество белка в осадке, образуемом при взаимодействии антигена с антителом (обычно к стандартному раствору антигена постепенно добавляли антитела и измеряли содержание белка в преципитате), а также концентрацию свободных антител или антигена в растворе. Эта кривая обычно имеет горбовидную форму. Перед формированием максимального количества преципитата находится точка эквивалентности, когда в растворе отсутствуют свободные антигены и антитела.
Изучение и объяснение кривых преципитации привело к созданию теории решетки, согласно которой в основе формирования преципитата лежит бивалентность молекулы антитела и поливалентность антигенов (рис. 3.27). В результате при взаимодействии антигена с малым количеством антител образуются растворимые комплексы из одиночных пар молекул. По мере увеличения количества антител возникает возможность не только каждой молекуле антитела связывать две молекулы антигена, но и разным молекулам антител взаимодействовать с одной и той же молекулой антигена. В результате формируется молекулярная «решетка», не способная удержаться в растворе и выпадающая в осадок. Формулы иммунных комплексов в зоне эквивалентности: АГ2АТ2, АГ3АТ3, АГ2АТ3 (где АГп — число молекул антиге-
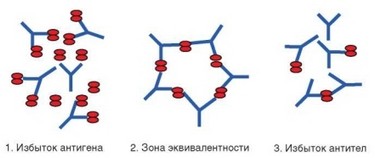
Рис. 3.27. Иммунные комплексы при разных соотношениях антигена и антител
на, а АТП — число молекул антител). Размер решетки и объем преципитата увеличивается с возрастанием относительной доли антител в растворе. Однако добавление антител вскоре после достижения точки эквивалентности приводит к «блокаде» молекулы антигена, когда обе валентности нескольких молекул антитела оказываются связанными с одной молекулой антигена. Это препятствует формированию решетки и сопровождается образованием растворимых иммунных комплексов состава АГ4АТ3, АГ3АТ2 и АГ2АТ.
В настоящее время методы, основанные на преципитации, продолжают использовать в лабораторной и исследовательской практике. Реакцию преципитации в агаре применяют для определения концентрации иммуноглобулинов в сыворотке крови (метод радиальной иммунодиффузии). Преципитация лежит в основе широко используемого метода иммуноблот- тинга («иммунопромокания»), когда электрофоретические фракции белков переносят в целлюлозу и «проявляют», осаждая антителами.
Два других традиционных подхода к определению антител или выявлению антигенов основаны на агглютинации и лизисе. Сущность агглютинации состоит в склеивании частиц (эритроцитов, частиц латекса и и т.д.), несущих антиген, в присутствии антител. Антитела вызывают перекрестное связывание молекул антигена, находящихся на разных частицах, что приводит к их склеиванию. В результате стабильность суспензии частиц, поддерживаемая их взаимным электростатическим отталкиванием, нарушается и образуются агрегаты, обнаруживаемые визуально. В реакциях иммунного гемолиза, помимо антигенов и антител, участвует комплемент, обусловливающий лизис связавших антитела эритроцитов. Аналогичный подход лежит в основе метода лимфоцитотоксичности. Результаты этого метода оценивают по снижению жизнеспособности лимфоцитов, связавших антитела, в присутствии комплемента; гибель клеток выявляют по окраши- ваемости витальными красителями (эозин, трипановый синий). Реакции, основанные на агглютинации и гемолизе, в настоящее время применяют в ограниченных масштабах (для экспрессной полуколичественной оценки содержания антител или антигенов).
