Интерферон (интерфероны)
Согласно современным представлениям, интерфероны (ИФН) — это семейство родственных биологически активных пептидов, продуцируемых клетками животных после стимуляции различными индукторами.
ИФН были открыты в 1957 г. Инактивированный нагреванием вирус гриппа инкубировали на курином эмбрионе, гомогенизировали хорионаллантоис, и оказалось, что надосадочная жидкость подавляла рост активного вируса на хорионаллантоисе. Фактор, содержащийся в гомогенате, был назван интерфероном, и его единственным биологическим свойством долгие годы считалась противовирусная защита.
Значительные успехи в изучении ИФН были достигнуты лишь в 70-е годы. Выяснилось, что его свойствами обладает не один-единст- венный белок, а имеется 3 типа ИФН, различающихся происхождением, некоторыми химическими и биологическими свойствами.
Первый тип а-ИФН (лейкоцитарный) продуцируется В-лимфоци- тами, О-лимфоцитами и макрофагами после индукции различными антигенами (индукторами интерферона). К ним относятся вирусы, полирибонуклеотиды, эндотоксины, чужеродные, вирусинфицирован- ные и опухолевые клетки, бактерии. При очистке и фракционировании оказалось, что а-ИФН представляет собой не один белок, а содержит около 20 белков, относительная молекулярная масса которых от 16 500 до 24 ООО. Белки обладают ИФН-активностью.
Второй тип р-ИФН (фибробластный). Он был открыт первым. Описаны 2 его подтипа. Относительная молекулярная масса Р-ИФН 19 ООО — 20 000. а- и р-ИФН имеют сходные черты: состоят из одинакового числа (165—166) аминокислот и при этом обнаруживают от 30 до 50% гомологии последовательности аминокислотных остатков, тогда как у-ИФН состоит из 146 аминокислот, гены их расположены в 9-й хромосоме, тогда как гены у-ИФН — в 12-й.
Третий тип у-ИФН (иммунный интерферон) отличается по молекулярной структуре и антигенным свойствам от а- и Р-ИФН. Он продуцируется иммунокомпетентными лимфоидными клетками (О- и Т-лимфоцитами) в ответ на множество сенсибилизирующих агентов или после митогенной стимуляции. Недавно был получен рекомбинантный у-ИФН. Молекулярная масса этого белка — 17 110, тогда как очищенный иммунохимическими методами «натуральный» ИФН имел молекулярную массу 40 000 — 70 000. В связи с этим естественный ЙФН гликолизирован. Тем не менее генно-инженерный у-ИФН имел те же свойства, что и «аутогенный».
Механизм регуляции продукции интерферона пока не ясен. Считается, что не активированная клетка не продуцирует ИФН (по крайней мере в определяемых количествах). Этому положению не противоречит тот факт, что ИФН в небольших концентрациях определяется вблизи лимфатических желез желудочно-кишечного и респираторного трактов, поскольку эти органы постоянно контактируют с большим количеством индукторов вирусного или бактериального происхождения, с пылевыми и пищевыми митогенами.
Установлено, что индукторами ИФН может быть большое число различных молекул как с низкой, так и высокой молекулярной массой. Показано также, что ИФН может быть индуктором собственного синтеза. Полагают, что продукция ИФН контролируется каким-то регуляторным белком, репрессирующим действие интерфероногена, а когда действие этого репрессора снимается, происходят активный синтез и выброс ИФН. Вслед за ним под влиянием того или иного интерфероногена для клетки наступает фаза гипореактивности, в течение которой она становится на какое-то время нечувствительной к
действию того же самого индуктора. Правда, в последнее время показано, что простагландин Е снимает такую толерантность. Что касается механизма противовирусного эффекта ИФН, то полагают, что вначале ИФН связывается с соответствующим ему рецептором на мембране клетки. Наличие таких рецепторов установлено бесспорно. Они имеют белковую природу и, вероятно, два участка связывания. Один служит для соединения молекулы ИФН, другой — для активации противовирусного механизма клетки. При этом активируется продукция различных внутриклеточных белков. Среди них важнейшими и наиболее изученными являются 2'-5'-олигоаденилсинтетаза и протеин- киназа. Эти ферментные системы в конечном счете ингибируют распространение (размножение) вируса in vivo. Имеются прямо противоположные данные о связи между устойчивостью клетки к вирусной инфекции и ее способностью продуцировать ИФН.
Система ИФН неспецифична в двух отношениях: различные индукторы могут индуцировать один и тот же тип ИФН; ИФН индуцирует резистентность клетки к широкому кругу различных вирусов (не обязательно через один и тот же внутриклеточный механизм). Важным для понимания механизмов противовирусной активности ИФН явилось наблюдение, свидетельствующее о том, что они повышают экспрессию антигенов главного комплекса гистосовместимости (МНС) на клеточной поверхности. Известно, что МНС-антигены важны для лизиса in vitro вирус-инфицированных клеток сенсибилизированными Т-лимфоцитами. Логично допустить, что классическая противовирусная активность ИФН не ограничивается ранней стадией инфицирования путем ингибиции размножения вируса, но ИФН может быть важен и на более поздних фазах вирусной инфекции, так как он повышает экспрессию МНС- антигенов и цитотоксический эффект Т-клеток.
Противовирусное действие ИФН наиболее изучено. В последние годы у ИФН был обнаружен ряд биологических свойств, предположительно с ним не связанных: ингибиция клеточного размножения (антипролиферативная активность), повышение генерации цитотокси- ческих Т-лимфоцитов in vitro в миксткультуре, увеличение активности нормальных киллеров (НК). Установлен противоопухолевый эффект интерферона. Он действует как «киллер последней клетки» и этим определяется его роль в предотвращении метастазов. Показано, что ИФН повышает экспрессию 1а-антигенов на человеческий лимфоцит периферической крови, уменьшает плотность плазматических мембран, модулирует синтез антител in vivo и in vitro, повышает фагоцитарную активность моноцитов и тканевых макрофагов.
Суммируя представления о функции ИФН в организме, можно сказать, что они являются биорегуляторами, нормализующими физиологические функции клеток, т. е. их можно относить к таким клеточным продуктам, как гормоны, факторы роста, цитотоксины и их антагонисты. В последние годы появился даже термин «физиологические» ИФН.
Специфические гуморальные факторы
Важнейшим фактором специфического иммунитета являются антитела, появляющиеся в ответ на искусственную антигенную стимуляцию или вследствие перенесенной инфекции. Они чрезвычайно гетерогенны по физико-химическим свойствам и биологическим функциям (табл. 1). Эта гетерогенность объясняется их принадлежностью к различным группам сывороточных белков, объединяемых общим названием «иммуноглобулины». Согласно номенклатуре ВОЗ (1964), различают 5 классов иммуноглобулинов: IgG, IgA, IgM, IgD и IgE. Они обладают активностью антител и наряду с очевидными структурными различиями имеют общие черты строения.
Таблица 1. Физико-химические и иммунологические свойства иммуноглобулинов
|
Признак |
IgGl, 2. 3, 4 |
IgAi, 2 |
IgMi. 2 |
IgDi, 2 |
IgE |
|
Коэффициент седиментации, S20.W |
6,6 |
6,6(9, И) |
18 |
7 |
8 |
|
Относительная молекулярная масса |
150 ООО |
150 000 |
900 000 |
183 000 |
200 000 |
|
Условия элюции при хроматографии на ДЭАЭ (молярность) |
0,005 |
0,035 |
0,15 |
0,035 |
0,03 |
|
Содержание углеводов, % |
2,9 |
7,5 |
11,8 |
|
10,7 |
|
Тип Н-цепей |
У |
а |
Ц |
5 |
8 |
|
L-цепей |
кА. |
кк |
кХ |
кХ |
кА. |
|
Молекулярная формула |
У2К2 |
СХ2К2 |
(М2К2)5 |
Й2К2 |
Е2К2 |
|
|
уг^2 |
012X2 |
(Ц2*.2)5 |
82X2 |
?2^2 |
|
Количество в нормальной сыворотке, г/л |
12,4 |
2,4 |
1,2 |
0,03 |
|
|
Период полураспада, дни |
21, 20, 7, 21 |
5, 8 |
5, 1 |
2, 8 |
2, 3 |
|
Прохождение через плаценту Фиксирование к коже |
++++ |
|
|
|
|
|
гомологичной (пассивная кожная анафилаксия) |
|
— |
|
— |
+ |
|
гетерологичной |
+ - + + |
-- |
-- |
- |
+ |
|
Реагиновая активность |
|
— |
-- |
- |
- |
|
Концентрация в слизистых и серозных оболочках |
|
+ + |
|
— |
— |
|
Фиксация комплемента Агглютинация |
+ ± + - + + + + |
+ - + + |
+ + |
" |
~ |
|
Преципитация Реакция Артюса Лизис |
+ + + + + + + + |
+ + + + |
± |
|
|
|
с участием комплемента |
+ + + + |
-- |
-- |
- |
- |
|
» » лизоцима Нейтрализация |
|
|
+ + |
|
|
|
вирусов |
+ |
+ |
+ |
- |
- |
|
токсинов Реакция с фагоцитами |
+ |
|
+ |
|
|
|
клиренс |
+ |
+ |
- |
- |
- |
|
фагоцитоз |
+ |
+ |
+ |
- |
— |
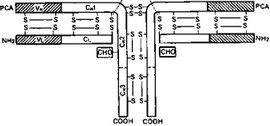
Схема 2. Строение IgG Fa в
Яав
Тяжелая цепь
Легкая цепь
Fc
Схема 3. Третичная структура IgG
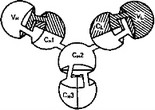
Иммуноглобулины обладают своеобразной структурой и особенностями, отличающими их от других животных белков. Наиболее полные данные получены о структуре IgG, для которого предложены вполне отчетливые схемы строения (схемы 2, 3). IgG человека состоит из двух тяжелых полипептидных цепей Н (отн. молекулярная масса 52 ООО) и двух легких полипептидных цепей L (отн. молекулярная масса 23 500), соединенных между собой дисульфидными связями. Четырехцепочная структура лежит в основе строения и других иммуноглобулинов (схема 4).
Антигенные свойства и гетерогенность иммуноглобулинов. Молекулы иммуноглобулинов — носители сложной мозаики антигенных детерминант. Легкие цепи у всех классов иммуноглобулинов идентичны и подразделяются на 2 серотипа — к и X. В свою очередь к-тип имеет подтипы к-глу, к-асп.1, к-асп.Н. Легкие цепи определяют генетические Inv-детерминанты, тяжелые — специфичность иммуноглобулинов, и в соответствии с пятью известными классами обозначаются у, a, ji, 6, е. Некоторые их классы имеют подклассы или изотипы. В классе IgG известно 4 изотипа (IgGi, IgG2, IgGs и IgG4) и 2 подкласса IgA, IgM и IgD. Тяжелые и легкие цепи
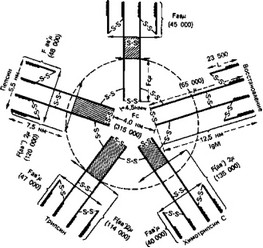
Схема 4. Строение IgM
Папаин
являются носителями различных аллотипических детерминант. Известны 24 генетические детерминанты Gm-фактора IgG. Найдены аллоти- пические детерминанты для класса IgA.
Помимо этих общих групповых структур, идентичных для различных индивидуумов, обнаружены антигенные детерминанты, присущие каждому индивидуальному белку, так называемые идиотипические детерминанты. Они связаны с вариабельными участками полипептид- ных цепей и по существу отражают специфичность антител. Именно поэтому идиотипы не связаны со структурой отдельных классов иммуноглобулинов и оказываются идентичными у разных лиц при наличии у них антител к одному и тому же антигену.
Исследование аминокислотной последовательности Н- и L-цепей, проведенное на гомогенных моноклональных миеломных белках, показало, что каждая из цепей, начиная с N-конца, обладает вариабельным и постоянным участками. Такая особенность имеет большой биологический смысл и связана с функцией данных белков как антител. С одной стороны, вариабельность аминокислотного состава в участке молекулы, где расположен активный центр антитела (Fab-фрагмент), обеспечивает возможность формирования большого числа различных структурных конформаций, комплементарных бесчисленному множеству природных и синтетических антигенных структур, с другой — константность строения Fc-фрагмента обеспечивает постоянства эф-
фекторных функций данного класса иммуноглобулинов, независимо от специфичности активного центра.
В середине тяжелых цепей находится так называемый шарнирный участок. На этом отрезке цепи сосредоточены все дисульфидные связи Н-цепей. Кроме того, он характеризуется высоким содержанием про- лина. Ввиду этих особенностей участок не имеет упорядоченных вторичных структур, что обусловливает, с одной стороны, его легкую доступность для действия различных протеолитических ферментов, с другой — значительную гибкость молекулы. Гибкость шарнирного участка IgG, обеспечивающая определенную свободу смещения Fab- фрагментов относительно друг друга и относительно Fc-фрагмента, имеет весьма важное функциональное значение для эффективного взаимодействия антител с антигенными детерминантами.
При действии на молекулу IgG различных протеаз и восстановителей могут образовываться несколько типов фрагментов. Фрагменты типа Fab содержат легкую цепь и часть тяжелой цепи, а Fc-фрагменты включают в себя только участки тяжелых цепей.
Все многообразные серологические свойства и биологические функции антител определяются их важнейшими структурными субъединицами (Fab- и Fc-фрагментами). С Fab-фрагментами как носителями активного центра связан прежде всего авидитет (авидность антител). Этим понятием принято обозначать такое их качество, от которого зависит прочность образующегося комплекса антиген — антитело. Слагаемые авидности — это аффинность (сродство) и валентность антител (число активных центров, а также их расположение). Аффинность — сила связывания активного центра антитела со специфической антигенной детерминантой в первую очередь зависит от их стерического соответствия друг другу, комплементарности, так как именно последняя создает условия для проявления сил связывания, действующих на очень близких расстояниях, в пределах 1 — 10А. Это силы Ван-дер- Ваальса, водородные связи, электростатические силы притяжения.
Известно, что иммуноглобулины (особенно четко это было установлено для классов G и М) весьма существенно отличаются по авидности. При этом оказалось, что авидность антител, относящихся к IgG и IgM, зависит от того, против какого антигена они направлены. В частности, для крупных корпускулярных антигенов (эритроцитов, фагов и вирусов) большей авидностью отличались антитела, относящиеся к IgM. Более прочное взаимодействие IgM с корпускулярными антигенами объясняется поливалентностью IgM. При этом увеличение прочности связывания с антигеном происходит не только за счет общей энергии взаимодействующих участков, но и вследствие усиления каждой связи в отдельности. Поэтому даже при более низком аффинитете каждого из активных центров антител, относящихся к данному иммуноглобулину, в целом авидность молекулы может оказаться выше, чем у антител класса IgG. По отношению к более простым белковым антигенам преимущество в авидности установлено для антител, относящихся к IgG.
За последние несколько лет обнаружено еще одно необычное свойство Fab-фрагментов. Оказывается, они способны взаимодействовать с интактными IgG, названными гомореактантами или агглютинатора- ми. Это взаимодействие осуществляется в связи с потреблением эндогенного комплемента. Показано, что при введении гомологичного Fab-фрагмента в область коленного сустава кролика возникает воспалительный процесс, напоминающий ревматоидный артрит у человека. Есть основания полагать, что взаимодействие РаЬ-фр1агмент — гомореактант носит неспецифический характер. Эти принципиально новые данные позволяют предположить, что Fab-фрагменты, носители специфических активных центров антител, могут участвовать и в неспецифических защитных реакциях, в частности служить медиаторами воспаления.
Структурные отличия фрагментов разных классов иммуноглобулинов определяют функциональную неоднородность антител к одному и тому же антигену: способность фиксировать комплемент, проникать через биологические мембраны, осуществлять перенос пассивной кожной анафилаксии, нейтрализовать токсины, вирусы и т. д. С точки зрения клинициста, самым существенным в функции иммуноглобулинов является то, что именно различиями эффекторных функций Fc- фрагментов отдельных классов иммуноглобулинов определяются особенности механизмов развития патологического процесса при заболеваниях, связанных с иммунологическими конфликтами.
Одним из важнейших свойств иммуноглобулинов классов G и М, связанным со структурой Fc-фрагмента, является их способность фиксировать комплемент. Биологическое значение такого свойства иммуноглобулинов огромно, так как комплементзависимые реакции играют исключительно важную роль как в защите организма от инфекции, так и при аутоиммунных процессах.
Другое важнейшее свойство, связанное со структурой Fc-фрагмента, — способность IgG проникать через биологические мембраны. Эта особенность обусловливает трансплацентарный переход материнских антител к плоду и участие их в иммунологической защите новорожденного. Иммуноглобулины других классов такой способностью не обладают. Поскольку с классом IgM связана большая часть антител к грамотрицательным бактериям, то новорожденный оказывается плохо защищенным от инфекций, вызываемых подобными микробами. К IgM относятся и групповые изогемагглютинины, а тот факт, что данный иммуноглобулин не способен проходить через плаценту, является положительным моментом. Таким образом, плод оберегается от катастрофических последствий, если мать несовместима с ним по групповым эритроцитарным антигенам.
Наконец, с Fc-фрагментом связаны цитотропные свойства иммуноглобулинов. Это также чрезвычайно важное биологическое свойство, так как характер патофизиологических процессов, возникающих при взаимодействии антигена с антителом, в значительной мере зависит от способности антител и их комплексов с антигенами фиксиро
ваться в тканях и оказывать различные воздействия на соответствующие клетки-мишени.
Говоря о цитотропных свойствах, мы исключаем взаимодействие иммуноглобулинов с клеткой за счет Fab-фрагментов в случае, когда активный центр антитела направлен против клеточных антигенов (например, так называемый иммунный гемолиз), а также «иммунное прикрепление», когда фиксация комплекса антиген — антитело происходит с помощью клеточных рецепторов к комплементу. Имеется в виду лишь такое взаимодействие иммуноглобулинов с клеткой, когда присоединение последних осуществляется благодаря цитотропным участкам Fc-фрагмента. Такого рода взаимодействие приводит к высвобождению из клетки вазоактивных субстанций типа гистамина и обусловливает реакции гиперчувствительности немедленного типа. При этом иммуноглобулины различаются по способности фиксироваться в гетерологичных или гомологичных тканях (кожа). У человека иммуноглобулины класса G способны сенсибилизировать гетероло- гичную кожу морской свинки и обусловливать реакцию пассивной кожной анафилаксии. В то же время IgE гомоцитотропны, т. е. связываются с гомологичными тканями. Поэтому они играют исключительно важную роль при заболеваниях аллергической природы. Тот факт, что взаимодействие такого типа обусловлено именно Fc-фраг- ментами, подтверждается способностью изолированных Fc-фрагмен- тов соответствующих классов иммуноглобулинов сенсибилизировать ткани и конкурировать за рецепторы с интактными белками.
Особенностями строения Fc-фрагмента обусловлены также и другие цитофильные свойства, в частности у человека IgG2 способен соединяться с макрофагами.
Иммуноглобулин G. Иммуноглобулины этого класса составляют около 70—75% общего количества иммуноглобулинов. Их молекулярная масса 150 ООО, константа седиментации 7S. К ним относятся антитела против большинства антигенов различной природы, чем обусловлена их важная роль в защитных реакциях. IgG может специфически взаимодействовать с клеточными рецепторами, макрофагами, комплементом, переносить кожную анафилаксию. IgG является единственным из иммуноглобулинов, способным проходить через плаценту. Иммуноглобулины этого класса разделяются на 4 подкласса (субкласса, изотипа): IgGi, IgG?, IgG3 и IgG4, различающиеся эффек- торными функциями и специфичностью антител. Так, антитела против полисахаридов относятся преимущественно к подклассу IgG2, антире- зусные антитела — к IgG4. Реакцией связывания комплемента обладают преимущественно подклассы IgGi и IgG3, кожной чувствительностью — IgGi и IgG4 и т. д.
Иммуноглобулин A. IgA составляет около 20% общего количества иммуноглобулинов. По физико-химическим свойствам они весьма гетерогенны, могут иметь константы седиментации 7, 9, 11 и 13S и встречаться в форме мономеров, димеров или тримеров.
IgA является основным секреторным иммуноглобулином и играет
важную роль в формировании местного иммунитета. Если в сыворотке крови отношение IgG/IgA составляет 5—6, то в секретируемых биологических жидкостях (молозиво, слюна, кишечный сок, мокрота и т. д.) оно уменьшается до 1 и менее. IgA содержится в количествах около 30 мг на 100 мл секрета. При этом оказывается, что IgA секретируемых жидкостей (кишечного содержимого, молозива, слюны) идентичны между собой, но существенно отличаются от сывороточного IgA. Установлено, что секреторный IgA представляет собой димер (константа седиментации — 11S, относительная молекулярная масса
- ООО) двух субъединиц, аналогичных сывороточному IgA, и, кроме того, содержит два дополнительных пептида. Один из них, называемый либо «транспортным компонентом», либо «секреторным компонентом» (SC), соединен с a-цепью IgA в области Fc-фрагмента и имеет, по различным данным, относительную молекулярную массу 50 ООО, 58 ООО, 74 ООО. Выделенный в чистом виде SC-компо- нент может связываться с сывороточным IgA при добавлении к сыворотке крови.
Биологическая функция SC-компонента, во всяком случае его транспортная функция, сомнительна, и можно предположить, что он повышает устойчивость IgA к протеолизу, так как ни сывороточный IgA, ни 11 S-димеры миеломных сывороточных IgA в аналогичных условиях не обнаруживают подобной резистентности. Наряду с этим комплексы, образующиеся при соединении димеров сывороточного IgA с SC-пептидом, оказались более устойчивыми к протеолитической деградации пепсином и трипсином. Однако, как показали наблюдения В. J. Underdown и К. V. Dorrington (1974), осторожный протеолиз (папаина — 4 ч или проназы — 24 ч без восстановителей) приводит к полному расщеплению IgG, в то время как моноклональный димер сывороточного IgA и секреторный IgA (85%) остаются нерасщеплен- ными. Небольшие концентрации (10 ммоль) дитиотреитола способствуют расщеплению миеломного IgA, а при концентрации восстановителя, составляющей 35 ммоль, расщепляется и секреторный IgA. Эти данные свидетельствуют о том, что конформационные особенности третичной структуры секреторного IgA также определяют его устойчивость к протеолизу.
Вторая дополнительная j-цепь по своей молекулярной массе (13 000—17 700) близка к легким цепям, однако отличается от них большим зарядом. j-Цепи были обнаружены также в IgM и полимерном сывороточном IgA. Причем все они оказались идентичными в физико-химическом и антигенном отношении.
Таким образом, можно утверждать, что j-цепь не является структурным компонентом только секреторного IgA, но играет важную роль в полимерной структуре иммуноглобулинов. Связывание j-цепи с иммуноглобулинами происходит в области Fc-фрагмента.
Один из принципиальных вопросов — происхождение иммуноглобулинов в секретах. В серии морфологических работ, проведенных с использованием метода флюоресцирующих антител, было показано
наличие плазматических клеток, окрашивающихся моноспецифически- ми сыворотками к IgA, IgM и IgG, в срезах околоушной и подчелюстной желез, слизистой оболочки носа и бронхов, собственной пластинки (lamina propria), стенок желудка и кишечника. При этом установлено совпадение между относительным количеством клеток, окрашивающихся антисыворотками к IgA, IgG и IgM, и количественным соотношением тех же классов иммуноглобулинов, определяемых иммунодиф- фузионными методами в соответствующих секреторных жидкостях. В тех случаях, когда использовали антисыворотку, содержащую антитела только к секреторному (SC) фрагменту, не отмечалось свечения плазматических клеток, однако четко флюоресцировали эпителиальные клетки, выстилающие слизистые оболочки.
Приведенные данные вместе с известными фактами о принадлежности антител одинаковой специфичности к различным классам иммуноглобулинов в сыворотке и секреторных жидкостях, а также многократно подтвержденные наблюдения о том, что уровень сывороточных антител и антител в секреторных жидкостях к одному и тому же антигену зависит от способа аппликации антигена (парентерального или энтерального), дают основание постулировать существование автономной системы локального синтеза иммуноглобулинов. Эти наблюдения позволили сформулировать наиболее распространенный в настоящее время взгляд на синтез секреторных иммуноглобулинов как на комплексный процесс взаимодействия двух различных клеточных систем. Предполагается, что местные плазматические клетки синтезируют основные субъединицы антител, секреторный же фрагмент выделяется эпителиальными клетками. Объедицение составляющих компонентов в цельную молекулу происходит на поверхности эпителиальной клетки, внутри ее и в просвете протока.
Количественное определение иммуноглобулинов в секретах с помощью иммунодиффузионных методов сопряжено с рядом трудностей. В частности, наличие в секретах, помимо интактных иммуноглобулинов, различных продуктов их протеолитической деградации приводит к завышению данных. Исследование же иммуноглобулинов кишечного содержимого осложняется еще и тем, что при его взаимодействии с моноспецифическими сыворотками дополнительно формируются неспецифические полосы или кольца преципитации, делающие невозможной истинную оценку уровней иммуноглобулинов. Нам удалось показать, что неспецифическая преципитация обусловлена сывороточными а-глобулинами и альбумином, причем преципитаты с кишечным содержимым формируются и при использовании неиммунных кроличьих сывороток. Только применение для исследования иммуноглобулинов кишечного содержимого у-глобулиновых фракций моноспецифических сывороток позволяет избежать формирования неспецифических преципитатов. SIgA препятствуют фиксации (адгезии) микроорганизмов и вирусов на слизистых оболочках, но не обладают свойствами опсонинов. Иммунологическая реакция с участием секреторных иммуноглобулинов А и М не сопровождается вовлечением
системы комплемента, хотя допускается активация альтернативного пути крупными комплексами антиген — SIgA-антитело.
В реакциях гиперчувствительности немедленного типа (ГНТ) SIgA действует как блокирующее антитело. Крайне важной функцией секреторных иммуноглобулинов следует считать их способность противодействовать массивному поступлению антигенов через слизистые оболочки. Проникшие под эпителий антигены встречают димерные молекулы IgA. Образующиеся при этом иммунные комплексы (ИК) активно выносятся на поверхность слизистых оболочек после их соединения с транспортным фрагментом в мембранах эпителия. Этот процесс «очищения» или иммунологического клиренса как бы дополняет систему фагоцитоза и особенно интенсивен в желчевыводящих протоках. Пищевая антигенная перегрузка способствует напряжению секреторной функции печени и, по-видимому, формированию хронических холангитов.
Система секреторных иммуноглобулинов обеспечивает интенсивный, но непродолжительный иммунный ответ и не формирует клеток иммунологической памяти. Она препятствует контакту антигенов с плазматическими IgG или IgM, которые активируют систему комплемента с образованием мембраноатакующего комплекса С5 — С9, что создает опасность цитолитического разрушения собственных тканей. Такой контакт становится возможным при поступлении антигенов в более глубокие (дистальные) формирования органов. Например, в лимфоидных образованиях толстого кишечника значительно возрастает число клеток, секретирующих IgG. Аналогична топография плаз- моцитов и в бронхах, где система местного иммунитета лимитирована нижними дыхательными путями, а в альвеолах отсутствует. Однако на поверхности альвеол имеются молекулы плазматических иммуноглобулинов и прежде всего IgG. Не менее половины SIgA, обнаруживаемых 6 моче, секретируется в слизистой оболочке мочеиспускательного канала, значительная часть — в мочевом пузыре, тогда как в мочеточниках и тем более в почках система местной защиты не развита. Способность к синтезу SIgA обнаружена и у плодных оболочек плаценты.
IgA не определяются в секретах новорожденных. В слюне они появляются у детей в возрасте 2 мес [Штеренгарц Б. П., 1979], причем первым обнаруживается свободный секреторный компонент SC, и только позднее — полная молекула SIgA. Возраст 3 мес многие авторы считают критическим; именно в этом периоде особенно важны исследования системы секреторных иммуноглобулинов для выявления врожденной или транзиторной недостаточности местного иммунитета. Содержание SIgA в слюне достигает его уровня у взрослых (10—15 мг/100 мл) к 6—8 годам, но при стимуляции лимонным соком уровень выделения слюны достигает такового у взрослых к 3-м годам. Данное обстоятельство требует тщательного соблюдения однотипных условий исследования SIgA во избежание разницы в показаниях. Кроме того, при исследовании SIgA рекомендуется соотносить их концент
рацию и содержание в секретах общего белка или плазматического IgA-мономера.
Таким образом, в первые 3 мес жизни система местного иммунитета (СМИ) не функционирует, однако и в последующие периоды (особенно в раннем детском возрасте) она остается незрелой. Например, секреторные антитела к респираторному синцитиальному вирусу отсутствуют у детей первые 5 мес жизни, а к 10 годам они обнаруживались немного более чем у половины детей. В течение первого года жизни в составе SIgA остается крайне низким титр антител против кишечной палочки.
Иммуноглобулин М. IgM составляют относительно небольшую часть (около 10%) общего количества иммуноглобулинов. Они являются макроглобулинами с относительной молекулярной массой около 900 ООО и константой седиментации 17—19S. При электрофоретическом исследовании макроглобулины мигрируют в зоне р-глобу- линовой фракции. IgM содержат основную массу антител против полисахаридных антигенов и О-антигенов грамотрицательных бактерий, ревматоидный фактор, гемагглютинины и т. д. Макроглобулины синтезируются в ответ на большинство антигенов на ранних стадиях иммунологического ответа. Антитела, относящиеся к этому классу, значительно активнее IgG по агглютинирующей и преципитирующей способности, а также по гемолитическому и опсонизирующему действию. Один из субклассов IgM может фиксировать комплемент. Имеются наблюдения, что у больных с дефицитом IgA увеличивается количество секретируемого IgM.
Иммуноглобулин D. IgD составляют около 0,2% общего количества иммуноглобулинов крови и имеют относительную молекулярную массу примерно 180 000. Они не обладают способностью фиксировать комплемент, переносить пассивную кожную анафилаксию, проходить через плаценту. Роль их в организме мало изучена. Есть сведения об увеличении количества IgD при остеомиелите и некоторых кожных заболеваниях. Известно, что на определенных стадиях дифференцировки IgD выполняет роль рецептора В-лимфоцита. Во время беременности его концентрация в циркуляции возрастает почти вдвое. По-видимому, к этому классу иммуноглобулинов относятся антитела к ДНК и инсулину.
Иммуноглобулин Е. IgE имеет относительную молекулярную массу приблизительно 20 000 и константу седиментации около 8S. Его содержание в плазме составляет почти 0,03 г/л. Значение антител этого класса в организме очень велико, так как именно с ними связана реагиновая активность. Согласно современным представлениям, IgE играет роль пускового механизма при аллергических реакциях немедленного типа. Специальные физико-химические исследования идентифицированного и выделенного нами миеломного IgE, в частности изучение поляризации флюоресценции конъюгатов иммуноглобулина с флюоресцентным красителем, а также спин-меченых IgE и IgG, показали повышенную жесткость молекулы IgE в сравнении с IgG,
уменьшение свободы вращения Fab-фрагментов относительно друг друга. Этими структурными особенностями IgE можно объяснить одно из характерных биологических свойств реагинов, которые, как теперь известно, относятся именно к данному классу иммуноглобулинов, — их неспособность преципитировать аллерген. IgE не проходят через плаценту, не фиксируют комплемент, не способны переносить пассивную кожную анафилаксию, не преципитируют антигены.
Большой интерес представляют вопросы, для чего существуют в организме реагины (иммуноглобулины класса Е), какова физиологическая функция анафилактической реакции? Интересную концепцию в связи с этим предложил И. Д. Ионов (1987). Он внимательно проанализировал имеющиеся в литературе сведения о биологических эффектах анафилактических медиаторов и обратил внимание на то, что они (калликреиноподобный фермент, фактор, активирующий тромбоциты, тромбоксан А2 и другие метаболиты эндоперекисных проста- гландинов С2 и Н2, фактор, генерирующий простагландины, гистамин, медленно действующее вещество анафилаксии), за исключением фактора хемотаксиса эозинофилов, индуцируют тромбообразование. Механизм действия каждого из факторов различен, но в конечном счете все сводится к активации процесса тромбообразования в месте развития анафилаксии. Наряду с этим происходят снижение концентрации факторов свертывания в общем кровотоке и замедление свертывания крови. Таким образом, активацию свертывания крови на участке развития анафилаксии, по-видимому, следует рассматривать как закономерное проявление
А так же в разделе «Интерферон (интерфероны) »
- СПИСОК СОКРАЩЕНИЙ
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- ГЛАВА 1 ГУМОРАЛЬНЫЕ ФАКТОРЫ ИММУНИТЕТА
- Острофазный ответ организма
- Система комплемента
- ГЛАВА 2 КЛЕТОЧНЫЕ ОСНОВЫ ИММУННЫХ РЕАКЦИЙ
- Медиаторы клеточного иммунитета
- Нейтрофилы
- ГЛАВА 3 СИСТЕМА HLA И ИММУНОЛОГИЧЕСКАЯ РЕАКТИВНОСТЬ
- СТАНОВЛЕНИЕ И РАЗВИТИЕ ИММУННОЙ СИСТЕМЫ В ОНТОГЕНЕЗЕ
- ГЛАВА 5 ИММУНОДЕФИЦИТНЫЕ состояния
- Наследственные (первичные) формы ИДС
- Лечение ИДС
- Рецидивирующие и хронические заболевания легких