Система комплемента
Комплемент представляет собой одну из важнейших полифункцио- нальных систем организма. С одной стороны, его можно расценить как принципиальный эффектор антителозависимых реакций. Он участвует не только в литических и бактерицидных реакциях, но и в других антителозависимых эффектах, среди которых повышение фагоцитоза является одной из его важнейших функций in vivo. С другой стороны, комплемент выступает как основная система — амплифика- тор воспалительных реакций. Возможно, что в эволюционном аспекте это его главная (первичная) функция, и совсем не обязательно связывать ее с антителами и другими иммунологическими механизмами.
Центральным событием в процессе активации комплемента является расщепление СЗ-компонента по классическому (названному так только потому, что он был открыт первым, а не в силу его исключительной значимости) и альтернативному пути. Вторым принципиальным моментом является возможная глубина процесса: останавливается
ли он на стадии расщепления СЗ, обеспечивая при этом ряд биологических эффектов, или углубляется далее (от С5 до С9). Последний этап активации часто называют терминальным, заключительным (мембраноатакующим), он является общим, идентичным для классического и альтернативного пути и с ним связана литическая функция комплемента.
В настоящее время насчитывают не менее 20 протеинов плазмы, объединяемых в систему комплемента. Принципиально они делятся на 3 группы. Компоненты, участвующие в классическом пути активации и в заключительном (мембраноатакующем) этапе, обозначены как Clq, Clr, С1„ С4, С2, СЗ, С5, С6, С7, С8 и С9. Белки, участвующие в альтернативном пути активации, называются факторами и обозначены как В, Д, Р. Наконец, выделяется группа белков, регулирующих интенсивность реакции, или группа белков-контролеров: к ним относятся С1-ингибитор (C1INH), СЗЬ-инактиватор (C3bINa), pIH-фактор — С4 — ВР, ингибитор анафилотоксина. Фрагменты, получающиеся при энзиматическом расщеплении основных компонентов, обозначаются малыми буквами (например, СЗа, СЗь, C3d, С5а и т. д.). Для обозначения компонентов или фрагментов, обладающих энзиматической активностью, над их символами ставится черта, например Cl, С42, СЗьВь.
Ниже приводится содержание отдельных компонентов комплемента в сыворотке крови [Forehand I. R. et al., 1988]:
Компонент Концентрация, мкг/мл
Классический путь
С1 70
С1 34
С1 31
С4 600
С2 25
СЗ 1200
Альтернативный путь
Пропердин 25
Фактор В 200
Фактор Д 1
Мембраноатакующий комплекс
С5 85
С6 75
С7 55
С8 55
С9 60
Регуляторные белки
С1-ингибитор 180
Фактор Н 500
Фактор I 34
 Система комплемента относится к числу «триггерных» энзимати
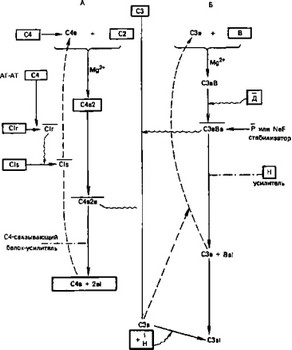
Система комплемента относится к числу «триггерных» энзиматических систем, как и система свертывания крови, фибринолиз, образование кининов. Она характеризуется быстрым и стремительно усиливающимся ответом на стимуляцию. Эта амплификация (усиление) вызывается каскадным феноменом, для которого характерно, что продукты одной реакции являются катализаторами для следующей. Такой каскад может быть линейным, однонаправленным (например, классический путь активации комплемента), или вовлекает петли обратной связи (альтернативный путь). Таким образом, в системе комплемента имеют место оба варианта (схема 1).
Классический путь активируется иммунными комплексами
антиген — антитело, в состав которых в качестве антигенов входят IgM, IgG (субклассов 3, 1, 2; они расположены по убывающей активности). Кроме того, классический путь могут активировать агрегаты IgG, СРБ, ДНК, плазмин. Процесс начинается с активации С1, который состоит из 3 компонентов Clq, Clr, Cls. Clq (относительная молекулярная масса 400), имеет своеобразную структуру: 6 субъединиц с коллагеновым стержнем и неколлагеновой головкой, 6 стержней объединены на конце молекулы, противоположном головке. На головках находятся участки для присоединения к молекулам антител, участки же для присоединения С1Г и Cls расположены на коллагеновых стержнях. После присоединения Clq к АТ С1г путем конформативных преобразований становится С1г, активной протеазой. расщепляет Cls, превращая весь комплекс в серинэстеразу С1. Последняя расщепляет С4 на 2 фрагмента — С4а и С4ь и С2 на С2а и С2ь. Образующийся комплекс С4Ь2Ь(а) представляет собой активный фермент, расщепляющий СЗ-компонент (СЗ-конвертаза классического пути); иногда он обозначается С42.
Регулятором классического пути является С1-ингибитор (C1INH), подавляющий активность С1г и Cls путем необратимого связывания с этими ферментами. Установлено, что C1INH также уменьшает активность калликреина, плазмина и фактора Хагемана. Врожденный дефицит этого ингибитора приводит к неконтролируемой активации С4 и С2, проявляющейся в виде врожденного антиоотека.
Альтернативный (пропердиновый) путь состоит из ряда последовательных реакций, не включающих Cl, С4 и С2-компо- ненты и тем не менее приводящих к активации СЗ. К тому же эти реакции приводят к активации заключительного мембраноатакующего механизма. Активация этого пути инициируется эндотоксином грам- отрицательных бактерий, некоторыми полисахаридами типа инулина и зимозана, иммунными комплексами (ИК), содержащими IgA или IgG, и некоторыми бактериями и грибками (например, Staf. epidermis, Candida albicans). В реакции участвуют 4 компонента: факторы Д и В, СЗ и пропер дин (Р). При этом фактор Д (фермент) подобен Cls классического пути, СЗ и фактор В соответственно аналогичны С4- и С2-компонентам. В результате образуется конвертаза альтернативного пути СЗьВь. Образовавшийся комплекс крайне нестойкий, и для выполнения своей функции он стабилизируется пропердином, образуя более сложный комплекс СЗьВьР. Регуляторными белками альтернативного пути являются piH и СЗь-инактиватор (C3JNA). Первый связывается с СЗь и формирует участок связывания для инактиватора (C3bINA). Искусственное удаление этих факторов или их генетический дефицит, существование которого недавно установлено у людей, приводит к безудержной активации альтернативного пути, которая потенциально может завершиться полным истощением СЗ или фактора В.
Терминальный мембраноатакующий механизм. Как уже было сказано, оба пути сходятся на СЗ-компоненте, который активируется любой из образовавшихся конвертаз С42 или СЗьВь. Для
формирования С5-конвертазы необходимо расщепление дополнительного количества СЗ. СЗь, связанный на поверхности клетки, и свободные В, Р или р1Н формируют участок для связывания С5 и придают последнему чувствительность к протеолизу любой из конвертаз СЗ. При этом от С5 отщепляется небольшой пептид С5а, а остающийся крупный С5ь присоединяется к клеточной мембране и имеет участок для прикрепления Сб. Далее последовательно присоединяются компоненты С7, С8, С9. В результате формируется стабильный трансмембранный канал, обеспечивающий через билипидный слой клетки двустороннее движение ионов и воды. Мембрана повреждается, и клетка гибнет. Так, в частности, осуществляется киллинг чужеродных микроорганизмов.
В ходе активации комплемента образуется ряд фрагментов, пептидов, играющих важную роль в процессах воспаления, фагоцитоза и аллергических реакциях.
Так, расщепление С4 и С2 с помощью Cls ведет к повышению проницаемости сосудов и лежит в основе патогенеза врожденного антиоотека, связанного с дефицитом С1-ингибитора. Пептиды СЗа и С5а обладают свойствами анафилотоксина. Присоединяясь к тучным клеткам и базофилам, они индуцируют выделение гистамина. Связываясь с тромбоцитами, СЗа вызывает секрецию серотонина. Анафило- токсическая активность СЗа и С5а легко разрушается под воздействием карбоксипептидазы В, которая отщепляет от этих пептидов аргинин. Образующиеся продукты приобретают свойства хемоаттрактантов в отношении полиморфно-ядерных клеток, эозинофилов и моноцитов. Комплекс C5i67, не обладающий гемолитическими свойствами, и Вь- фрагмент вызывают хемотаксис только у полиморфно-ядерных лейкоцитов. В нормальной человеческой сыворотке имеется фактор CFi, который подавляет активность С5а в отношении полиморфно-ядерных клеток, устраняя способность его стимулировать освобождение лизо- сомальных ферментов. У больных саркоидозом и болезнью Ходжкина имеется избыток CFi. Этим можно объяснить дефект функционирования указанных клеток. Другой пептид СЗь является сильным опсонином для полиморфно-ядерных клеток (ПМЯ) и макрофагов. Рецепторы к этому пептиду обнаружены и на других клетках (моноцитах и В-лим- фоцитах), однако их значение для функционирования этих клеток пока неясно. Связывание лимфоцитами комплемента, находящегося в составе иммунного комплекса, может играть роль в формировании первичного иммунного ответа.
Исследование системы комплемента в клинической практике может быть использовано для диагноза заболевания, определения активности процесса и оценки эффективности терапии. Уровень сывороточного комплемента в каждый данный момент зависит от баланса синтеза, катаболизма и потребления его компонентов.
Низкие значения гемолитической активности комплемента могут отражать недостаточность отдельных компонентов или нахождение продуктов его расщепления в циркуляции. Следует также иметь в виду,
что интенсивное локальное потребление комплемента в таких участках, как плевра, полости суставов, может не сочетаться с изменением уровня комплемента й сыворотке крови. Например, у некоторых больных ревматоидным артритом уровень сывороточного комплемента может быть нормальным, тогда как в синовиальной жидкости он может быть резко понижен из-за активного его потребления. Определение комплемента в синовиальной жидкости очень важно для диагностики.
Врожденные дефициты комплемента. Наследование дефицитов комплемента — аутосомное рецессивное или кодоминант- ное, поэтому гетерозиготы имеют около 50% нормального уровня компонентов комплемента. В большинстве случаев врожденные дефициты ранних инициирующих компонентов (С1, С4, С2) ассоциированы с системной красной волчанкой. Лица с дефицитом С-компонента подвержены возвратным пиогенным инфекциям. Дефициты терминальных компонентов сопровождаются повышением восприимчивости к гонококковой и менингококковой инфекциям. При этих дефицитах комплемента также встречается системная красная волчанка, но реже. Наиболее часто наблюдается врожденный дефицит С2. Гомозиготный дефицит по этому признаку обнаруживается при некоторых аутоиммунных нарушениях, включающих волчаночноподобные заболевания, болезнь Шенлейна — Геноха, при гломерулонефритах и дерматомиозитах. Гомозиготные по этому признаку индивидуумы не обнаруживают повышенной чувствительности к инфекции, если альтернативный путь активации функционирует нормально. Гомозиготы, имеющие дефицит С2, обнаружены среди практически здоровых людей.
Гетерозиготный дефицит С2 может быть ассоциирован с ювенильным ревматоидным артритом и системной красной волчанкой. Семейные исследования позволили обнаружить, что дефицит С2 и С4 ассоциируется с определенными HLA-гаплотипами.
Дефицит регуляторных протеинов системы комплемента также может иметь клинические проявления. Так, при врожденном дефиците C3INA наблюдается клиническая картина, аналогичная таковой при дефиците СЗ, потому что потребление последнего по альтернативному пути становится неконтролируемым.
А так же в разделе «Система комплемента »
- СПИСОК СОКРАЩЕНИЙ
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- ГЛАВА 1 ГУМОРАЛЬНЫЕ ФАКТОРЫ ИММУНИТЕТА
- Острофазный ответ организма
- Интерферон (интерфероны)
- ГЛАВА 2 КЛЕТОЧНЫЕ ОСНОВЫ ИММУННЫХ РЕАКЦИЙ
- Медиаторы клеточного иммунитета
- Нейтрофилы
- ГЛАВА 3 СИСТЕМА HLA И ИММУНОЛОГИЧЕСКАЯ РЕАКТИВНОСТЬ
- СТАНОВЛЕНИЕ И РАЗВИТИЕ ИММУННОЙ СИСТЕМЫ В ОНТОГЕНЕЗЕ
- ГЛАВА 5 ИММУНОДЕФИЦИТНЫЕ состояния
- Наследственные (первичные) формы ИДС
- Лечение ИДС
- Рецидивирующие и хронические заболевания легких