Пиелонефрит
В процессе изучения роли иммунопатологических реакций в развитии микробного тубулоинтерстициального процесса — пиелонефрита — остается неясной причинно-следственная связь между инфекцией и иммунными реакциями. Либо инфицирование почек происходит в связи с предшествующей парциальной иммунной недостаточности, либо выпадение отдельных звеньев иммунитета — следствие их истощения и депрессии в процессе заболевания. Для решения этого вопроса немалое значение имеет понимание роли самой инфекции в развитии
Таблица 29. Содержание иммуноглобулинов в крови детей с пиелонефритом (М ± гл), в процентах по отношению к возрастной норме
|
Пиелонефрит |
Степень активности |
IgA |
IgM |
IgG |
|||
|
Первичный Вторичный, на фоне метаболических нарушений Вторичный, обструктив- ный |
|
0—1 I—II I—II II—III I—II II—III |
|
110 ± 18 103 ± 16 103 ± 13 134 ±27 100 ± 10 94 ±8 |
156 ± 17 129 ± 26 110 ±11 120 ± 18 166 ±29 149 ± 18 |
131 ±23 118 ± 17 112 ± 8 142 ± 10 138 ±25 116 ± 6 |
|
|
Таблица 30. Содержание иммуноглобулинов в моче детей с пиелонефритом (М ± т), мг/сут |
|||||||
|
Пиелонефрит |
Степень актив ности |
IgA секреторный |
IgA |
IgM |
IgG |
||
|
Первичный Вторичный на фоне метаболических нарушений Вторичный, об- структивный |
0—1 I—II I—II И—III I—II И—III |
1,34 ±0,2 1,9 ±0,32 2,52 ± 0,45 2,49 ± 0,9 0,97 ± 0,23 2,43 ± 0,57 |
0,79 ± 0,2 1,22 ±0,6 0,78 ±0,21 1,76 + 0,5 1,46 ± 0,82 0,87 ±0,25 |
0,14 (у 1 из 10) 0 0,75 (у 2 из 13) 0,27 (у 1 из 7) 0 0 |
5,47 ± 1 5,75 ± 2 18,8 ± 8,1 16,37 ± 6,18 7,07 ± 2,6 8,71 ±3,13 |
||
|
Здоровые дети |
|
|
0,67 ± 0,1 |
|
0,21 ± 0,1 |
0,033 (у 2 из 20) |
2,45 ± 0,53 |
патологии. Превалирующими инфекционными агентами в развитии пиелонефрита до настоящего времени оказываются различные типы эшерихий, содержащих О- и К-антигены, обладающие выраженной уропатогенностью. В настоящее время уже четко определено, что антигены кишечной палочки обладают рядом общих детерминант, с некоторыми структурными белками почечной ткани. Многолетние исследования шведской школы нефрологов, руководимые J. Winberg, показали, что предрасположенность к развитию микробно-воспалительного процесса в почечной ткани и мочевыводящей системе связана с наличием специфических рецепторов на эпителиальных клетках мочевого тракта, с которыми имеют сродство эшерихии. В настоящее время уже определена молекулярная структура рецепторов, которые распознают Р-фимбрии эшерихий. В эксперименте изучается возможность блокирования этих рецепторов, что в будущем откроет перспективы предупреждения рецидивирования микробно-воспалительных заболеваний почек и мочевыводящего тракта [Jodal U., Winberg G., 1987].
Как показали исследования, при пиелонефрите отмечается повышение уровня иммуноглобулинов различных классов (табл. 29). Эти данные, дополненные сведениями об уровне иммуноглобулинов, экс- кретируемых с мочой (табл. 30), позволяют представить следующий механизм вовлечения гуморального звена иммунитета в патологический процесс.
Таблица 31. Экскреция с мочой интактных IgG и их фрагментов у детей с пиелонефритом (М±т), мг/сут
|
Пиелонефрит |
Степень активности |
IgG интактный |
Фрагменты IgG |
|
|
Fab |
Fc |
|||
|
Первичный |
0—1 |
5,47 ± 1 |
4,88 ± 1,3 |
0,81 ± 0,39 |
|
|
I—II |
5,75 ± 2 |
5,09 ± 1,5 |
0,39 ± 0,19 |
|
Вторичный, на фоне метабо |
I—II |
18,8+ 8,1 |
7,2 ± 2,3 |
1,16 ±0,34 |
|
лических нарушении |
II—III |
16,37 ±6,18 |
19,3 ± 6,46 |
3,04 ± 1,06 |
|
Вторичный, обструктивный |
I—II |
7,07 ± 2,6 |
4,11 ±2,3 |
0,38 + 0,16 |
|
|
И—III |
8,71 ±3,13 |
8,5 ± 3,6 |
1,2 ±0,53 |
По-видимому, вслед за антигенным воздействием бактерий происходит выработка секреторных антител, связанных с IgA. Кроме секреторных IgA, в почке возможен синтез IgG. Она становится как бы иммунокомпетентным органом. При развитии патологического процесса выявляется параллелизм: степень активности пиелонефрита коррелирует с выраженностью повышения уровня иммуноглобулинов. Подобная корреляция может вызвать вопрос, потому ли иммуноглобулины продуцируются в повышенном количестве, что активность микробно-воспалительного процесса высока, или пиелонефрит протекает остро, потому что ребенок имеет возможность в должной мере продуцировать иммуноглобулины. Убедительнее второе предположение, так как торпид- ное течение заболевания, склонность к хроническому течению процесса происходит, как правило, при недостаточной продукции иммуноглобулинов, что затрудняет элиминацию бактериальных антигенов, появляется возможность их персистиро'вания в почках.
При развитии и прогрессировании микробно-воспалительного процесса в почках происходит усиленная фиксация иммуноглобулинов, которые привлекаются из сыворотки крови к органу-«мишени». Увеличение катаболизма IgG с образованием большого количества Fab- фрагментов IgG имеет биологический смысл, так как эти фрагменты обладают активностью антител (табл. 31).
Изучение состояния системы клеточного иммунитета при пиелонефрите у детей подтвердило фазность состояния Т-системы иммунитета [Теблоева П. Т. и др., 1983]. В начальный период развития пиелонефрита наблюдается депрессия Т-системы иммунитета с последующим повышением показателей реактивности и специфической сенсибилизации Т-лимфоцитов, которое происходит при стихании патологического процесса. Такое циклическое развитие характерно для остро развивающегося микробно-воспалительного процесса (острый пиелонефрит). Отсутствие положительной динамики со стороны Т-системы лимфоцитов отмечается при хроническом течении пиелонефрита. В тех случаях, когда у ребенка с пиелонефритом выявляется снижение содержания иммуноглобулинов в крови и моче, сохраняется депрессия клеточного звена иммунитета, пиелонефрит принимает торпидное течение. Нередко этот характер развития микробно-восцалительного


процесса в почечной ткани наблюдается на протяжении длительного времени. В этих случаях нет и манифестации начала болезни, что позволяет называть такой вариант пиелонефрита латентным. Является ли это своеобразной формой течения или клиническим вариантом микробновоспалительного процесса у ребенка с признаками дизэмбриогенеза органов мочевой и иммунокомпетентной системы, должно быть предметом специального обдумывания у конкретных больных. Решение данного вопроса значимо и в плане терапевтических назначений. Обычно при снижении параметров клеточного и гуморального иммунитета возникает необходимость прибегать к назначению такого иммуностимулятора, как продигиозан (рис. 7)[2]. Стимулирующим эффектом обладает лизоцим. Убедительные данные стимуляции клеточного звена иммунитета левами- золом и димефосфоном приводит И. Н. Зернов (1985). Его исследования показали, что перед назначением левамизола или другого иммуномодулятора целесообразно провести пробу in vitro, чтобы убедиться в их действенности конкретно на лимфоциты данного ребенка.
При длительном персистировании в почечной ткани микробных антигенов, особенно в сочетании с вирусными, на определенных этапах болезненного процесса, особенно при наличии органного дизэмбриогенеза, может произойти усиленный, плохо контролируемый синтез антител, имеющих органоспецифические свойства. Этому может способствовать подавление активности супрессорных клеток [Miller Т. Е.
et al., 1983]. Возможна вторичная иммунопатологическая реакция, которая по своей характеристике может быть близкой тем сдвигам, которые наблюдаются при абактериальном интерстициальном нефрите. Эта фаза может развиться у больных пиелонефритом, когда удается подавить микробное воздействие. В этих случаях тубулоинтерстици- альный нефрит имеет абактериальную характеристику. Бактериальные же антигены остаются в качестве тех пусковых, которые способствовали развитию тубулоинтерстициальных изменений.
Иммунный статус у детей с наследственными и врожденными нефропатиями
Роль иммунных сдвигов в развитии нефропатий при наличии врожденного или генетического детерминированного дефекта строения почек наименее изучена в нефрологии. Однако это белое пятно должно быть устранено по нескольким причинам.
- Наследственные и врожденные заболевания различных органов и систем, в том числе и почек, по мировой статистике, занимают существенное место среди других: заболеваний, приводящих к ранней инвалидизации детей и подростков.
- Время закладки и развития иммунокомпетентной системы и органов мочевой системы очень близки, поэтому трудно представить, что дефекты развития одной из них не сопряжены с неполноценностью другой.
- Наследственные и врожденные заболевания, совместимые с жизнью, могут длительно существовать, не вызывая отчетливых признаков болезни у ребенка. Декомпенсация состояния нередко связана с повторными интеркуррентными инфекциями, что подразумевает тот или иной вариант парциального ИДС. Последнее в свою очередь является основой для вторичных иммунопатологических сдвигов.
Врожденный нефротический синдром
Наиболее распространенной и изученной в иммунологическом плане формой врожденного нефротического синдрома является финский тип этой патологии. Основой заболевания является микрокистоз почек, передающийся аутосомно-доминантным путем. Иммунологические исследования 60—70-х годов показали наличие антипочечных антител у матери, передающихся трансплацентарно ребенку. Специальные работы были направлены на выделение и описание особенностей антигенов базальных мембран ребенка с финским типом нефротического синдрома. У родителей же в характеристике антигенов базальных мембран клубочков отклонений, как правило, не выявляется. Основой ранней диагностики этой тяжелой, по сути дела фатальной, патологии явилась возможность определения в амниотической жидкости и в сыворотке беременных женщин высокого уровня а-фетопротеина. При нормальном содержании а-фетопротеина рождались дети без этой патологии.
Другие варианты врожденного нефротического синдрома могут зависеть от внутриутробного инфицирования при наличии у матери
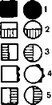
- — нефротический синдром; 2 — повышение подвижности почек; 3 — заболевания глаз; 4 — гипероксапурия; 5 — атопические реакции.
цитомегалии, сифилиса, токсоплазмоза. При расшифровке сущности заболеваний акцент делается на характере иммунных сдвигов в связи с наличием хронической специфической инфекции.
Семейный нефротический синдром
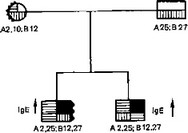
Неблагоприятный прогноз имеет нефротический синдром, развивающийся у ребенка в возрасте до года, в тех случаях, когда аналогичная патология имеет место и у других членов семьи. В тех случаях, когда заболевание проявляется позднее, его характеристики, как клиникоиммунологическая, так и морфобиоптическая, близки к таковым нефротического синдрома, не имеющему семейного распространения. Нередок мезангиопролиферативный вариант заболевания с глыбчатым свечением различных фракций иммуноглобулинов и СЗ-фракцией комплемента в гломерулах. Дебатируется полигенный тип наследования патологии. В этом плане интересны и важны данные, полеченные у различных членов семей при исследовании антигенов HLA. Наблюдались 2 мальчика в одной семье с гормоночувствительным вариантом нефротического синдрома, в фенотипе которых имелся антиген HLA В12, а в крови был повышен титр IgE (схема 16).
Наследственный нефрит, включая синдром Альпорта, рассматривается как генетически детерминированная первичная гломерулопатия. Нередко при идентификации патологии используется термин «неиммунная гломерулопатия», в основе которой лежит дефект строения базальной мембраны клубочков. Имеются данные, что у больных наследственным нефритом антитела не фиксируются на базальной мембране в связи с отсутствием в их структуре одного или нескольких нормальных антигенов. В частности, у них отсутствует антиген Гудпасчера [Kashtan С. et al., 1986]. Он представляет собой молекулу с относительной молекулярной массой 25 000—54 ООО как часть неколлагеновой структуры
- типа коллагена, локализованного в гломерулярных базальных мембранах [Pysey С. et al., 1987].
В настоящее время появились описания случаев быстро прогрессирующего гломерулонефрита, который развивался у больных с синдромом Альпорта после почечной трансплантации, т. е. когда в организме появились антигены Гудпасчера.
Иммунопозитивный результат при иммунофлюоресцентном исследовании почечного биоптата противоречит возможности наличия у такого больного наследственного нефрита. Однако по мере изучения заболевания ученые периодически возвращаются к вопросу о влиянии на его развитие иммунопатологических реакций. Этому вопросу было посвящено специальное исследование [Фокеева В. В. и др., 1978]. Исследование гуморального и клеточного иммунитета у детей с наследственным нефритом выявило снижение активности энергетических ферментов лимфоцитов, а также неполноценность функциональной способности Т- и В-системы лимфоцитов.
При количественном определении фракций иммуноглобулинов в крови и моче у детей с наследственным нефритом обнаружена тенденция к повышению фракции IgG при наследственном нефрите без тугоухости. У детей с синдромом Альпорта чаще отмечалась тенденция к снижению содержания в крови IgG. При выраженной протеинурии у них отмечалось повышение экскреции IgG с мочой. Обращало на себя внимание повышенное выделение с мочой IgA. Вследствие нарушения синтеза секреторного IgA у детей с наследственным нефритом было возможно снижение местного иммунитета, что в свою очередь способствовало бы присоединению инфекции мочевой системы. У детей с наследственным нефритом снижение активности клеточного и гуморального звеньев иммунитета вряд ли является первичным, однако оно может иметь определенное значение в появлении некоторых клинико-морфологических синдромов, свойственных наследственному нефриту. Несовершенство клеточного звена иммунитета может проявиться нарушением «иммунологического надзора», обеспечивающего гистологический гомеостаз организма на различных этапах развития, с одной стороны, и снижение защитных механизмов иммунитета в постнатальном периоде развития ребенка — с другой. Возможность развития вторичного феномена аутоагрессии остается сомнительной.
Анатомические аномалии строения органов мочевой системы и иммунная система
Нередко у детей наблюдается сочетание анатомического и структурного дизэмбриогенеза почек и мочевыводящего тракта. В тех же случаях, когда ведущим и клинически основным оказываются анатомическая аномалия мочевой системы, иммунные сдвиги, выявляемые у детей, как правило, коррелируют с выраженностью микробно-воспа- лительного или абактериального тубулоинтерстициального поражения. Однако необходимо подчеркнуть, что при грубом анатомическом дефекте с резко выраженными признаками обструктивной уропатии, как правило, микробно-воспалительный процесс носит прогрессирующий рецидивирующий характер и нередко определяет прогноз заболевания. Именно в этих случаях выявляется выраженное снижение клеточного и гуморального иммунитета, призванных защищать организм от повреждающего влияния экзогенных антигенов. Однако в тех стадиях болезненного процесса, когда обычно осуществляются иммунологические исследования, провести грань между гипоиммунным состоянием, предшествующим инфицированию мочевой системы или связанным с рецидивирующей мочевой инфекцией, оказывается весьма затруднительно.
Рефлюкс-нефропатия
В последние годы все большее внимание привлекается к изучению склерозирования почечной паренхимы, которое развивается при наличии пузырно-мочеточникового рефлюкса. Существуют различные точки зрения на генез этого поражения. Одной из оригинальных гипотез является взгляд на патогенез патологии, который высказывает J. Winberg (1984), называя это заболевание не рефлюкс-нефропатией, a «delay-nephropathy», что буквально означает «отсроченная нефропатия». По его мнению, в развитии патологии несомненное значение имеют инфекция и своеобразие иммунного ответа больного. Специальные исследования роли белка Tamm-Horsthall, проведенные A. Fast (1984), показывают, что в развитии рефлюкс-нефропатии и других нефро- и уропатий, связанных с анатомическими аномалиями строения органов мочевой системы, принимает участие этот белок, который может вызывать появление антител к нему, что на следующих стадиях формирования заболевания часто проявляется и другими признаками аутоиммунного процесса.
А так же в разделе «Пиелонефрит »
- Рецидивирующие и хронические заболевания легких
- Нарушения иммунитета и острые респираторные заболевания
- ИММУНОПАТОЛОГИЯ ПРИ ЗАБОЛЕВАНИЯХ ПОЧЕК
- Основные типы иммунопатологических проявлений
- Образование антител к базальным мембранам
- Образование ИК и поражение почек (ИК-нефрит)
- Система комплемента при воспалительных заболеваниях почек на иммунной основе
- Нарушения гемостаза при нефритах
- Особенности иммуногенеза при нефротическом синдроме
- Терапия иммунных гломерулопатий
- Иммунопатологические характеристики тубулоинтерстициального нефрита
- Почечные дисплазии
- ГЛАВА 10 ЮВЕНИЛЬНЫЙ РЕВМАТОИДНЫЙ АРТРИТ