Система комплемента при воспалительных заболеваниях почек на иммунной основе
В развитии гуморальных реакций, ответственных за почечное поражение, большое место принадлежит комплементу. Уже в 60-е годы было показано на экспериментальных моделях, что подавление активности комплемента, циркулирующего в крови, может предупредить развитие нефротоксического нефрита. При многих формах гломеру- лонефрита содержание комплемента в крови снижено. Последний обнаруживается в депозитах почечной ткани. Введение меченных изотопами компонентов комплемента взрослым больным выявляет их повышенный катаболизм. Наиболее существенна роль комплемента в иммунопатологических реакциях II типа, когда происходит разрушение клеточных мембран в связи с реакцией антиген — антитело (схема 10). Активизация комплемента — сложная цепная реакция, в которой последовательно участвует около 20 известных компонентов (белков) комплемента. До сравнительно недавнего времени уменьшение содержания в крови того или иного компонента комплемента связывали с текущим иммунным процессом. Однако в последние годы стало очевидным, что иммунопатологический процесс может происходить в связи с дефицитом той или иной фракции комплемента. В этом отношении весьма демонстративны исследования Т. Н. Coleman и соавт. (1983), которые показали дефицит С6- и С7-компонентов комплемента в семьях с больными мембранозно-пролиферативными гломерулонеф- ритами (схема 11). Следует вывод, что парциальный дефицит одного или нескольких компонентов комплемента может оказаться фактором, предрасполагающим к развитию гломерулонефрита.
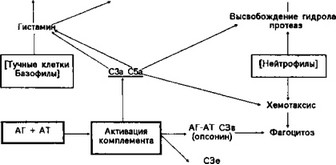
Юпочевым в развитии иммунопатологических сдвигов по-прежнему считается СЗ-компонент комплемента, так как эпителий клубочковых капилляров имеет рецепторы для активизированного СЗь-компо- нента.
При воспалительных заболеваниях почек система комплемента активируется после «распознавания» Fc-фрагмента антител (в составе
Реакция АГ-АТ __ IgM, IgG
Комплекс СЗа С5-С9
Активация протеолиза Тромбин Плаэмин Трипсин
СЗ
Альтернативный путь
Активаторы:
IgA
Ренин
Лимфокины
Полисахариды
Бактерии
Изменение мембран клеток Кристаллы солей
Усилители:
Пропердин СЗ NEF
Мембранолиз (цитолиз) Стимуляция образования
медиаторов воспаления
иммунных комплексов или депозитов) компонентом Clq, что ведет к повышению активности компонентов-регуляторов (точнее, протеоли- тических ферментов) — С1г и Cls расщепляющих молекулы компонентов С2 и С4. Одним из метаболитов С2 становится кинин, повышающий проницаемость капилляров. С другой стороны, активированный биомолекулярный комплекс (С2-С4-конвертаза) фиксируется на клеточных мембранах и расщепляет компонент СЗ на следующие фрагменты: СЗа-анафилактоидный фактор, СЗь-фактор хемотаксиса нейтрофилов и комплекс, расщепляющий компонент С5, из которого образуются С5а (также фактор хемотаксиса и анафилотоксин) и С5ь, который связывается с компонентом С6, что ведет к образованию мембраноатакующего комплекса С5—С9. Последний обеспечивает образование ионных каналов в клеточных мембранах, вызывает внутриклеточный отек и лизис клеток. Однако более значительную роль в повреждении тканей, особенно на начальных этапах нефрита, играют нейтрофилы, привлеченные хемотаксичёскими факторами (СЗе, С5а). Схематически взаимодействие системы комплемента и клеток, участвующих в воспалении, представлено на рис. 5. Продемонстрированная на схеме последовательность включения отдельных компонентов комплемента представляет собой классический путь его активации.
При гипокомплементарном гломерулонефрите, как правило, вовлекается и альтернативный путь активации с отложением в почках СЗ, пропердина и компонентов мембраноатакующего комплекса. В этих случаях в составе депозитов не находят компонентов начальных этапов активности классического пути — Clq и С4. Кроме того, при снижении плазматического уровня СЗ и фактора В концентрация С4 нормальна, что также свидетельствует об активации комплемента не
по классическому, а по альтернативному пути. Еще одним доказательством такой активации служит обнаружение в крови «нефритического фактора» (СЗ NEF или NEF). Согласно современным данным, этот фактор представляет собой аутоантитело по отношению к биомоле- кулярному комплексу СЗ и фактору В. Образующийся при их взаимодействии сложный иммунный комплекс активирует СЗ-конвертазу, что ведет к образованию фрагмента СЗь с активацией всех последующих звеньев системы комплемента. Активность нефритического фактора зависит от присутствия ионов магния. Он представляет собой термостабильный белок; при электрофорезе — белок располагается в зоне у-глобулина. Имеются данные о том, что по химической структуре СЗ NEF идентичен IgG [Schreiber Н., Miller-Eberhard М., 1979]. Однако
если у больных гломерулонефритом обнаруживается в крови C3NEF, в биоптатах почек — депозиты СЗ и пропердина, тогда как IgG не определяется. Возможно, это связано с распадом комплекса in situ и вымыванием нефритического фактора.
Альтернативный путь активации комплемента компенсирует недостаточную активность системы при наследственных дефектах синтеза отдельных компонентов. Поражение почек отмечено при следующих дефицитах в системе комплемента:
С1Г — системная красная волчанка, фокальный гломерулонефрит; С4 — системная красная волчанка, гломерулонефрит; С2 — системная красная волчанка, мембранозно-пролиферативный гломерулонефрит.
Связывание комплемента наиболее отчетливо выражено при ИК- нефрите, когда имеет место значительное преобладание антител над антигеном и образуются крупные, агрегированные ИК (табл. 26).
Таким образом, крупные ИК обладают способностью фиксировать комплемент и почти полностью поглощаются фагоцитами, тогда как относительно малые по размеру ИК не связывают комплемент, слабо фагоцитируются. Независимо от размеров ИК высвобождение лизо- сомных энзимов и усиление продукции свободных кислородных радикалов (и соответственно перекисей) оказываются примерно одинаковыми. Следовательно, при хемотаксисе нейтрофилов, их скоплении в
Таблица 26. Зависимость биологического действия ИК от их величины [Weiss I., Ward А., 1982]
|
Относительные функциональные характеристики |
Соотношение антиген/антитело в ИК |
|
|
1:5 (крупные ИК) |
1:2 (мелкие ИК) |
|
|
Связывание комплемента |
100% |
lt;2% |
|
Поглощение их нейтрофилами |
95% |
24% |
|
Высвобождение лизосомных ферментов (N-ацетил-глюкозаминидаза и др.) |
12% |
12% |
|
Стимуляция продукции перекиси водорода, нмоль/ч |
43 ± 5,8 |
52,1 ± 2,9 |
очаге воспаления локальный эффект не зависит от размеров ИК, однако более крупные ИК включают комплементарную систему «усиления» воспалительной реакции.
Клеточные защитные реакции при воспалительных заболеваниях почек на иммунной основе
Система фагоцитов. Полиморфно-ядерные лейкоциты, привлеченные хемотаксическими факторами иммунных реакций, фагоцитируют депозиты и разрушают соответствующие участки базальной мембраны с помощью лизосомных ферментов. Базальная мембрана фрагментируется, значительно возрастает выведение антигена базальных мембран.
Однако в значительной мере механизм повреждения клубочков и нефрона в целом связаны не с нейтрофильными, а с другими медиаторами воспаления. Прежде всего при исследованиях было обращено внимание на систему фибриногена — фибрино-фибринолитических факторов. Отложения фибрина обнаруживаются в капиллярах клубочков, в субэндотелиальных пространствах, в мезангии при нефроток- сическом нефрите. При иммунокомплексном нефрите этот феномен менее выражен, что связывают с деградацией фибрина.
Повреждение тканей могут вызвать кислые и нейтральные гидро- лазы (катепсины), эластаза, коллагеназа, катионные белки. Нейтрофи- лы выделяют также биологически активные продукты окисления арахидоновой кислоты — простагландины и лейкотриены, поддерживающие процесс воспаления (табл. 27). Их действие на почечные клубочки охарактеризовано ниже. Показано, что блокада мембранных Fc-pe-
цепторов для IgG (например, интактными молекулами данного иммуноглобулина или его Fc-фрагментами) подавляет высвобождение ли- зосомных ферментов при воздействии ИК [Альбини Б. и др., 1982].
Клетки мезангиума обладают способностью фагоцитировать чужеродные соединения и макромолекулы. Однако в эксперименте с воспроизведением МК-нефрита было показано, что ИК не подвергаются фагоцитозу этими клетками и располагаются между ними, т. е. в матриксе мезангиума. Этот факт пока не получил четкого объяснения, но предполагается, что в его основе лежит дисфункция мезангиальных клеток, связанная с нарушением гломерулярной гемодинамики.
Клетки мезангия содержат миозин (актомиозин), что обеспечивает им функцию сократимости, необходимую при фагоцитозе. Кроме того, они характеризуются наличием мебранного белка — фибронектина, свойственного фибробластам. Несомненно, клетки мезангиума содержат множество функциональных белков, но они пока мало изучены и пока привлекли внимание лишь актомиозин и фибронектин. При мембранопролиферативном гломерулонефрите количество этих белков снижено, но для мезангиопролиферативного гломерулонефрита характерно их увеличение, еще более выраженное при диабетической нефропатии. В пересаженных почках возрастает только содержание фибронектина, а в гиалинизированных гломерулах оба вида белка не обнаруживаются.
Одним из важнейших проявлений активации фагоцитов при поглощении чужеродных частиц, иммунных комплексов служит переход в активное состояние мембранной НАФН-оксидазы, переносящей электроны на молекулярный кислород, образуя его частично восстановленные формы — супероксид-анион, синглетный кислород, гидроксильный радикал, перекись водорода (схема 12). Нередко все эти продукты объединяют термином «токсические формы кислорода», с учетом их повреждающего действия как на фагоцитированные частицы, так и на окружающие клетки. В здоровых клетках ряд ферментов защищает их от токсического действия супероксид-аниона (супероксид-дисмутаза, глютатион-редуктаза, каталаза и др.). Однако при патологии эта защита может оказаться недостаточной, не говоря уже о наследственных дефектах синтеза этих ферментов, когда их отсутствие ведет к постоянным или рецидивирующим воспалительным процессам. В. А. Комаровым (1986) проведены исследования величины окислительного метаболизма стимулированных опсонизированными микрококками гра- нулоцитов. Оказалось, что «дыхательный взрыв» метаболизма фагоцитирующих клеток отражает степень активности гломерулонефрита и интерстициального нефрита. При наследственном нефрите и заболеваниях почек в стадии хронической почечной недостаточности отмечается незначительное повышение окислительного метаболизма, что может говорить о предсуществующей при наследственном нефрите или развивающейся при тяжелом почечном заболевании недостаточности супероксидобразующей функции стимулированных гранулоци- тов.
Схема 12. Высвобождение медиаторов реакции воспаления из нейтрофилов при фагоцитозе опсонизированных частиц.
Гиперемия Отек Некроз
(лейкоцитоз)
Примечание. Объяснение в тексте.
В острый период патологического процесса «дыхательный взрыв» окислительного метаболизма фагоцитированных клеток может, очевидно, в какой-то мере «локализовать» воспалительный процесс. Но при продолжающемся выделении токсических форм кислорода объектом их воздействия оказывается арахидоновая кислота, высвобождающаяся из фосфолипидов клеточных мембран. Продукты окисления арахидоновой кислоты (лейкотриен В, 5-гидроксиэйкозатетраеновая кислота) представляют собой мощные факторы хемотаксиса. Совместно с другими белковыми факторами они могут способствовать дальнейшему притяжению фагоцитов и других клеток к очагу воспаления. Не исключена возможность образования и таких биологически активных веществ — продуктов арахидоновой кислоты, какими являются лейкотриены С и D, составляющие медленно действующее вещество анафилаксии, а также простагландины. Среди естественных ингибиторов воспалительной реакции ведущее значение придается лимфоцитам — Т-супрессорам, инактиватору СЗь, ингибиторам протеолитичес- ких ферментов, в частности a-системе антипротеаз. Несомненно, велика роль ретикулоэндотелиальной системы, простациклинов как ингибиторов агрегации тромбоцитов. Глюкокортикоиды способствуют стиханию воспаления, развивающегося на иммунной основе. Одним из мало изученных до недавнего времени эффектов влияния стероидов было их действие на окислительный метаболизм гранулоцитов. В исследованиях, проведенных В. А. Комаровым (1986), было показано, что при использовании глюкокортикоидов в лечении больных гломе- рулонефритом отмечаются два варианта изменений показателей окислительного метаболизма: первый, когда при лечении преднизолоном
Рис. 6. Показатели окислительного метаболизма гранулоцитов при нефротической форме гломерулонефрита до и на фоне глкжококортикоидной терапии [ммоль О2 (120 мин) 10_| мл крови].
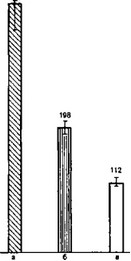 а — II — III степень активности (без преднизоло- на); б — II — III степень активности (на фоне пред- низолона); в — 0—I степень активности (без пред- низолона).
а — II — III степень активности (без преднизоло- на); б — II — III степень активности (на фоне пред- низолона); в — 0—I степень активности (без пред- низолона).
наступает ремиссия заболевания, что происходит параллельно с резким снижением показателей окислительного метаболизма гранулоцитов — ОМ (рис. 6); второй — когда при выраженной гормонорезистентности в процессе лечения не отмечается положительных сдвигов со стороны показателей окислительного метаболизма гранулоцитов.
Система Т- и В-лимфоцитов крови при нефритах
Инфильтрация клубочков и канальцев полиморфно-ядерными лейкоцитами, характерная для экспериментального нефрита, выявляется при остро развившемся нефрите или при его обострении. Этот феномен рассматривается как реакция «острой» фазы воспаления. При развитии хронического гломерулонефрита происходит смена клеточного состава воспалительных инфильтратов з почечной паренхиме и преобладающими клетками оказываются мононуклеазы. Это указывает на вовлечение в процесс системы клеточных иммунных реакций (не исключено, что в прогрессировании заболевания участвуют киллеры или сенсибилизированные Т-лимфоциты). Сенсибилизация лимфоцитов нередко происходит в связи с уже развернувшимися реакциями, связанными с наличием ИК или АБМ. В свою очередь, когда уже произошла сенсибилизация лимфоцитов с развитием гиперчувствительности замедленного типа, отмечается повышенная продукция лимфокинов, кото
рые в свою очередь способствуют дальнейшему повреждению мембранных структур. При активно протекающем гломерулонефрите абсолютное количество В-лимфоцитов повышается, что отражает интенсивность гуморального ответа на антигены — этиологические факторы нефрита. При нерезко выраженной протеинурии отмечается повышение в крови иммуноглобулинов различных классов. В случаях нефрита с большой протеинурией в связи с повышенной потерей IgG с мочой уровень их в крови может быть снижен. При тяжелом деструктивном процессе в почечной ткани с выраженными фибропластическими изменениями с мочой выделяются крупномолекулярные фракции иммуноглобулинов.
Количество Т-лимфоцитов в крови, как при первичных, так и связанных с системной красной волчанкой нефритах, обычно снижено [Гареева И. Е., 1983]. При различных формах гломерулонефрита отмечается недостаточность некоторых функций Т-лимфоцитов (прежде всего супрессорной). Все большую популярность приобретает теория иммунодефицита как основы развития различных форм гломерулонефрита. Исследования Е. К. Баландиной (1980) подчеркивают, что при незрелости почечной ткани имеются особенности реагирования иммунокомпетентной системы на внешние или эндогенные антигены, что приводит к развитию ГЗТ. Роль реакций ГЗТ в развитии нефритов продолжает изучаться, тем более что при различных формах заболевания в биоптатах обнаруживается специфическая картина, характеризующая ГЗТ [Серов В. В. и др., 1983].
А так же в разделе «Система комплемента при воспалительных заболеваниях почек на иммунной основе »
- Рецидивирующие и хронические заболевания легких
- Нарушения иммунитета и острые респираторные заболевания
- ИММУНОПАТОЛОГИЯ ПРИ ЗАБОЛЕВАНИЯХ ПОЧЕК
- Основные типы иммунопатологических проявлений
- Образование антител к базальным мембранам
- Образование ИК и поражение почек (ИК-нефрит)
- Нарушения гемостаза при нефритах
- Особенности иммуногенеза при нефротическом синдроме
- Терапия иммунных гломерулопатий
- Иммунопатологические характеристики тубулоинтерстициального нефрита
- Пиелонефрит
- Почечные дисплазии
- ГЛАВА 10 ЮВЕНИЛЬНЫЙ РЕВМАТОИДНЫЙ АРТРИТ