Почечные дисплазии
Среди структурного почечного дизэмбриогенеза внимание к иммунным сдвигам привлечено в основном при патологических процессах, которые сопровождают нерезко выраженную гипопластическую дисплазию почечной ткани [Стефани Д. В. и др., 1985]. Очевидно, это в больщей мере связано с тем, что клинически заболевание протекает
как нефритоподобное, а при морфобиоптическом исследовании выявляются признаки почечного дизэмбриогенеза, не укладывающиеся в рамки грубой почечной дисплазии [Bernstein J., 1975], при которой наблюдается наличие в почечной ткани элементов мезенхимы. При нефропатиях, связанных с гипопластической почечной дисплазией, выявляется, как правило, мезангиальная пролиферация. При манифестации патологического процесса нередко ее степень такова, что появляется возможность говорить о мезангиопролиферативном гломеру- лонефрите. В некоторых случаях в биоптате выявляется свечение IgM. Эти данные тем более интересны, что в настоящее время в литературе обсуждается вариант почечного заболевания, которое условно носит название IgM-нефропатия [Huisel P. et al., 1984].
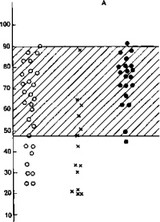
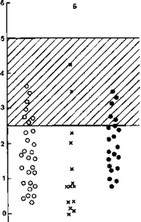
Проведены исследования функционального состояния иммунной системы у детей с нефропатией, связанной с гипопластической дисплазией на ранней стадии выявления патологии, когда не было клиникоморфологического симптомокомплекса, свидетельствующего о наслоении нефрита [Харина Е. А., 1981]. Оказалось, что независимо от того, была ли это гипопластическая дисплазия sui generis или она сочеталась с отчетливыми метаболическими нарушениями и (или) анатомическими аномалиями строения органов мочевой системы, определялось два феномена. Первый — это снижение активности нейтрофилов периферической крови (по показателям ФЧ), а также функциональная недостаточность макрофагов при проведении реакции «кожное окно». Показатели фагоцитоза варьировали у отдельных больных, но общая тенденция отчетливо прослеживалась, особенно при сравнении с данными, полученными у больных нефритом (рис. 8). Второй феномен — увеличение уровня IgM и снижение IgG при нормальном количестве В-лимфоцитов в периферической крови (рис. 9). Изменения содержания иммуноглобулинов в крови могут быть объяснены нарушениями функционирования В-лимфоцитов — изначальный синтез IgM по причинам дизэмбриогенеза не только почек, но и системы иммунитета сохраняется у детей на протяжении жизни. Это может быть связано с действием в процессе развития плода повреждающего фактора (тератогена), который вмешивается в развитие не только почки, но и системы иммунитета, так как сроки формирования этих систем (10—12 нед) близки. Частичный блок переключения синтеза IgM на IgG и является выражением нарушения внутриутробного развития системы иммунитета. Правда, можно также предположить, что под влиянием тех же тератогенных воздействий, которые приводят к развитию гипопластической дисплазии, происходят изменения функциональной активности В-лимфоцитов, которые проявляются в парциальном нарушении синтеза именно IgG. В любом случае выявленные феномены заслуживают внимания при объяснении возможности наслоения на структурный почечный дизэмбриогенез вторичных изменений, которые клинически рассматриваются как нефрит у ребенка с гипопластической дисплазией. В качестве антигенов, способствующих его развитию, могут выступать различные вирусы, так как этим детям свойственны частые респира-
О 1 X 2 #3 '///,4
Рис. 8. Показатели фагоцитоза у детей в различными нефропатиями.
 А — фагоцитоз (в процентах); Б — ФЧ. 1 — нефриты при гипопластической дисплазии;
А — фагоцитоз (в процентах); Б — ФЧ. 1 — нефриты при гипопластической дисплазии;
- — нефриты без гипопластической дисплазии; 3 — нефропатии, связанные с гипопластической дисплазией; 4 — норма.
По оси ординат — процент от возрастной нормы (М±); по оси абсцисс — классы иммуноглобулинов; 1 — нефропатия, связанная с гипопластической дисплазией; 2 — нефриты при гипопластической дисплазии; 3 — нефриты без гипопластической дисплазии.
Схема 17. Состояние фагоцитирующей системы крови и ГЗТ при хроническом интерстициальном нефрите у детей
[Коровина Н. А., 1982]
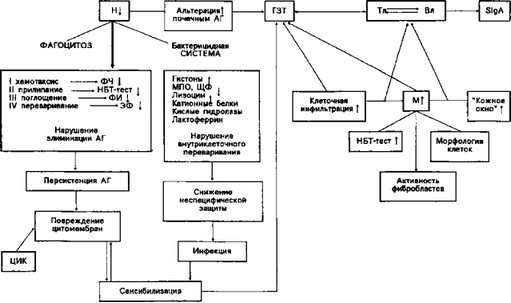
торные заболевания, а проведенные нами совместно с J1. С. Лазовской исследования показали нередкость персистирования вирусов у детей с гипопластической дисплазией. Не исключается роль в качестве антигенов элементов эмбриональной почечной ткани, не элиминированных в эмбриональном периоде в связи с функциональным дефицитом фагоцитирующей системы. Перспективным является поиск этих эмбриональных антигенов как основы для будущих разработок иммунокоррекции. В настоящее время можно лишь отметить, что наряду с возможностями присоединения к гипопластической дисплазии гломерулопатии с IgM-гиперпродукцией нередко наблюдается развитие тубулоинтерстициального нефрита с явлениями ГЗТ. Последнее наиболее типично, как показали исследования Н. А. Коровиной (1982), для различных вариантов почечного дизэмбриогенеза, включая гипо- пластическую дисплазию (схема 17).
В случаях тяжелой структурной аномалии строения почек, которая, как правило, сочетается с анатомическими пороками органов мочевой системы и требует хирургического вмешательства, при наличии грубых недифференцированных структур в почке выявляются отчетливые признаки своеобразной иммунной реакции с преобладанием макрофагов. Эти данные получены Е. К. Баландиной и соавт. (1980) и расцениваются как несостоятельность местной иммунологической системы, причем последнее происходит при наличии парциальных гипоиммунных состояний.
Исследования иммунной системы у детей с различными врожденными и наследственными нефропатиями должны продолжаться. Полагаем, что с появлением возможностей исследования эмбриональных антигенов откроются пути не только к пониманию причин наслоения на недифференцированные почечные структуры микробно-воспалительного процесса и иммунной нефропатии, но открываются перспективы для иммунокоррекции дефектов дизэмбрионального характера.
РЕВМАТИЗМ
Это заболевание стало встречаться в нашей стране реже благодаря проведению широкого комплекса социальных и медицинских мероприятий. Важнейшей предпосылкой успешной борьбы с ним явилось то, что удалось определить главный этиологический фактор ревматизма — гемолитический стрептококк группы А. Именно на этой основе сформировались и оправдали себя в многолетней практике многих стран мира методы первичной и вторичной профилактики ревматизма как у детей, так и у взрослых. Можно говорить и о том, что среди широкого круга ревматических заболеваний ревматизм является единственной болезнью с известным этиологическим фактором. Однако вопросы патогенеза заболевания до сих пор представляют сложнейшую и во многом нерешенную проблему.
Клинически ревматизм у детей является чрезвычайно полиморфным заболеванием — от стертых форм миокардита или случайно выявляемого порока клапанного аппарата сердца до острых генерализованных форм болезни с вовлечением всех оболочек сердца, суставов, нервной системы и сосудов. Клиническое распознавание болезни обычно осуществляется на основе критериев Джонса, недавно модифицированных и дополненных (табл. 32).
При наличии у больного одного основного и двух дополнительных или двух основных критериев диагноз ревматизма считается высоко вероятным при наличии подтверждения перенесенной стрептококко-
Таблица 32. Критерии Джонса для диагностики ревматизма
Дополнительные
Кардит
Полиартрит
Хорея
Кольцевидная эритема Подкожные узелки лихорадка
артралгии
ревматизм в анамнезе или ревматический порок сердца
Лабораторные ускорение СОЭ лейкоцитоз СРБ
удлинение интервала Р — Q
вой инфекции. Наибольшее число диагностических ошибок при ревматизме связано с применением перечисленных критериев при невыполнении основного условия — подтверждения перенесенной стрептококковой инфекции.
Патоморфологическая верификация диагноза «ревматизм» как на аутопсии, так и в последнее время по материалам прижизненной биопсии сердца оказывается вполне возможной, ибо еще одной особенностью ревматизма является возникновение при нем совершенно специфических морфологических изменений в миокарде, никогда не наблюдаемых при других заболеваниях. Представления о морфологической сущности и механизмах формирования ревматической гранулемы чрезвычайно важны для понимания патогенеза ревматизма. Согласно данным О. Saphir (1974), P. Virmani и W. С. Roberts (1977), морфологическими критериями ревматической гранулемы в миокарде являются следующие признаки: форма гранулемы — округлая или овальная; локализация ее только в эндокарде или периваскулярных областях; клеточный состав — кардиогистиоциты (клетки Аничкова, миокардиальные ретикулоциты, клетки Ашоффа), лимфоциты, поли- мофно-ядерные лейкоциты (единичные), тучные клетки (небольшое количество); клетки расположены в несколько параллельных рядов; наличие очагов фибриноидной дезорганизации или некроза (либо того и другого), расположенных между клетками и примыкающих к ним.
Имеются некоторые трудности в дифференцировании ревматической гранулемы от гранулем, возникающих при гиперергическом воспалении и при некоторых сосудистых заболеваниях. Вместе с тем, распознавание ревматической гранулемы, как правило, возможно. При каждом обострении (рецидиве) ревматического процесса возникают новые очаги поражения сердца, которые через несколько стадий гистологической эволюции превращаются в типичную свежую гранулему. Примерно через 6 мес от возникновения атаки (рецидива) коллагеновая ткань гранулемы гиалинизируется и фиброзируется, формируя рубец. Вопрос о происхождении специфических клеток гранулемы — клеток Ашоффа и Аничкова — до сих пор не решен, и это в определенной мере тормозит построение патогенетической концепции ревматизма. Особый интерес представляет точка зрения Н. Н. Аничкова и J. Е. Murphy о мышечном происхождении этих клеток и вторичных изменениях соединительной ткани сердца. Эта концепция не является общепринятой. Важно подчеркнуть, что по классификации D. L. Boros (1980), стрептококковые гранулемы относятся к группе гранулем инородных тел, принципиальным отличием которых является не их неиммунный характер, а связь с токсическим действием возбудителя. Автор считает первичным возникновение под влиянием токсинов стрептококка тканевой деструкции, а вторичным — присоединение иммунных механизмов воспаления. Соотношение же токсического и иммунного механизмов в возникновении ревматической гранулемы пока не установлено. Признавая ее роль в качестве специфического маркера ревматического процесса, большинство клиницистов и морфологов все-
таки не считают гранулематоз основным механизмом поражения сердца при ревматизме. Последнее связывают главным образом с неспе- Цифическим экссудативным воспалением, которое и определяет всю клиническую симптоматику болезни, как со стороны сердца, так и других органов, вовлекаемых в патологический процесс. Именно этим неспецифическим экссудативным воспалением обусловливается и лабораторная картина так называемой активности ревматического процесса. Однако собственно гранулематоз и даже поражение клапанного аппарата могут протекать при минимальной и даже отсутствующей клинической и общепринятой лабораторной симптоматике (латентный ревматизм или ревматизм с минимальной активностью). Это принципиально отличает ревматизм от других ревматических заболеваний. При них обычно степень органного поражения и риск инвалидизации коррелируют с длительностью периодов некупируемой активности процесса.
Иммунологические аспекты проблемы ревматизма можно с полным правом назвать и проблемами инфекционной (в данном случае стрептококковой) иммунологии, и проблемами конституциональной иммунологии.
Стрептококк группы А — этиологический фактор ревматизма. Стрептококк воздействует на организм и многочисленными продуцируемыми им внеклеточными факторами. К ним относятся токсины и ферменты. В частности, это стрептолизины S и О, гиалуронидаза, стрептокиназа, эритрогенный токсин и т. д. Стрептолизин неиммуно- генен, однако он вызывает стойкую активацию Т-лимфоцитов и может быть ответствен за возникновение регуляторных расстройств в иммуногенезе при ревматизме. Стрептолизин-О высокоиммуногенен.
Инфицирование стрептококком и даже перенесенная стрептококковая ангина не являются обязательным причинным фактором для возникновения ревматизма. При спорадических случаях стрептококковой инфекции частота возникновения последнего составляет около
- 1—0,3%, однако при эпидемической ситуации вирулентность стрептококка может существенно увеличиться, и частота ревматизма увеличивается, достигая 2—3%.
Взаимодействие стрептококка и вирусов. В настоящее время роль ассоциации стрептококка и вирусов в этиопатогенезе ревматизма рассматривается некоторыми исследователями как отражение эволюци- онно сложившегося биоценоза [Казначеев В. П., Яворская В. Е., 1985]. Показано, что при ревматизме в ткани сердца нередко обнаруживаются вирусы Коксаки А-13 и А-18. Эти вирусы хорошо сорбируются на клеточной оболочке стрептококка и при этом могут сохраняться намного длительнее, чем в отсутствие микроба. Соответственно, нельзя исключить возможного дополнительного повреждения кардиомиоци- тов при наличии такой ассоциации у больного. И. М. Ганджа и соавт. (1984) считают, что многие хронические инфекции, в том числе и латентно текущие, равно как и вирусная инфекция, предшествующая стрептококковой, могут изменить состояние иммунорегуляторных кле
ток, в частности вызвать функциональную депрессию Т-супрессоров и тем самым участвовать в возникновении аномального ответа на стрептококк ревматизма.
Значение локализации стрептококка в патогенезе ревматизма. Одно из важных положений патогенеза заключается в том, что именно локализация инфекции в носоглотке и регионарных лимфатических образованиях может создавать риск возникновения ревматизма. В настоящее время имеется несколько объяснений этого факта, но они не являются исчерпывающими. Во-первых, избирательная тропность стрептококка к эпителию, определяемая свойствами липотейхоевой кислоты, содержащейся в его оболочке. Во-вторых, специфические особенности иммунологического ответа на стрептококковую инфекцию в носоглотке. Так, после перенесенного ребенком стрептококкового назофарингита закономерным является значительное нарастание титра антител к стрептолизину-О, чего, как правило, не наблюдается при кожных воспалительных процессах, вызванных теми же штаммами возбудителя. Это определяется тем, что выделяемый кожным стрептококком стрептолизин-О прочно связывается липидами кожи. В-третьих, имеется непосредственная связь слизистой оболочки верхних дыхательных и лимфоидных образований кольца Вальдейера и сердца по лимфатическим путям. Эта связь обусловливает возможность прямого попадания в оболочки сердца и даже непосредственно в клапанные структуры как внеклеточных продуктов стрептококка, так и компонентов его оболочки и мембран, равно как и иммунных комплексов, включающих эти продукты и компоненты. Высказывается предположение, что патологическая нервная импульсация, исходящая из миндалин и носоглотки, при остром и хроническом воспалении может быть причиной нейрогенной дистрофии миокарда и способствовать поражению сердца комплексом факторов, зависящих от стрептококковой инфекции.
Персистирование стрептококковой инфекции как существенный компонент патогенеза ревматизма. Имеются многочисленные исследования, показывающие, что при ревматизме частота выделения из зева Р-гемолитического стрептококка группы А при остром течении болезни приближается к 100% и имеет лишь незначительную тенденцию к снижению при стихании процесса. Только многолетней целенаправленной бициллинопрофилактикой можно добиться снижения частоты носительства стрептококка до уровня, определяемого у здоровых людей. Выделение стрептококка из крови больных ревматизмом в доантибиотическом периоде, по данным В. А. Башенина и А. И. Белкина (1930), Н. Д. Стражеско (1934), достигало 70%, в последние же годы стало редкой находкой. Несколько чаще выделяются L-формы стрептококка, отношение которых к патогенезу ревматизма остается дискутабельным. Вместе с тем, работы Н. А. Ардаматского (1983) показали, что с применением современной электронно-микроскопической техники микробные клетки, морфологически идентичные стрептококку, могут быть выявлены у значительной части больных ревма
тизмом как в периферической крови, так и в тканях. При этом морфологически различаются как обычные стрептококки, так и L-формы и клетки-ревертанты, т. е. клетки, трансформирующиеся из L-форм в обычные. Разнообразие клинических проявлений ревматизма Н. А. Ардаматский связывает в определенной мере и с формой возбудителя. Такая предельно четкая концепция ревматизма как хронической генерализованной стрептококковой инфекции в настоящее время не разделяется большинством исследователей, однако с доказательствами существования хронического инфекционного процесса стрептококковой этиологии соглашаются все ревматологи. Различие существует в расстановке акцентов на непосредственном распространении возбудителя в организме или на ограниченном (очаговом) характере инфекции, при котором патогенез и клинические особенности ревматизма определяются уже не столько деятельностью микроба, сколько характером ответных реакций организма на микроб. В иммунологических исследованиях, проводимых в ревматологической клинике, наиболее убедительным подтверждением длительного персистирования стрептококковой инфекции являются данные по частоте выделения у больных из периферической крови стрептококковых антигенов. Причем, если при острых стрептококковых заболеваниях антиген исчезает из крови больных уже через 2—3 нед, то при ревматизме он может определяться не только в период активности, но и в межприступном периоде. В работах, выполненных В. В. Юрьевым (1980), частота выявления стрептококкового антигена при первой атаке с поражением сердца составляла 52%, а при динамическом наблюдении через 5 нед и более от начала заболевания снижалась очень незначительно и независимо от применяемого лечения. Развитием этой работы явилось исследование свободного и связанного в иммунном комплексе стрептококкового антигена, выполненное JI. И. Моногаровой (1984). При исследовании свободного стрептококкового антигена частота его обнаружения составила только 28,6%; однако используя метод диссоциации иммунных комплексов, автор получила подтверждение стрептококковой антигенемии у 73,8%, а при затяжном течении — у 92% больных.
Выявление стрептококкового антигена не имеет диагностического значения при ревматизме, отражает только факт переносимой стрептококковой инфекции. В. В. Юрьев (1980) находил стрептококковый антиген у больных хроническим тонзиллитом и при ряде других заболеваний пограничной с ревматизмом группы значительно выше, чем при ревматизме. Патогномоничным для ревматизма является именно факт длительного сохранения антигенемии нередко даже при санированных очагах инфекции в носоглотке. Следует полагать, что зависимость антигенемии ot длительности антйбиотикотерапии и пеницил- линопрофилактики подтверждает ее связь с активной стрептококковой инфекцией у больных ревматизмом и, следовательно, наличие у этих больных особенностей иммунологической реактивности, предрасполагающих их к высокой чувствительности и длительному персистирова- нию стрептококковой инфекции.
Противострептококковые антитела как признаки персистирования инфекции. Антитела к полисахаридному антигену стрептококка, анти- стрептолизину-О, антистрептогиалуронидаза, антистрептофибриноли- зин выявляются при ревматизме с такой же и даже большей частотой, чем свободный полисахаридный антиген стрептококка. Наиболее стандартизированным в настоящее время является определение антител к стрептолизину-О. Закономерное повышение титров антистрептолизи- на при стрептококковой инфекции носоглотки и при ревматизме послужило основанием для того, чтобы включить данные этого исследования в диагностические критерии ревматизма.
По данным В. В. Юрьева (1980), при первой атаке ревматизма случаи обнаружения различных противострептококковых антител составляют: к полисахаридному антигену 72%, к антистрептолизину-О 84%, к антистрептогиалуронидазе 83%, к антифибринолизину 74%, к антидезоксирибонуклеазе А 28%, к антидезоксирибонуклеазе В 35%, к антидезоксирибонуклеазе С 22%.
Титр антител к групповому полисахаридному антигену выявляет тесную связь с активностью ревматического процесса. При максимальной степени активности имеют место и самая большая частота обнаружения этих антител (93—100%), и набольшие их титры. По мере затихания активности процесса у детей с первичным ревматизмом титры антител существенно снижаются, и частота их выявления составляет 55—60%, а при рецидивах — до 71%. Уже имеются многочисленные литературные данные о стойкости выявления противострептококковых антител этого типа у детей, больных ревматизмом. Независимо от рецидивирования процесса или его латентного прогрессирования умеренные титры антител к полисахаридному антигену могут быть выявлены и через 2—3 года и даже через 25 лет после перенесенной атаки [Kaplan, 1978]. Несмотря на тесную связь выявления противострептококковых антител у детей в ревматизмом, диагностическое использование этих лабораторных тестов ограничено, так как они дают положительные результаты при различных острых стрептококковых заболеваниях, хотя сроки выявления антител при всех заболеваниях, кроме ревматизма, обычно очень непродолжительны — не более 3 нед. Обнаружены антитела к отдельным антигенам стрептококка у новорожденных детей и даже у плодов незадолго до рождения. Спектр антител у ребенка в этих случаях полностью определялся спектром антител, выявленных у матери.
Клеточная гиперчувствительность к стрептококку. У детей, больных ревматизмом, клеточная гиперчувствительность к антигенам стрептококка может быть выявлена как методом кожных проб, так и посредством лабораторных тестов в реакциях бласттрансформации лимфоцитов или торможения миграции лейкоцитов. История изучения кожных проб при стрептококковых заболеваниях берет свое начало в работах И. А. Вержиковского и О. М. Константиновой и соавт. (1936). По данным В. И. Иоффе (1963), придававшего большое значение кожным пробам, положительная реакция на введение внутрикожно
стрептококкового аллергена имела место у 39—45% больных ревматизмом. Важно, что по мере стихания атаки ревматизма у многих больных наблюдалось нарастание интенсивности кожных проб со стрептококковым аллергеном. В работе В. И. Беляковой (1973), проведенной с использованием стрептококкового аллергена, положительные и резкоположительные кожные реакции были получены у 54% детей с ревматизмом в активной фазе и у 23% больных ревматизмом в неактивной фазе. В. И. Пуринь (1977) показал тесную корреляцию между выраженностью кожных проб на стрептококковый аллерген и интенсивность включения тимидина-Н3 в ДНК лимфоцитов под влиянием стрептококкового аллергена. Высокие индексы стимуляции наблюдались у 42% детей с ревматизмом III степени активности и у 27% детей с неактивной фазой ревматического процесса. Параллелизма между выраженностью бластной трансформации лимфоцитов и титрами ACJIO не определялось, что говорит о формировании у отдельных больных преимущественно клеточной гиперчувствительности, а у других — гуморального ответа на инфекционный агент. В ряде зарубежных исследований показано, что клеточные реакции на стрептококк могут быть обусловлены неспецифическим митогенным эффектом S-стрептолизиноподобных веществ стрептококков [Taranta А., 1969]. С. И. Рид и Дж. Б. Забриски (1984), используя методику торможения миграции лейкоцитов на очищенные препараты мембран и клеточных оболочек стрептококка, получили убедительные данные о наличии у больных ревматизмом клеточной гиперчувствительности к антигенам клеточных мембран стрептококка. Авторы подчеркивают, что сенсибилизация к мембранным антигенам сохраняется до 5 лет после перенесенной атаки ревматизма без каких-либо клинических или лабораторных признаков случайной стрептококковой инфекции или рецидива ревматизма. Только более чем через 5 лет отмечается угасание клеточной гиперчувствительности. Такая стойкость реакции не наблюдалась при неосложненной стрептококковой инфекции. Важно, что не обнаружено различий в характеристиках клеточной гиперчувствительности по отношению к антигенам оболочек стрептококка при ревматизме и острой стрептококковой инфекции.
В последние годы особенно пристально изучаются функции «эф- фекторных клеток», в частности полиморфно-ядерных лейкоцитов и моноцитов. Эти клетки играют решающую роль как в собственно иммунологической реакции на бактериальный антиген на этапах ее включения и регулирования, так и в реализации иммунного воспаления и элиминации антигена. Pena Sanchez de Rivera и соавт. (1985) показали гиперреактивность этих клеток по отношению к стрептококковому антигену, а в работе, выполненной В. И. Макаровой (1986), выявлено принципиальное отличие реакции эффекторных клеток на стрептоли- зин-О у больных острой стрептококковой инфекцией и ревматизмом. У первых отмечалось весьма умеренное изменение величин хемотак- сической активности полиморфно-ядерных лейкоцитов на стрептоли- зин-О, в то время как при ревматизме у детей происходило сущест-

 исследование I
исследование I
» II
» III
Ревматизм неактивный общая группа через 2 года и более
венное нарастание величин хемотаксического индекса по отношению к стрептолизину-О 6 динамике ревматической атаки. Более того, максимальные величины этого индекса у больных ревматизмом закономерно определялись уже в неактивной фазе болезни, нередко более чем через 2 года после стихания клинико-лабораторных проявлений активности заболевания (табл. 33).
Приведенные выше данные свидетельствуют как о длительном персистировании в организме компонентов стрептококковой инфекции, так и о стойкости изменений иммунологического ответа на эти компоненты. Все это имеет прямое и непосредственное отношение и к патогенезу, и к нозологической сущности ревматизма. Можно предположить, что и персистирование антигенов, и аномальная реакция ца эти антигены стрептококка имеют в основе единый иммунологический механизм, а сравнительная редкость возникновения ревматизма после перенесенной стрептококковой инфекции и семейное «накопление» случаев болезни говорят в пользу наследственной природы и конституциональной обусловленности этого механизма. Можно назвать этот феномен аномалией конституции или «стрептоаллергичес- ким диатезом». Некоторым подтверждением правомочности такого предположения являются и отдельные исследования, показавшие ассоциацию между антигенами системы HLA и особенностями ответа на стрептококковую инфекцию, или возникновением ревматизма. Так, антигены HLA-B5, Bw-35, В-7, В-18 у больных ревматизмом обнаруживаются чаще, чем при других заболеваниях. Высказывается предположение, что в генотипе лиц, предрасположенных к ревматизму, отсутствуют 1г-гены, контролирующие иммунный ответ на стрептококковый антиген [Sentner D., Freimer Е. Н., 1984].
Острота течения и активность процесса, по клинико-лабораторным данным, коррелировали с более высокими показателями синтеза ДНК
в нестимулированных культурах, что связано с активизацией системы гуморального иммунитета. Необходимо отметить, что эта корреляция наблюдалась только в осенне-зимнее время, в весеннее же время она отсутствовала и результаты, полученные в группе больных, практически не отличались от таковых в группе здоровых детей. Показатели синтеза РНК в нестимулированных клетках не коррелировали с остротой и активностью ревматического процесса [Пуринь В. И., Назаров П. Г., 1977].
Изучение реактивности лимфоцитов при стимуляции ФГА. Согласно установившимся представлениям, чувствительность лимфоцитов к ФГА отражает активность этих клеток. Лимфоциты больных ревматизмом, независимо от его формы, отличаются значительно более высокой реактивностью в отношении неспецифического митогена ФГА, чем клетки здоровых детей. Отмеченная особенность реактивности больных ревматизмом не свойственна исключительно этому заболеванию, а отмечена и при тонзиллитах, и в период реконвале- сценции при острых респираторных заболеваниях. Таким образом, эти данные указывают на безусловную неспецифичность изучаемого феномена. Особенностью ФГА индуцированного синтеза ДНК в отличие от «спонтанного» синтеза ДНК в лимфоцитах является относительная стабильность в разные сезоны года.
Изучение показателей реакции лимфоидных клеток на ФГА у больных ревматизмом в зависимости от степени активности процесса не выявило существенных различий между группами при первом обследовании. Обращала на себя внимание высокая частота выявления более интенсивного синтеза ДНК в клетках больных по сравнению со здоровыми детьми. Эти изменения наблюдались значительно чаще, чем превращения обычно используемых критериев активности процесса (СОЭ, лейкоцитоз, протеинограмма, антистрептолизин-О, СРБ), что позволило с большей вероятностью дифференцировать больных с минимальной активностью процесса от здоровых детей.
При анализе показателей ФГА индуцированного синтеза ДНК в лимфоцитах при различных клинических проявлениях поражения сердца отмечено усиление интенсивности синтеза ДНК в клетках по мере увеличения выраженности признаков поражения сердца. Возможно, это отражает связь активации лимфоидных клеток с развитием патологического процесса в тканях сердца.
Одна из практических возможностей использования указанного теста вытекает из относительной стабильности повышенных показателей в период затихания атаки ревматизма. Высокие показатели синтеза ДНК наблюдались у 65% больных детей. Относительная частота высоких значений индуцированного синтеза ДНК в 3,7 раза превосходила частоту патологических отклонений по общепринятым лабораторным данным.
Принципиально важной характеристикой ревматизма является иммунопатологический процесс в тканях сердца. Широко обсуждается роль циркулирующего сердечного антигена и антикардиальных анти-
Таблица 34. Показатели иммунопатологического процесса у больных с первой атакой ревматизма и пограничными состояниями (процент положительных реакций)
|
Нозологические формы |
Антикардиальные антитела |
Сердечный антиген |
|
|
метод Штеффена |
метод Каплан |
||
|
Первая атака без клинического пораже |
58 |
68 |
28 |
|
ния сердца |
|
|
|
|
Первая атака с поражением сердца |
48 |
68 |
52 |
|
Инфекционно-аллергический полиартрит |
52 |
70 |
20. |
|
Ревматоидный артрит |
36 |
50 |
19 |
|
Инфекционно-аллергический миокардит |
68 |
97 |
79 |
|
Тонзиллогенная интоксикация |
15 |
33 |
30 |
|
Контрольная группа |
5 |
4 |
5 |
тел. В табл. 34 приведены данные по частоте их обнаружения в различных группах больных.
Наиболее убедительны различия в частоте обнаружения показателей иммунопатологического процесса во всех группах больных по сравнению с контрольной группой детей, где показатели иммунопатологического процесса оказывались положительными, не более чем у 4% детей. Необходимо также подчеркнуть существующую разницу в частоте обнаружения показателей аутосенсибилизации при тонзилло- генной интоксикации и, в меньшей степени, — при ревматическом артрите у других групп больных. Близкие показатели аутосенсибилизации при таких клинических формах, как ревматизм, инфекционноаллергические миокардиты и полиартриты, оказываются несколько неожиданными. Попытки объяснить эти данные разной активностью патологического процесса оказались неудачными, так как в отличие от показателей серологических реакций на антигены стрептококка не ¦выявлено определенной связи между частотой обнаружения показателей иммунопатологического процесса и активностью ревматизма.
Циркулирующие иммунные комплексы. По данным JI. И/ Мокога- ровой (1984), при ревматизме циркулирующие ИК, выявляемые анти- геннеспецифическими методами, найдены более чем в половине случаев (59,6% — по тесту антикомплементарной активности сыворотки и 54,1% — по тесту ингибиции рилизинг-фактора). Средний уровень комплемента при ревматизме не имел отличия от нормальных показателей, тем не менее у 13% больных он оказался ниже минимальной нормы. Частота выявления свободного стрептококкового антигена составила 28,6%, антистрептококковые антитела найдены в 40,6% случаев. Таким образом, подтвердить серологически стрептококковую инфекцию удается не у всех больных. Диссоциация ИК показала, что большая часть антигенов и антител связана в комплексы: после обработки сывороток цистеином частота выявления стрептококкового антигена возросла почти в 2 раза; антиген обнаруживался у 73,8% больных. Свободный сердечный антиген обнаружен у 40% больных; у 26,3% найдены ИК с этим антигеном.
При сопоставлении двух антигеннеспецифических методов определения циркулирующих ИК корреляция между ними не обнаружена, что свидетельствует о выявлении этими методами разных по природе ИК. Сопоставление тестов ингибиции РФ и антикомплементарной активности сыворотки с антигенспецифическими методами показало наличие положительной корреляции антикомплементарной активности с выявлением стрептококковых ИК.
Тест ингибиции РФ имел слабую положительную корреляцию с выявлением ИК с сердечным антигеном; в 80% случаев выявления сердечных ИК этот тест был положительным. Вероятно, антикомпле- ментарная активность определяет в основном ИК с чужеродным, микробным антигеном; положительный тест ингибиции РФ свидетельствует скорее о наличии тканевых ИК.
Уровень и частота выявления циркулирующих ИК по антикомплементарной активности сыворотки имеют высокодостоверную положительную связь со степенью активности ревматического процесса, оцененной по клинико-лабораторным данным на каждый момент иммунологического исследования. Очевидно, циркулирующие ИК относятся к факторам, сопровождающим или даже вызывающим активацию воспалительных реакций организма. Обнаружение циркулирующих ИК при наличии измененных общеклинических показателей активности не несет дополнительной информации.
Клинико-иммунологические сопоставления при ревматизме с разной степенью поражения сердца показали отсутствие корреляции с уровнем свободного сердечного антигена. Он является с одинаковой частотой как при мио- и эндомиокардитах, так и при ревматизме без поражения сердца. Это может гово
А так же в разделе «Почечные дисплазии »
- Рецидивирующие и хронические заболевания легких
- Нарушения иммунитета и острые респираторные заболевания
- ИММУНОПАТОЛОГИЯ ПРИ ЗАБОЛЕВАНИЯХ ПОЧЕК
- Основные типы иммунопатологических проявлений
- Образование антител к базальным мембранам
- Образование ИК и поражение почек (ИК-нефрит)
- Система комплемента при воспалительных заболеваниях почек на иммунной основе
- Нарушения гемостаза при нефритах
- Особенности иммуногенеза при нефротическом синдроме
- Терапия иммунных гломерулопатий
- Иммунопатологические характеристики тубулоинтерстициального нефрита
- Пиелонефрит
- ГЛАВА 10 ЮВЕНИЛЬНЫЙ РЕВМАТОИДНЫЙ АРТРИТ