Взаимосвязь анемии с хроническими инфекционными (туберкулез, гепатит и др.), ревматическими заболеваниями, другими воспалительными процессами описана более 150 лет назад. Для характеристики таких анемий
в литературе используются термины: хроническая анемия, анемия воспаления и анемия хронических заболеваний. Наиболее частым и устоявшимся термином является «анемия хронических заболеваний» (АХЗ). Анемия часто сопровождает и неинфекционные воспалительные заболевания кишечника, соединительной ткани, множественную миелому и другие злокачественные новообразования. АХЗ занимает по распространенности второе место после железодефицитной анемии.
В 1945 г. G.E. Cartwright, М.М. Wintrobe провели серию экспериментальных исследований у животных и человека и охарактеризовали клинические и биохимические признаки АХЗ. Анемия обычно носит нормохромный нормоцитарный характер, однако гипохромия встречается так же часто, и иногда анемия становится микроцитарной гипохромной. АХЗ постоянно сопровождается нарушением метаболизма железа: гипоферремией, некоторым снижением концентрации трансферрина в крови и повышением ферритина как в крови, так и в органах и тканях.
В настоящее время рассматриваются следующие патофизиологические факторы, участвующие в развитии АХЗ:
- влияние провоспалительных цитокинов,
- воздействие гепсидина,
- низкая продукция эритропоэтина,
- ингибиция эритропоэза,
- укорочение продолжительности жизни эритроцитов.
Активация иммунной системы при воспалительных, инфекционных и некоторых онкологических заболеваниях антигенными факторами индуцирует синтез провоспалительных цитокинов (ИЛ-1, ФНО-а, ИЛ-6), интерферонов.
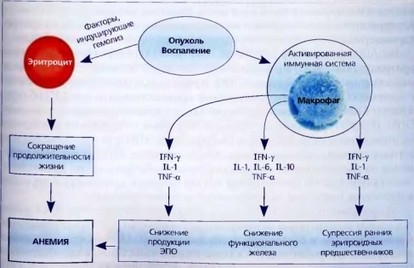
Рис. 49. Схема патогенеза анемии хронических заболеваний
ИЛ-6 является основным индуктором синтеза гепсидина в печени, котоый значительно повышается независимо от состояния эритропоэтичессои активности и изменений в обмене железа. Гепсидин является негативим регулятором как выведения железа из макрофагов, так и всасыванияже- леза в тонком кишечнике. Результат действия гепсидина - блокада жееза в клетках СМФ, гепатоцитах и энтероцитах, нарушение передачи жееза трансферрину и быстрое развитие гипоферремии. Механизм ингибщии выведения железа из клетки связан с образованием комплекса гепсидда - ферропоргин (клеточный транспортер железа, участвующий в передач! его из клетки плазменному трансферрину) и последующим его расщеплешем. Сходный механизм взаимодействия гепсидин - ферропортин приводи к снижению всасывания железа в тонком кишечнике, что может привести к снижению запасов железа, однако это встречается очень редко, напримерпри ювенильном ревматоидном артрите, при котором отмечается значитаьно повышенный синтез ИЛ-6.
В норме ежедневно около 20 мг железа поступает в плазму крови,связывается с трансферрином и большая часть его доставляется эритроидным клеткам костного мозга для синтеза гемоглобина. Так как всасывание железа и мобилизация его из депо нарушены, а клетки в костном мозге продоша- юг расходовать железо на свои нужды, то плазменный пул железа бьстро истощается, вызывая гипоферремию. При продолжительной гипоферр(мии развивается железодефицитный эритропоэз, одной из характеристик котфого является повышение концентрации протопорфирина в эритроцитах.
Таким образом, каскад событий, который приводит к развитию АХЗ. сводится к следующему: действию ИЛ-6 на избыточный синтез гепсидинц нарушению метаболизма железа (гипоферремия, гиперферритинемия, изблток железа в макрофагах тканей и органов), развитию перераспределителшого или функционального дефицита железа, снижению доставки железа к эртгро кариоцитам костного мозга, нарушению эритропоэза и развитию анеши.
Ряд цитокинов (ИЛ-1, ФНО-а, ТФР-р) подавляют экспрессию гена эритропоэтина (ЭПО) в клетках почек и печени, у больных АХЗ отмечются неадекватно низкая продукция ЭПО. Кроме того, в экспериментальных исследованиях показано, что эритроидные предшественники при АХЗ обнаруживают в некоторой степени резистентность к пролиферативному действию ЭПО. Ингибиторный эффект провоспалительных цитокинов на эритропоэз не ограничивается их действием на продукцию ЭПО и на чувствительность к этому гормону, доказано прямое супрессирующее воздействие ряда дито кинов на пролиферацию эритроидных клеток костного мозга. Кроме того, экспериментальные исследования in vitro показали прямое ингибирующее воздействие гепсидина на эритроидное колониеобразование.
Укорочение продолжительности жизни эритроцитов при АХЗ ранее объясняли воздействием активированных макрофагов, которые избыточно фагоцитировали и секвестрировали эритроциты. Однако незначительная деструкция эритроцитов при АХЗ сама по себе недостаточна для объяснения развития анемии, т. к. костный мозг при необходимости может увеличить продукцию эритроцитов в 6-8 раз. Эти данные свидетельствуют о том, что
при АХЗ пролиферативная активность костномозговых эритроидных клеток нарушена. Повышенный гемолиз эритроцитов при АХЗ связывают с действием ИЛ-1 и ФНО-а.
Таким образом, патогенез АХЗ достаточно сложный, в котором участвуют различные механизмы, ведущими из которых являются воздействие гепси- дина и провоспалительных цитокинов (рис. 49).
Лабораторные показатели. У больных с анемией хронических заболеваний костный мозг характеризуется нормальным или сниженным, реже повышенным количеством эритрокариоцитов, повышенным содержанием сидеробластов и макрофагов с гранулами гемосидерина. Возможно обнаружение эритрофагоцитоза.
Периферическая кровь. Чаще анемия при АХЗ нормохромная нормо- цитарная, реже умеренно гипохромная или гипохромно-микроцитарная (рис. 50).
Число ретикулоцитов нормальное или снижено, ретикулоцитарный индекс продукции снижен, что отражает сниженную пролиферативную активность костного мозга. Повышен уровень протопорфирина в эритроцитах.
Изменения метаболизма железа характеризуются перераспределительным дефицитом железа (снижение сывороточного железа, ОЖСС, трансферрина, НТЖ и повышение содержания сывороточного ферритина). Ферритин относится к острофазным белкам, поэтому повышенный уровень сывороточного ферритина при АХЗ может отражать не только запас железа в организме, но и явиться проявлением острофазного ответа, что ограничивает его использование в качестве показателя определения запасов железа. В большинстве случаев АХЗ повышены и другие белки острой фазы. Количество sTfR остается стабильным при воспалительных процессах (табл. 10).
Дифференциальная диагностика АХЗ и ЖДА основана на комплексном исследовании обмена железа, острофазных белков, растворимых рецепторов к трансферрину и в последнее время — гепсидина в моче, концентрация которого повышена при АХЗ (табл. 11). Ошибочная диагностика ЖДА может повлечь за собой назначение препаратов железа (парентерально) с развитием вторичного гемосидероза.
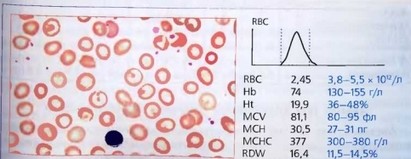
Рис. 50. Периферическая кровь при АХЗ. Нормохромная нормоцитарная анемия. Видны единичные мишеневидные эритроциты и стоматоциты. хЮОО
Лабораторные показатели при некоторых хронических заболеваниях
|
Показатели |
Острое и хроническое воспаление |
Заболевания почек |
Эндокринные заболевания |
|
MCV (фл) |
75-90 |
80-90 |
80-105 |
|
Полихромазия |
Нет |
Нет |
Нет |
|
Ретикулоцитарный индекс продукции |
lt;2 |
lt;2 |
lt;2 |
|
Костномозговой индекс Лейко/Эритро |
3:1 |
3:1 |
3:1 |
|
Запасы железа в КМ |
Повышены |
Норма |
Норма |
|
Ферритин сыворотки |
Повышен |
Норма |
Норма |
Примечание. MCV - средний объем эритроцитов, КМ - костный мозг.
Таблица 11
Дифференциальная диагностика анемии хронических заболеваний и железодефицитной анемии
|
|
О |
§ |
MCV |
1 |
мснс |
RDW |
Б-н til а; |
Эритрокариоциты, к/м |
? |
Трансферрин |
НТЖ |
Ферритин |
со |
ФИО (TNF), ИЛ-6 |
Гепсидин |
|
ЖДА регенераторная стадия |
N |
1 |
1 |
1 |
1 |
4 |
N |
Т |
1 |
т |
4 |
4 |
4 |
N |
4 |
|
ЖДА гипорегенераторная стадия |
1 |
1 |
I |
1 |
1 |
1 |
1 |
1 |
1 |
т |
4 |
4 |
Т |
N |
4 |
|
Анемия хронических заболеваний |
1 |
1 |
N |
N |
N |
N |
1 |
1 |
1 |
J./N |
4 |
|/N |
N |
! |
Т |
