Мембрана эритроцитов в качестве структурной основы, как и другие биомембраны, имеет бислой фосфолипидов, в котором встроены белки.
Внутренняя сторона мембраны эритроцитов связана с сетью миофиламент- ных белков, формирующих цитоскелет и придающих эритроциту в покое специфическую двояковогнутую форму (рис. 76).
Структурная организация мембраны эритроцита позволяет этой клетке быть, с одной стороны, высокоэластичной (примерно в 100 раз более эластичной, чем латексная пленка той же толщины), с другой стороны, выдерживать очень высокие нагрузки без фрагментации. Специальное строение амфифильных липидов (растворимы в полярных и неполярных растворителях) позволяет встраиваться в мембрану белкам, которые формируют эластичный цитоскелет, деформируемый в 2 направлениях - трансмембранно и вдоль мембраны (рис. 77).
Липидный бислой эритроцитарной мембраны содержит в эквивалентных количествах холестерин и фосфолипиды. Фосфолипиды расположены асимметрично: фосфатидилхолин и сфингомиелин предпочтительно представлены на наружной стороне, тогда как большая часть фосфатидилэтаноламина и весь фосфатидилсерин и фосфоинозитиды - на внутренней стороне бислоя. Именно фосфатидилсерин и фосфоинозитиды способны взаимодействовать с белками цитоскелета - спектрином и белком 4.1R. Нарушение асимметричности и выход фосфатидилсерина на наружную сторону мембраны приводят к фагированию эритроцитов макрофагами. Описано более 50 трансмембранных белков, около 25 из которых связаны с групповой принадлежностью.
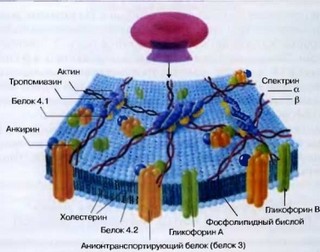
Рис. 76. Схематическое изображение внутренней стороны мембраны эритроцита с сетью миофиламентных белков, формирующих цитоскелет. Фосфолипиды образуют асимметричную бислойную мембрану, холестерин растворен между хвостами жирных кислот, придавая определенную жесткость мембране. Гликофорин А и В — трансмембранные гликопротеины, определяющие антигенные и рецепторные свойства мембраны эритроцитов. Белок 3 — анионт- ранспортирующий белок, к нему со стороны цитозоля ассоциирован белок 4.2 и НЬ. Спектрин, актин и тропомиозин формируют цитоскелет на внутренней стороне. Спектрин — гетеродимер, имеет а- ир-цепи. Анкирин связывает белок 3 с цитоскелетом
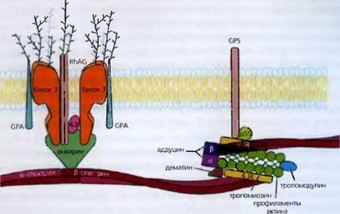
Рис. 77. Мембрана эритроцита (по X. Ап, N. Mohandas) построена из амфифильных липидов, в которую встроены белки, формирующие поперечную эластичную ось из p-спектрина, анкирина, белка 4.2, белка 3 и комплекса Rh. Продольную (латеральную) эластичную ось формируют а- и p-спектрины и комплекс сократительных белков, сопряженный с гликофорином С. Такое строение позволяет эритроциту выдерживать разные нагрузки и деформироваться как в продольном, так и поперечном направлении
Ряд белков определяет проницаемость мембраны для катионов, воды, мочевины и др. метаболитов. Структурными белками, обеспечивающими связь с внутренними белками цитоскелета, являются белок 3, гликофорин С и Rh-антигены. Основными белками цитоскелета являются а- и Р-спектрины, актин, белок 4.1R, аддуцин, дематин, тропомиозин и тропомодулин. Принципиальным моментом в поддержании специфической формы эритроцита является взаимодействие белков внутреннего цитоскелета с мембранными белками и фосфолипидами.
При патологии белков и связей между элементами цитоскелета нарушается форма эритроцита, что может сопровождаться развитием овалоцитоза (эллиптоцитоза), сфероцитоза, стоматоцитоза, акантоцитоза. Описано до 20 различных аномалий белков мембраны.
